B4
목차
- 1 프로젝트 개요
- 2 서론
- 2.1 개발 과제의 개요
- 2.2 관련 기술의 현황
- 2.2.1 관련 기술의 현황 및 분석(State of art)
- 2.2.2 특허조사
- 2.2.3 특허전략
- 2.3 개발과제의 기대효과
- 2.4 기술개발 일정 및 추진체계
- 3 설계
- 4 결과 및 평가
- 5 참고 문헌
프로젝트 개요
기술개발 과제
국문 : 핵산 기반 입자의 효과적인 면역 반응 유도를 위한 마이크로-디스크 구조 제작
영문 : Fabrication of micro-disk structure for inducing effective immune response by nucleic aicd-based particles
과제 팀명
B4
지도교수
이종범 교수님
개발기간
2020년 9월 ~ 2020년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20173400** 윤*정(팀장)
서울시립대학교 화학공학과 20163400** 배*재
서울시립대학교 화학공학과 20143400** 김*현
서울시립대학교 화학공학과 20163400** 이*현
서론
개발 과제의 개요
개발 과제 요약
- 핵산(Nucleic acid)을 이용한 micro-pattern disk 제작 시 핵산 입자의 효과적인 면역 반응을 위한 입자의 크기와 농도를 알아보고 disk의 향후 application을 위한 연구를 수행하는 것이 이 프로젝트의 목적이다. Gene therapy란 유전자를 이용하여 환자의 유전자부터 세포 단계, 혹은 그 이상까지를 조절하여 질병을 치료 및 완화시키는 치료법을 의미하며 생체적합성이 좋은 유전자를 이용하여 면역관련질환, 바이러스 관련질환 등을 치료할 수 있다는 점에서 주목 받고 있는 치료법이다. Cancer therapy, Immune therapy, Human-safe antiviral agent가 있으며, 이 중 Immune therapy를 목적으로 목표 유전자를 면역세포까지 안전하게 전달할 수 있다면 암에 대항하는 면역력을 높임으로써 암 치료 효능을 획기적으로 증대하고, 암이 완치된 이후 재발 방지에도 큰 효과를 보이는 것을 기대하여 본 과제를 수행한다.
- 핵산은 고분자로서 가지는 여러 이점(서열 특이성을 이용한 설계, 생체 내 저독성, 생분해성)들로 인해 새로운 생체 재료로써의 가능성을 인정받고 있지만 안정성이 다소 떨어진다는 것이 단점이다. 이에 대한 보완책으로 RCR(Rolling Circle Replication) 방식을 통해 핵산을 입자화하고 더 나아가 물리적인 힘으로 입자를 압축해 안정성을 더 높이기 위한 마이크로 디스크 구조를 개발하였다. 핵산 입자로 마이크로 디스크구조를 제작하고 이의 안정성과 다양한 응용에 대한 실험을 수행하는 것과 특히 핵산 중 CpG 서열을 가지는 DNA가 면역 효과에 뛰어나다고 알려져 있어 CpG DNA를 마이크로 디스크 구조로 제작해 면역제로 사용하기 위한 최적화 조건을 찾는 것이 이번 프로젝트의 목표이다.
개발 과제의 배경 및 효과
Gene Therapy[1][2][3][4]
- Gene therapy란, 유전자를 이용하여 환자의 유전자부터 세포단계 혹은 그 이상까지를 조절하여 궁극적으로 질병을 치료 및 완화시키는 치료법을 의미한다. 생체적합성이 좋은 유전자를 이용해 암이나, 면역관련질환, 바이러스 관련질환 등을 치료할 수 있다는 점에서 주목받고 있는 치료법이다. 약물을 활용한 항암치료는 chemical drug, protein drug, gene drug 순으로 발달해왔다.
- 1세대 항암제인 화학치료제(Chemical drug)는 감염, 악성 종양, 자가 면역 질환의 치료에 사용된다. 특정 종류의 생물에게만 치명적인 독성을 발휘하도록 하는 성질을 목표로 두고 있다. 본래 화학요법은 항암제 개발의 목표로 시작된 것은 아니다. 제 1차 세계 대전 때 사용된 NH3, NH2 가스를 제 2차 세계 대전을 치루는 동안 군사적 목적으로 연구하던 중, 가스에 노출된 사람들의 백혈구 수가 감소하였다. 이러한 사실에 과학자들은 노출된 가스 정상과는 다르게 신속히 분열하는 백혈구와 유사한 암세포에도 유사한 효과를 나타낼 것으로 생각하였다. 이러한 이론을 바탕으로 1942년, 림프종 환자에게 NH3, NH2 가스를 정맥에 주사한 것을 시작으로 발달되어 왔다. 화학 치료제는 현재 대부분의 환우들이 받고 있는 치료로 암세포뿐만 아니라 정상세포까지 공격해 여러 가지 부작용을 일으킨다. 화학 약물의 예시로는 알킬화약물, 항대사물질, 천연물질 등으로 다양하다.
- 2세대 표적치료제(Protein drug)부터 표적세포에만 반응한다. 암세포에만 나타나는 특정 단백질 또는 특정 유전자에 표적하여 암의 성장과 분화를 막는 치료이며 화학 치료제와 달리 정상세포를 공격하지 않아 부작용이 덜한 편이다. 대표적으로 1999년 개발된 글리벡은 만성 골수성 백혈병을 유발하는 유전자 이상을 표적으로 하여 뛰어난 효과를 보여주어 이 혈액암의 특효약이 되었다. 이러한 분자 표적치료제들은 암세포가 정상세포와는 다른 유전자 변형을 표적으로 하여 정상세포에는 손상을 주지 않고 암세포만을 선택적으로 공격함으로써 보다 안전하고 효과적이라는 장점이 있다. 그러나 표적 치료제들은 다양한 문제점을 가지고 있다. 이론적으로는 암세포만을 공격해 부작용이 보이지 않지만 개인별로 부작용의 빈도나 심각성이 차이가 있다. 실제로 암 종양은 다양한 표적들이 존재하기에 단일 표적 치료제로는 치료가 잘 되지 않을 수도 있고 처음에는 효과가 좋았다가 후에 효과가 사라지기도 한다.
- 3세대 면역치료제(Gene drug)는 기존 면역체계를 자극시켜 인공 면역 유전자를 투여해 암세포를 공격한다. 여러 연구 결과, 암세포만을 잡는다고 암이 없어지지 않는 사실을 알게 됐다. 암조직은 섬유아세포, 다양한 면역세포, 혈관내피세포 등 여러 종류의 세포로 구성되어 종양 미세 환경을 형성한다. 이들은 암세포에 영양분 공급을 위해 암세포의 성장을 도와 항암제 효능을 저해하는 것으로 판명이 됐다. 그래서 암을 직접 표적하지 않고도 면역기능을 강화하여 간접적으로 암을 없애는 것을 가능하게 하는 종양 미세 환경으로 암 치료 관점이 확장되었다. 이런 과정을 통해 면역항암 치료라는 개념이 등장하였다. 이렇듯 gene therapy는 계속해서 연구 중에 있으며 발전해가고 있다. Gene therapy의 예시로 CpG 서열을 가진 DNA가 있고 이번 프로젝트에서는 핵산 DNA 중 CpG DNA를 이용하고자 한다.
CpG ODN의 반응 메커니즘[5]
- 우리 몸의 유전 정보를 가지고 있는 DNA는 염기인 A와 T, C와 G의 수소결합으로 이루어진 이중나선 구조를 이루고 있다. CpG란 DNA를 구성하는 염기서열 중 사이토신(C)과 구아닌(G) 두 염기가 반복하여 존재하는 서열을 의미한다. 근본적으로 바이러스나 박테리아가 가지는 CpG는 메틸화가 되어있고 포유류인 사람이 가지는 CpG는 메틸화가 되어 있기 때문에 서열의 형태가 다르다.
- CpG ODN(Oligodeoxynucleotide)은 박테리아나 바이러스로부터 유래된 CpG를 갖고 있는 올리고 핵산으로, 주로 대식세포, 수지상세포, 자연살해세포 등을 활성화시켜 IL-6, IL-12, IL-18, TNF-α와 같은 사이토카인들의 분비를 촉진시킨다. 이를 통해 면역활성화를 증가시킨다. 이를 이용해 CpG ODN을 면역의 agent로도 사용할 수 있다는 가능성이 제기되고 있다. 면역력을 높이는 물질인 CpG ODN을 면역세포까지 안전하게 전달할 수 있다면 암에 대항하는 면역력을 높임으로써 암 치료 효능을 획기적으로 증대하고 암이 완치된 이후 재발 방지에도 큰 효과를 보이는 것을 기대한다.
- CpG ODN은 표적세포에 수초 대로 유입되어, 수분 내로 표적 유전자의 intracellualr mRNA를 증가시키고, 최종 산물인 사이토카인들을 분비하도록 촉진시킨다. CpG ODN의 표적세포로의 유입은 CpG 서열에 특이한 세포 표면 receptor를 매개로 하지 않고, non-specific adsorptive endocytosis를 통해 세포 안으로 유입된다고 알려져 있다. 세포 안으로 유입된 CpG ODN의 활성에는 엔도솜의 산성화가 필수적이다. 엔도솜의 산성화을 통해 세포질로 방출되어 작용한다. 엔도솜의 산성화를 통해 엔도솜의 막을 파괴하고 CpG ODN을 세포질에 방출할 수 있다.
RCR를 이용한 핵산 입자의 합성[6]
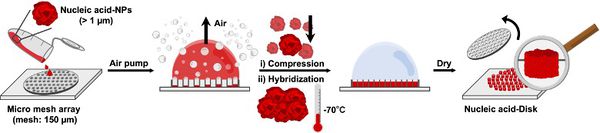
- 마이크로 디스크 구조 제작을 위한 핵산 입자는 RCR(Rolling Circle Replication) 기술을 이용하여 합성할 수 있다. 원형을 이루도록 양 끝 서열을 상보적으로 만든 Linear DNA와 primer, DNA ligase를 이용하면, 완전한 circular DNA가 된다. 만들어진 circular DNA은 주형이 되며, DNA 중합효소에 의해 무한히 복제된다.
- 이렇게 만들어진 circular DNA를 준비한다. Primer, 데옥시리보뉴클레오티드 3인산(dNTPs), DNA 중합효소를 첨가하여 반응을 진행하면 주형인 circular DNA를 여러 바퀴 복제하여 수십 또는 수백 번 반복된 단일가닥 DNA를 증폭해낼 수 있다. 이 때, RNA primer, 리보뉴클레오티드 3인산(rNTPs), RNA polymerase를 첨가하여 반응을 진행하면 무한히 RNA를 전사하여 대량의 RNA를 얻을 수 있다.
- RNA 입자는 반응물을 37도에서 20시간 동안 반응시킨 후 sonication 시키면 얻을 수 있으며, DNA 입자의 경우 반응물을 30도에서 20시간 동안 반응시킨 후 sonication 시키면 얻을 수 있다. 특히 상보적인 두 circular DNA를 이용하여 상보적 회전환 증폭(cRCA)을 한다면 더욱더 많은 DNA 입자를 얻어낼 수 있다.
개발 과제의 목표 및 내용
Micro-pattern disk 제작
- Micro 크기의 구멍이 균일하게 패터닝된 PDMS 기반 array를 이용하여 기능성 핵산 기반 입자를 패터닝하고, 이 과정에서 제작된 micro-disk 구조의 장점을 기반으로 핵산의 기능을 극대화하고자 한다. 핵산 중 안정성이 상대적으로 낮은 것으로 알려진 RNA로 전반적인 disk 구조의 제작 가능성 및 조건을 확인한다.
핵산 입자 기반 micro-pattern disk의 면역 반응 확인
Micro-pattern disk의 혈청 내 안정성
- 향후 핵산 입자의 micro-pattern disk를 인체 내 drug delivery system으로 이용하고자 하는 것은 이 프로젝트의 장기적인 목표 중 하나이다. 인체를 위해 사용하는 물질의 경우 혈청 내에서의 분해 실험을 통해 분해 여부, 분해 속도로 micro-pattern disk의 안정성 여부를 파악한다.
Micro-pattern disk의 면역 반응 증가 확인
- 핵산을 입자화하고 더 나아가 micro-pattern disk로 제작하였을 때 면역 반응 유도 관점에서의 장점을 확인하고자 한다. 쥐의 대식세포인 RAW 264.7 세포에 처리하여 면역세포가 분비하는 단백질인사이토카인의 분비로 면역 반응이 활성화되는지의 여부를 확인한다.
CpG DNA 마이크로 입자
CpG DNA 마이크로 입자의 제작
- 인체가 가지는 DNA 중 CpG 서열은 근본적으로 바이러스나 박테리아가 가지는 것과는 그 형태가 달라 면역 활성화를 유도할 수 있는 것으로 널리 알려져있다. 핵산의 고분자로서 가지는 여러 이점 중 서열 특이성을 이용한 설계가 가능하다는 점을 이용하여 CpG 서열이 있는 DNA를 이용해 입자를 만들어 이용하고자 한다.
입자의 크기 분포 확인
- 반응물들의 첨가 비율이나 반응 조건에 따라 CpG DNA 마이크로 입자의 크기가 달라질 수 있으며, 형성된 마이크로 입자들의 크기는 완벽히 일치하기 힘들다. 반응물의 비율을 다르게 설정하여 얻어지는 입자의 크기 분포 양상을 여러 분석 장치를 통해 확인해본다.
Micro-pattern disk의 높이 최적화를 위한 입자 농도 측정
- 같은 volume의 입자 solution을 micro mesh array에 적용시킨다고 하더라고 입자의 농도에 따라 disk의 높이나 형성 양상이 달라질 것으로 예상해 disk를 제작하기 위해 사용할 입자의 농도를 측정하고자 한다.
Micro-pattern disk의 응용
Micro-pattern disk의 캡슐화
- Drug delivery를 위한 Micro-pattern disk를 제작한다면, 이를 인체의 표적 장소에 어떻게 전달해야하는지에 대한 것도 고려해야할 사항이다. DNA 하이드로젤이 disk를 전달할 수 있는 운반체 역할을 할 수 있으며, 이를 이용하여 micro-pattern-disk의 캡슐화 작업을 진행한다.
야누스 micro-pattern disk
- 서로 다른 기능을 가진 입자를 사용하여 disk를 제작한다면, 하나의 disk에 두 가지 이상의 기능을 가진 micro-pattern disk를 제작해볼 수 있을 것이다. 두 가지 이상의 입자를 사용하여도 disk가 잘 만들어지는지, 하나의 입자를 사용했을 때와 비교하여 생기는 이점이 무엇일지 이미지화하여 파악한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
기술요소A-부작용 없이 세포에 전달하며 안정하고 복잡한 핵산 입자 구조체
추가적인 매개체 없이 면역자극을 증가시키는 핵산 입자 구조체[7]
▶ 요약
- 혈청 단백질과 효소로부터 핵산 사슬 구조를 보호하고 부작용 없이 세포 내로 전달하기 위해서는 안정성 향상을 위해 2가지를 고려해야 한다. 첫 번째, 화학적 수정을 하면 효소 안정성과 사이토카인의 효율적인 유도를 개선 가능하지만 신체 손상 등의 부작용이 심하다. 그러므로 추가적인 매개체 없이 면역자극을 증가시키기 위해 핵산을 입자화하는 방법이 있다. 부피가 크고 복잡한 DNA구조는 대식세포에 대한 강한 면역 반응을 일으킨다. 또한, 이중가닥의 DNA 구조보다는 단일 DNA의 사슬 구조가 receptor와 반응을 더 잘 할 수 있다는 사실을 기반으로 핵산 입자를 이용한다면 식세포 경로를 통해 단일 DNA 사슬 구조를 즉각적으로 방출할 수 있을 것이므로 기존의 방법과 비교하여 이점이 있다.
추가적인 매개체 없이 특이적으로 표적할 수 있는 나노 입자 구조체[8]
▶ 요약
- 약물전달체계에 이용되는 대부분의 나노입자들은 우리 체내의 다양한 장벽을 통과할 수 있고 부피에 비하여 상대적인 면적의 비율이 크기 때문에 많은 양의 약물을 전달할 수 있다. 더 나아가 정상세포에서는 보이지 않으나 표적세포에서만 발현되는 수용체나 항원을 특이적으로 표적할 수 있는 리간드나 항체를 나노 입자에 결합할 경우 약물독성을 피하면서 종양세포 내 약물농도를 높여 그 치료효과를 극대화할 수 있다. 나노 입자의 장점 중 하나는 제작 시 크기를 쉽게 조절할 수 있다는 것이다.
기술요소B-RCR 방법을 이용한 핵산 기반 microparticle 합성
등온 핵산 증폭기술로서 주형 template이 반복적으로 연결될 수 있는 RCA방법[9]
▶ 요약
- RCA는 Rolling Circle Replication을 응용한 등온 DNA 증폭기술이다. PCR과 같은 기존의 DNA 증폭 기술과는 달리 RCA는 등온 핵산 증폭기술로서 원형 주형에 달라붙는 프라이머에 단일 뉴클레오타이드를 연속적으로 첨가하는 방법이다. DNA 중합효소와 polyerase에 적합한 완충액, DNA 프라이머, 원형 DNA 주형과 dNTPs가 필요하다. PCR반응과는 달리 고정화된 표적에서 모두 일정한 온도에서 수행될 수 있다. RCA 반응은 수용액 상태 뿐 아닌 유리, microwell plates 등과 같은 단단한 표면에서도 수행할 수 있어 ELISA와 같은 고체상 면역 측정법에서 신호 증폭을 위한 도구가 될 수 있다.
상보적 회전환 증폭기술(cRCA)을 이용한 DNA 입자[9]
▶ 요약
- 상보적 회전환 증폭기술(Complementary Rolling Circle Amplification)을 이용하여 DNA 입자를 제작할 수 있다. 일반적인 회전환 증폭기술로 만들어진 입자에 비해 DNA 사슬간 상보적 결합으로 기존의 방법으로 만들어진 입자보다 강한 물성을 가지게 된다.
기술요소C-핵산 기반 micro-pattern disk
의학적 장치를 위한 분해되지 않는 합성 고분자[10]
▶ 요약
- 생물학적인 환경에서 분해되지 않고, 가공하기 쉬운 많은 합성 고분자들은 의학 분야의 응용에서 다양한 이점을 지니고 있다. 가수분해성, 산화성과 같은 분해 메커니즘에 저항성이 있는 대표적인 합성 고분자에는 폴리올레핀, 폴리우레탄, 폴리실록산 등이 포함되는데, 그 중 PDMS는 폴리 다이메틸 실록산(Poly(dimethyl siloxane))을 말한다. 메틸기로 치환된 실리콘의 교차결합으로 이루어진 PDMS는 액체, 젤, 탄성 중합체와 같은 다양한 형태로 존재할 수 있다. 또한, PDMS는 실리콘 고무라고도 하는데, 반응성이 없고 안정하며 극한 환경에 저항성을 가지고 있고, 좋은 생체 적합성을 가지고 있다.
소프트 리소그래피를 이용한 마이크로/나노 패터닝 기술[11]
▶ 요약
- Soft lithography는 부드러운 몰드를 이용하여 패턴을 제작하는 공정을 말한다. PDMS와 같은 유연한 유기물질을 이용하여 패턴을 전사하여 구조물을 만드는 기술로써, 마이크로/나노 크기의 패터닝을 제조하는 기술의 한 분야로 주목받고 있다. 다양한 방법을 통해 몰드에 원하는 패턴을 새길 수 있다.
패터닝된 마이크로 채널에서의 binary and ternary 입자 배열[12]
▶ 요약
- 특정한 기능을 가지는 입자를 2차원이나 3차원의 특정한 배열로 제작하는 것은 바이오칩이나 센서 및 다양한 소자에 응용될 수 있다. 나노입자를 포함한 용액을 적당한 온도에서 코팅하고 건조시키는 딥 코팅 방법을 이용하여 PDMS 몰드에 입자들을 패터닝시킬 수 있다. 이때 한 종류의 입자를 먼저 PDMS 몰드에 패터닝한 후, 빈 공간을 다른 입자로 채우게 되면 다양한 기능을 가지는 구조체를 만들 수 있다.
특허조사
기술요소A-작용 없이 세포에 전달하며 부피가 크고 복잡한 핵산 입자 구조체
면역 자극 활성이 증강된 소수성 T 유사체를 함유하는 CpG 올리고뉴클레오티드 유사체 방법[13]
▶ 요약
- 본 발명은 하나 이상의 친지성 치환된 뉴클레오티드 유사체 및 피리미딘-퓨린 디뉴클레오티드를 포함한 올리고뉴클레오티드에 관한 것이다. 본 발명은 또한, 그의 제약 조성물 및 사용 방법에 관한 것이다. 본 발명은 면역 자극 능력 증강을 유발시키는 한 가지 이상의 변형을 포함하는 올리고뉴클레오티드에 관한 것이다. 특히, 본 발명은 하나 이상의 친지성 치환된 뉴클레오티드 유사체를 갖는 특이적 아-부류의 올리고뉴클레오티드가 면역 반응을 매개하는 데에 있어서 고도로 유효하다는 발견에 기초한다. 이들 올리고뉴클레오티드는 면역 반응을 유도시키고 암 및 바이러스 감염증과 같은 질병 및 장애를 치료하는 데에 치료적 및 예방적으로 유용하다.
▶ 유사점
- 핵산을 재료로 하는 점과 면역 자극 활성이라는 목표에서 유사하다.
▶ 차이점
- 본 발명은 TLR9와의 상호 작용에 영향을 미치는 변경된 구조를 지닌 면역 자극성 ODN을 만들었으며 화학적으로 변경했다. 이러한 변경 없이, RCR을 통해 핵산을 입자화시키면 신체 손상 등의 부작용을 막은 추가적인 매개체 없이 면역자극을 증가시킬 수 있다.
리포좀에 포집된 ODN 및 Epitopes를 포함하는 면역증강용 조성물[14]
▶ 요약
- 본 발명은 다양한 암 및 감염성 질병 등에 대한 예방 및 치료를 가능하게 하는 신규의 면역보조제를 개발하고자 하였다. 면역 증강용 조성물, 면역원성을 가지는 에피토프, 이들의 스크리닝 방법 및 제조방법에 관한 것이다. 전달 운반체로서의 리포좀은 세포독성 T 림프구 반응을 강화시키는 백신의 개발에 광범위하게 평가되어 왔다. 포집된 리포좀은 전달물질을 주위 환경으로부터 보호하고 타겟 세포로 전달할 수 있다.
▶ 유사점
- 핵산을 사용해 표적 세포를 정하고 이를 전달한다는 궁극적인 목표와 면역 보조제를 통해서 면역 반응을 강화시키려는 점에서 유사하다.
▶ 차이점
- 본 발명은 리포좀을 통해 CpG ODN을 넣어 캡슐화시킨 것으로 대식세포를 표적해 전달함으로써 면역보조제 역할을 통해 면역 반응의 강화를 하고자 했다. 이와 다르게, 본 실험에서는 리포좀 이라는 캡슐 필요없이 핵산 입자만을 가지고 입자를 만들어 표적세포에 전달하고자 한다.
기술요소B-cRCA 방법을 이용한 CpG DNA microparticle 합성
RCT(Rolling Circle Transcription)에 의한 siRNA 다량체 제조방법[15]
▶ 요약
- Rolling Circle Transcription, RCT에 의한 siRNA 다량체의 제조방법 및 이를 이용해 제조된 siRNA 다량체에 관한 것이다. 제조된 siRNA 다량체는 생체 내 안정성이 향상되고, 생체적합성이 우수한 전달체를 이용해 세포 내 전달이 가능하다. 이를 통해 각종 질병의 치료에 효과적으로 사용될 수 있다.
▶ 유사점
- 질병의 치료를 위해 생체 내 안정성을 고려한 제조방법으로 주형 가닥을 프로모터와 중합효소를 이용해 다량체로 제조하는 점에서 유사하다.
▶ 차이점
- 본 발명은 TLR9와의 상호 작용에 영향을 미치는 변경된 구조를 지닌 면역 자극성 ODN을 만들었으며 화학적으로 변경했다. CpG ODN변경 없이, RCR을 통한 핵산을 입자화시키면 신체 손상 등의 부작용을 막은 추가적인 매개체 없이 면역자극을 증가시킬 수 있다.
2차 프라이머를 이용한 핵산 증폭 방법[16]
▶ 요약
- 헤어핀 구조를 가지는 2차 프라이머를 이용하여 회전환 증폭 기술의 효율을 높이는 방법. 헤어핀의 머리 부분은 증폭되는 DNA와 상보적으로, 꼬리 부분은 프라이머에 상보적으로 제작해서 증폭 효율을 높인다.
▶ 유사점
- 회전환 증폭 기술을 기반으로 한 증폭 방법으로의 공통점이 있다.
▶ 차이점
- 상보적 회전환 증폭기술과는 다르게 헤어핀 구조를 가진 2차 프라이머를 사용한다. 증폭 효율을 높아지나 제작된 물질의 안정성은 떨어진다. 2차 프라이머를 사용해야 하므로 염기서열 조작에 한계가 있을 것으로 예상된다.
다중 프라이머 증폭 기술[17]
▶ 요약
- DNA(RNA)의 염기서열을 조절하여 프라이머가 결합하는 자리가 다중으로 존재하는 사슬을 증폭한다. 증폭을 통해 복제된 사슬에 다른 프라이머가 결합하여 새로운 사슬이 복제되는 과정이 반복되며 물성이 높은 입자를 형성하게 된다.
▶ 유사점
- 효소 기반 증폭기술로 핵산 기반 물질 제작. 상보적 결합으로 인해 일반적인 RCA에 비해 높은 물성을 가진 입자가 생성 가능하다.
▶ 차이점
- 여러 종류의 프라이머를 사용하여 동시에 증폭 과정이 일어나므로 회전환 증폭기술에 비해 높은 물성을 가질 수 있으나, 제작 과정이 복잡하다. 요구되는 물질의 물성과 용이한 크기 제어, 염기서열의 조절을 위해 두 가지 방법을 이용하여 실험 중 합리적인 과정을 선택해 진행할 수 있을 것이다.
기술요소C-핵산 기반 micro-pattern disk
나노입자 패터닝 방법[18]
▶ 요약
- 금속이나 세라믹 성분의 나노입자를 포함하는 용액을 정전분무방식을 사용하여 대전시키고, 이를 제어하는 장치에 의해 이동시킴으로써 일정하게 패터닝하도록 한 것이다.
▶ 유사점
- 압력을 이용하여 원하는 모양으로 패터닝할 수 있고, 용액의 농도와 용해물질을 변화시킴으로써 미세입자의 크기와 농도를 제어하여 패터닝의 폭과 높이를 조절한다.
▶ 차이점
- 상기 방법은 입자가 금속이나 세라믹으로 생명체와 가깝거나 혹은 생체 내에 주입하기에 유익한 물질은 아니다. 하지만 생명체에서 유래한 핵산이라는 물질을 이용하여 생체적합성이 좋으면서도 정교한 패터닝이 가능하다는 면에서 이전에 볼 수 없던 새로운 발명이라 할 수 있다.
계층적 은나노 구조체 및 이의 제조방법[19]
▶ 요약
- 질산은 수용액을 이용하여 은나노 구조체를 제조한 후, 은 나노입자 캐핑제(capping agent)의 종류와 첨가량에 따라 2차원 및 3차원 구조체의 표면 형태를 제어할 수 있다. 은나노 구조체를 만드는 과정에서 시르트산삼나트륨의 첨가량이 증가할수록, 5~10nm의 크기를 갖는 은나노 입자 사이의 반발력이 증가하여 입자들이 packing 되어있는 구형에서 점차 꽃 형태가 되어간다. 또한 포도당의 첨가량이 많을 때 은나노 구조체는 disk stack 형태로서 계층적 3차원 구조가 된다.
▶ 유사점
- 구조체를 만드는 과정에서 사용되는 물질의 농도를 변화시킴에 따라 다양한 형태를 갖는 3차원 구조체를 만들어내고, 각 조건에 따른 특성을 비교하였다.
▶ 차이점
- 3차원 구조체를 이루는 단위체인 핵산이 생체에서 유래한다는 차이가 있다. 핵산이 가지는 서열에 관계없이 농도 및 크기의 최적화 조건만 형성해 준다면 3자원 구조체를 제작하는 방식이 모두 동일하다. 또한, 구조체의 형성을 화학적 결합이 아닌 물리적인 힘을 이용한다는 점에서 시간과 자본을 감소시킬 수 있다는 이점이 있다.
특허전략
- 기존 기술들의 내용을 종합해보면 핵산의 특정 서열을 이용하여 면역 활성을 유도하기 위한 시도는 있었으나 리포좀이라는 전달 운반체를 이용하였고, 생체 내 안정성을 위한 방법적인 과정이 복잡하거나 그 안정성을 보장하기가 힘들었다.
- 이번 프로젝트로 인해 개발될 기술은 이러한 문제점들을 수용할 수 있으며 더욱더 진보된 형태의 시스템을 설계할 수 있다는 점에서 차별성을 가진다. 구체적인 사항으로는 1. 핵산을 이용한 입자 형성으로 생체 내 안정성을 높였다는 점과, 2. 생체 내에서 유래한 유전체인 핵산을 물리적인 힘으로 압축하여 생체적합성을 높여 별도의 전달체 없이 원하는 위치로 핵산 유래 약물을 전달할 수 있다는 점, 3. 임의적인 서열의 핵산이어도 특정 조건만 맞춰주면 정교한 패턴의 마이크로-디스크 구조를 제작할 수 있다는 점이 있다.
- 이러한 장점들은 기존 기술들에는 적용되지 않았던 장점들이기 때문에 이번 프로젝트로 인해서 개발될 기술은 진보성과 신규성을 모두 획득할 수 있다.
개발과제의 기대효과
기술적 기대효과
생체 재료(DNA 및 RNA)의 안정성 증가
- 이번 프로젝트의 주재료인 핵산 기반 입자는 DNA나 RNA가 생체 고분자로서 가지는 여러 이점(서열 특이성을 이용한 설계, 생체 친화성, 생분해성)들로 인해 새로운 생체 재료로써의 가능성을 인정받고 있다. 일반적인 생체 고분자로서의 기능뿐만 아니라 핵산으로 구성된 나노구조체를 이용하면 생체 내 특정 위치까지 약물을 전달하거나 면역반응을 일으키는, 혹은 압타머와 타겟의 상호작용을 인식하는 센서 등으로도 활용할 수 있다.[20]
- 이러한 다양한 장점들이 존재함에도 불구하고 핵산을 기반으로 한 생체 재료들은 생체 혹은 생체 유사 환경에서 쉽게 분해된다는 점에서 상용화에 어려움이 있었다. 이중 나선 혹은 단일 나선 구조로 존재하는 핵산들과 비교하여 핵산의 회전환 복제방식(Rolling circle Replication)으로 입자를 형성하고 이 입자들을 마이크로-디스크 구조로 압축시키면, 핵산분해효소로 자를 수 있는 핵산 내 서열의 노출이 최소화되므로 생체 내 안정성이 높아지는 효과를 기대할 수 있다.
기존의 것보다 효과 빠른 면역 유도체(백신 치료제)로의 활용
- 합성된 CpG 올리고뉴클레오타이드(이하 ODN)의 DNA의 부분 서열은 면역 활성 능력에 필수적이고, 특히 이 서열의 사이토신(Cytosine)이 메틸화되었을 때에는 면역증진 활성이 사라진다는 사실이 보고되었다. 또한, 박테리아, 바이러스, 혹은 무척추동물에서 추출된 DNA는 면역증진 효과를 보이지만 어류, 포유류, 혹은 식물에서 추출된 DNA는 면역증진 효과를 나타내지 않았다. 이러한 사실로부터 CpG motif 혹은 CpG ODN의 면역활성 개념이 정립되었다. 즉, 포유류 DNA의 경우 ‘CpG 억제’ 및 사이토신의 메틸화로 인해 박테리아의 DNA에 비해 확률적으로 약 20배 적은 CpG motif를 갖고 있다는 점으로 미루어볼 때, 포유류의 면역체계가 박테리아나 바이러스 등의 병원체 등에 대처하는 하나의 수단으로써 외부 DNA, 곧 CpG DNA를 인식하여 면역 체계를 활성화 시킨다는 것이다.[21]
- 따라서 마이크로-디스크 구조의 활용 방법 중 하나로 이번 프로젝트에서는, 면역 매개체로 사용할 수 있는 CpG 서열을 가진 입자[22]로 디스크 구조를 제작하고 이의 최적화 조건을 찾고자 한다. 향후 이 platform은 대식세포의 식작용 및 표면 항원 제시와 다른 면역 세포 활성 등으로 빠른 면역 체계 활성에 도움을 줄 것이라 예상한다. 이는 곧 백신의 기능이며 기존의 피하나 근육에 주사하던 방식보다 빠른 면역 반응의 효과가 있을 것이라 기대한다.
경구용 의약품으로의 활용
- 기존의 입병 곧 구내염 치료제는 상처 부위에 약을 처리하였을 때, 통증의 강도가 너무 세다거나[23] 특유의 제형으로 인해 목에 걸리는 듯한 이물감[24]으로 사용하기에 불편한 점이 있다. 이러한 제품들의 단점을 보완한 가글형[25] 및 패치형 구내염 치료제[26]가 시중에 나오게 되었고 이 때 주목할 치료제가 바로 패치형 치료제이다.
- 핵산의 큰 장점 중 하나인 용이한 기능적·구조적 프로그래밍으로 치료제로 쓰일 수 있는 핵산의 서열을 합성 및 입자화, 그리고 마이크로-디스크 구조로 제작한다고 가정해보자. 이렇게 제작한 핵산 기반 약물을 패치형으로 만들어 혀 아래 및 볼 안쪽 점막에 붙여 사용한다면 약물이 소장 벽과 간을 먼저 통과하지 않고 직접 혈류로 들어가므로 다른 약물 투여 경로에 비해 빠르게 흡수될 수 있을 것이며, 이러한 구조의 핵산 기반 약물은 가닥으로 존재하는 것보다 안정성이 높아 효과적인 약물 전달을 할 수 있을 것으로 기대된다.
경제적, 사회적 기대 및 파급효과
동물실험의 간소화 및 실험동물에 관한 윤리
- 의약기술이 발달하면서 인간의 수명은 과거 대비 크게 늘어났지만, 그 이면에는 수많은 실험동물의 희생이 있었다. 동물을 이용한 실험은 제약, 생명 과학, 해부학과 같은 순수 과학에서부터 응용과학의 분야까지 다양하게 활용되고 있다.
- 다양한 동물 실험 중 이들을 대상으로 하는 약물 투여 실험의 경우 가장 많이 행해지는 방법은 약물을 용매에 녹여 피하주사기를 통해 주입하는 주사(injection)이다. 이는 가장 빠르게 효과를 볼 수 있으며 사람이 실행하기 쉬워 많이 이용된다.[27] 하지만 이쯤에서 우리는 실험동물에 관한 윤리도 생각해보아야 한다. 동물들은 우리에게 표현을 하지 못할 뿐, 사람과 똑같이 아파한다.
- 실험동물로 가장 많이 쓰이는 것은 쥐를 비롯한 설치류이며 국내 동물실험의 90% 이상을 차지할 정도로 압도적이다. 약물을 입자화하여 압축시키고 마이크로-디스크 구조로 제작한다면 그 크기는 쥐의 경구투여에 알맞은 크기가 될 것이다. 이 방법을 이용한다면 쥐가 고통을 느낄 일도 줄어들고 주사하기 위해 사용되는 여러 기구들의 사용도 줄일 수 있다. 약물을 실험동물에게 투여하기 위한 절차도 감소할 것으로 예상한다. 따라서 이번 프로젝트를 통한 연구로 동물실험에 있어서의 시간적·경제적·윤리적 이득이 기대된다.
경제적, 시간적 효율성 증가
- 이번 프로젝트에서 마이크로-디스크 구조의 응용처 중 하나로 사용한 서열인 CpG ODN은 박테리아나 바이러스로부터 유래된 특정 염기 서열(CpG)를 갖는 핵산 서열로서, 면역세포 표면에 있는 TLR-9과 상호작용하여 체내 면역 활성화를 증가시키는 면역증가 물질이다. 이와 같이 서로 다른 두 화합물이나 분자가 특이적으로 결합하여 일어나는 반응을 이용하여 연구하는 흔한 사례로는 DNA간 결합을 위한 –싸이올기 및 -알킬기의 결합, 바이오틴과 스트렙타비딘의 결합, 클릭 화학 등이 있다.
- 위에 언급한 반응들은 모두 화학적 반응으로서 두 핵산 그룹을 결합시키기 위해서는 미리 하나의 그룹을 특정 표면이나 물질에 coating 또는 결합시킨 뒤 나머지 하나의 그룹을 결합시켜야한다. 핵산 기반 입자의 마이크로-디스크 구조의 제작은 특이적 화학결합을 이용하는 것이 아닌 물리적인 힘을 이용하여 핵산을 서로 묶어주는 것이므로 이와 같은 부가적인 coating process를 생략할 수 있다. 이 구조를 통해서 핵산들은 고밀도로 압축되어 생체 내 환경에서 안정성이 높을 것이라는 장점도 생기게 된다. 따라서 이 프로젝트를 통하여 재료의 절약 및 제작 단계 감축으로 인한 경제적·시간적 효율을 기대한다.
기술개발 일정 및 추진체계
개발 일정
구성원 및 추진체계
설계
목표달성을 위한 설계(실험) 방법
- 핵산은 생체 내에서 유전정보를 저장하는 역할을 수행하지만, 여러 연구들을 통해 핵산을 생체 고분자로써 이용하는 방법이 소개되고 있다. 핵산은 이미 생체 내에 존재하는 물질이기 때문에 생체 내 독성이 없다는 장점이 있지만 제한효소나 분해효소에 의해서 쉽게 생분해될 수 있는 특성이 있다는 단점도 있다. 이 연구에서는 이러한 단점을 보완하기 위해 회전환 복제기술을 이용하여 기존의 것보다 물성이 높은 핵산 기반 입자를 제작할 뿐만 아니라 더 나아가 물리적인 힘으로 입자들을 압축시키고 정교한 패터닝이 가능한 마이크로 디스크 구조의 제작 기술을 통해 핵산이 가지는 주된 한계 중 하나인 안정성을 높여 생체 고분자로의 응용 분야를 넓히고자 하였다.
- 핵산 입자 중 상대적으로 불안정하다고 알려진 RNA로 선행 실험을 하였고, 입자는 회전환 복제 방법(Rolling Circle Replication)을 이용하여 합성하였다. 원형을 이루도록 양 끝 서열을 상보적으로 만든 Linear DNA와 primer, DNA ligase를 이용하면, 완전한 circular DNA가 된다. 만들어진 circular DNA는 주형이 되며, DNA 중합효소에 의해 무한히 복제된다. 주형인 원형 DNA를 여러 바퀴 복제하여 수십 또는 수백 번 반복된 단일가닥 핵산을 증폭해낼 수 있다. 이 때, RNA primer, 리보뉴클레오티드 3인산(rNTPs), RNA polymerase를 첨가하여 반응을 진행하면 무한히 RNA를 전사하여 대량의 RNA를 얻을 수 있다.
- 임의적인 서열의 원형 DNA와 중합효소를 이용하여 RNA가 무한 복제되는 시스템을 통해 scramble RNA 가닥들을 뽑아내고, 이를 초음파 처리하여 작은 입자 조각들로 분리시켰다. 이렇게 만든 scramble RNA 입자 조각들로 Figure 3과 같이 마이크로-디스크 구조를 제작하여 형성 양상을 광학현미경 및 주사전자현미경으로 관찰하여 어떤 조건에서 디스크가 형성되는지를 확인하였다. 또한, 디스크에 인체 내 환경과 유사한 혈청을 처리하여 안정성을 파악하고자 하였고, 면역 작용을 하는 대식 세포 중 하나인 RAW264.7 세포를 디스크에 처리하고 효소결합면역흡착검사 (ELISA assay)를 통해 면역 물질인 사이토카인이 얼마나 생성되는지 확인하여 핵산 기반의 마이크로-디스크 구조가 면역 작용 유도에 효과가 있는지를 살펴보고자 하였다.
- Micro-disk structure의 의학적 응용을 위해 핵산 중 인간 체내에서 면역 증진 효과를 보인다고 알려진 CpG 서열을 가진 DNA로 마이크로 입자를 제작해 이를 해당 process에 적용해보았다. CpG DNA 서열을 가진 입자는 상보적 회전환 기술(complementary Rolling Circle Amplification, cRCA)을 이용하여 합성하였다. RNA 입자를 만드는 방식과 다른 점은 상보적인 서열의 두 circular DNA와 DNA 중합효소를 이용하여 DNA를 무한히 복제하는 공정을 거쳐 물성을 더 높였다는 점이다. 두 circular DNA와 DNA 중합효소의 비율을 조절하여 CpG 서열을 가진 DNA 입자의 크기를 조절하여 디스크를 제작하였고 각각의 크기에 따른 형성 양상을 살펴보았다. 다음 순서로는 그 중 가장 잘 형성되는 크기를 가지는 입자 그룹의 입자 용액 농도를 조절하여 마이크로-디스크 구조 제작의 최적화 조건을 정립하였다.
- 마지막으로 마이크로-디스크 구조의 다양한 응용의 실현을 위한 두 가지 실험을 진행하였다. 첫 번째로, 마이크로-디스크를 DNA 하이드로젤로 캡슐화시켜 약물 전달 시스템에서 마이크로-디스크 구조의 조작 용이성을 극대화하고자 하였다. RNA 입자로 마이크로-디스크를 제작한 후 이를 용액 내로 회수하여 이것으로 DNA 하이드로젤을 제작하였다. DNA 하이드로젤 역시 회전환 증폭기술을 이용한 DNA 무한 복제 공정을 통해 합성하였다. 두 번째로, 서로 다른 기능을 가지는 두 RNA 입자를 이용하여 두 가지 이상의 기능을 가지는 하나의 마이크로-디스크를 만들고자 하였다. 이를 관찰하기 위해 두 RNA 입자를 서로 다른 염색약(DAPI, SYBR Ⅱ)을 사용해 염색하였다.
결과 및 평가
개발과제 핵심결과
Micro-pattern disk의 제작
- 핵산 중 상대적으로 안정성이 낮은 것으로 알려진 RNA로 마이크로 입자를 제작해 micro-pattern disk를 제작하여 전반적인 제작 가능성과 조건을 확인해보았다.
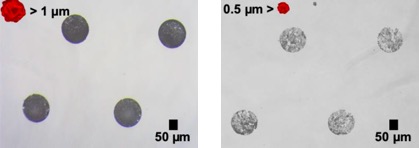
- 임의적인 서열의 scramble RNA 마이크로 입자를 이용해 micro-pattern disk를 제작해 먼저 광학현미경으로 10배율 확대하여 관찰해보았다. 같은 양의 nucleic acid를 micro array위에 떨어뜨렸음에도 불구하고 Figure 4 와 같이 크기에 따라 disk structure의 형성 양상이 다름을 알 수 있었고, RNA의 경우 1μm 이상의 크기를 가지는 입자로 micro-pattern disk 구조를 제작할 수 있음을 확인하였다.
- 또한, 제작한 RNA 기반의 micro-pattern disk 구조를 3D로 관찰하기 위해 주사전자현미경을 이용하였으며 각각의 disk 높이가 고르다는 것을 이미지를 통해 확인하였다.
핵산 입자 기반 micro-pattern disk의 면역 반응
- 핵산 입자 기반의 micro-pattern disk의 제작 조건을 확인한 후에는 이를 생체 내 면역 매개체로 활용할 수 있는지에 대한 여부를 살펴보고자 하였다. disk의 면역 유도 반응을 확인하기에 앞서 생체 내와 유사한 환경에서의 disk 안정성을 평가하였다.
- Figure 6 에서도 확인할 수 있듯이 시간에 따른 RNA pellet의 점진적인 붕괴와 48시간이 지난 시점까지도 상당히 안정적으로 구조가 유지되는 것을 확인할 수 있었으며 대식세포들이 disk 주위로 모이는듯한 양상을 광학현미경을 통해 관찰할 수 있었다.
- 면역 유도 여부를 알아보기 위해 RNA disk에 대식세포인 RAW 264.7 세포를 처리하였다 (Figure 7). 우선, RNA disk의 조각/RNA 입자가 대식세포 내부로 들어갔는지를 확인하고자 하였다. Figure 7의 (a) 에서 보이는 바와 같이, RNA disk 구조에 핵산 결합 형광 염색 물질인 Cy5를 labelling하고 형광현미경으로 관찰하였다. 시간이 지날수록 Cy5 signal이 점점 감소하는 것을 볼 수 있었고, (b)에서 확인할 수 있듯이 대식세포의 Cy5 signal로 RNA disk의 세포 내 유입을 역으로 추론함으로써 위에서 확인한 disk 주변으로 대식세포가 실제로 모인다는 사실을 증명할 수 있었다. 또한, 효소결합면역흡착검사 (ELISA assay)를 통해 RNA disk에 RAW 264.7 세포를 처리한 후 48시간이 지났을 때의 RNA pellet (RP)과 세포가 담긴 배지 상층액에서 상당한 양의 면역 물질인 TNF-α가 발견되었다. 따라서, 핵산 입자를 micro-pattern disk로 제작한 이와 같은 형태의 플랫폼은 체내에서 상당한 안정성을 가지고 면역 작용을 유도하여 새로운 유전자 치료제로 쓰일 수 있을 것이라는 가능성을 제시함을 알 수 있었다.

CpG DNA 마이크로 입자
- process의 최적화 및 제작 가능성을 확인하기 위해 상대적으로 불안정할 것이라고 예상한 scramble RNA 마이크로 입자를 이용하였고, 앞의 5.2에서 이의 안정성 및 면역치료제로서의 가능성을 입증하였다. 더 나아가 disk structure의 의학적 응용을 위해 인간 체내에서 면역 증진 효과를 보인다고 알려진 CpG 서열을 가진 DNA로 마이크로 입자를 제작해 이를 해당 process에 적용해보았다.
- CpG DNA 입자는 CpG 서열을 가진 circular DNA(CpG sense circular DNA)와 이와 상보적인 서열의 circular DNA(CpG antisense circular DNA), 중합효소를 이용하여 cRCA(complementary Rolling Circle Amplification) 방법을 통해 제작하였고 이는 CpG DNA 입자의 물성을 더욱더 높일 것이라는 아이디어에서 시작되었다. 또한, 서로 다른 크기의 입자를 얻기 위해 circular DNA 두 종류와 DNA 중합효소의 비율을 조절하였고 주사전자현미경을 통해 각 입자의 크기를 관찰하였다 (Figure 8).

- Figure 8의 (a)에서 볼 수 있듯, 전기영동법을 통해 CpG DNA 입자를 제작하기 위한 circular DNA가 만들어졌다는 것을 확인하였다. 이후 각자 다른 크기의 CpG 서열을 가진 DNA입자를 제작하여 주사전자현미경 이미지를 통해 1차적으로 크기를 확인하였다. (b)에서도 확인할 수 있듯이 0,5와 1 μm 크기의 입자들은 상대적으로 좁은 분포의 크기를 가진다는 것을 확인하였으나 2 μm 크기 입자의 경우 image j라는 프로그램을 이용하여 크기를 파악하였을 때, 크기가 고르지 않다는 것을 확인하였다. 이후 DLS(Dynamic Light Scattering)이라는 동적 광산란 주사전자현미경을 통해 1 μm 크기의 입자 샘플을 관찰한 결과, 3번의 cycle 모두 거의 차이가 없이 입자 크기가 1 μm 크기로 상당히 균일함을 2차적으로 증명할 수 있었다.
- 이렇게 얻은 다양한 크기의 CpG DNA 입자를 이용해 micro-disk structure를 제작하기 위한 최적화 조건을 찾는 실험을 추가적으로 진행하였다 (Figure 9).

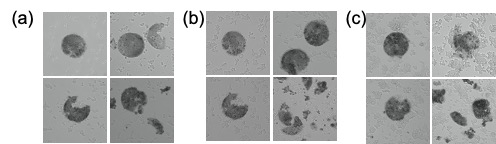
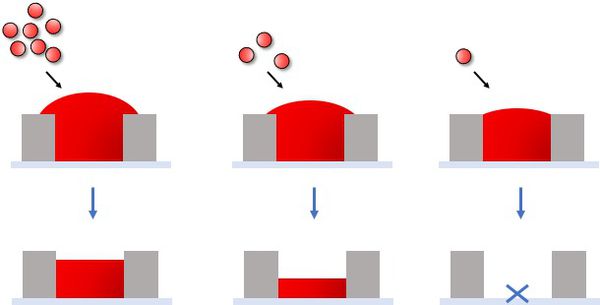
- 서로 다른 크기의 입자 용액의 농도를 모두 1000 ng/μl로 통일한 후 제작한 micro-pattern disk를 광학현미경으로 통해 관찰하였을 때, Figure 9의 (a)처럼 모두 제작이 잘 됨을 확인할 수 있었다. 광학현미경 이미징 software를 통해 각 지점의 contrast 차이를 이용한 3D 이미지도 얻어 각 디스크의 높이가 상당히 비슷하다는 것을 대략적으로 알 수 있었다.
- 하지만 Figure 9의 (b)에서와 같이 주사전자현미경(SEM)으로 서로 다른 크기의 CpG DNA입자로 제작한 disk를 관찰한 결과, 0.5 μm크기의 입자로 이루어진 디스크는 균열이 많고 제대로 disk의 모양을 갖추지 못한다는 것을 볼 수 있었다. 또한, 안정성은 추후에 비교해봐야 알겠지만 2 μm 크기의 입자로 이루어진 disk보다 1 μm 크기의 입자로 이루어진 disk의 높이가 더 높고 균열이 가장 적으며 입자가 가장 촘촘히 압축되어 있는 양상을 보인다는 것(Figure 9 (c))을 확인할 수 있었다.
- 다음 순서로는 위와 같은 결과를 바탕으로 1 μm 크기의 입자 용액의 농도를 조절하여 어느 조건에서 disk가 가장 잘 만들어지는지 확인하는 실험을 진행하였다. 입자용액의 농도는 1000, 700, 500, 300 ng/μl 순으로 감소시켰다. 결론적으로는 Figure 10에서의 그림에서 볼 수 있듯, 입자 용액의 농도가 낮을수록 disk가 잘 만들어지지 않았다. Figure 11의 (a)에서와 같이 광학현미경 상으로는 1000, 700, 500 ng/μl의 입자 용액으로는 disk가 잘 만들어짐을 확인하였고 300 ng/μl의 입자용액부터는 오른쪽 이미지와 같이 disk의 형성이 잘 이루어지지 않는다는 결과를 얻었다.
- 광학현미경을 통해 관찰한 이미지를 바탕으로 1 μm의 CpG DNA로 micro-pattern disk를 만들기 위한 입자 용액의 최소 농도는 500 ng/μl 라는 결론을 내릴 수 있었다. 이와 같은 사실을 바탕으로 300 ng/μl 의 입자 용액을 제외한 700과 500 ng/μl 의 입자 용액으로 micro-pattern disk를 제작해 SEM으로도 이미징을 하였다. 그 결과, Figure 11의 (b)에서와 같이 700 ng/μl 의 입자 용액으로 제작한 disk의 경우 확연히 높은 disk가 형성되는 것을 알 수 있었다.
- CpG DNA로 제작한 disk의 정확한 높이 수치화 및 disk를 이루는 입자 개수의 정량화, 크기, 농도 별 disk의 안정성에 대한 평가는 추후 실시해보아야 하겠지만 이번 프로젝트를 통해 micro-pattern disk 플랫폼은 어떤 서열을 가지는 핵산이던지 간에 제작을 할 수 있다는 사실을 증명하였다. 또한, 5.2에서 RNA 입자를 통해 핵산을 기반으로 한 이 플랫폼의 면역 효과를 어느 정도 입증한 현 상황에서 면역 증진에 효과가 뛰어나다고 알려진 CpG DNA 입자를 이용한 disk의 면역제로서의 면역 유도 효과는 더욱더 뛰어날 것이라고 기대된다.
Micro-pattern disk의 응용
- Micro-pattern disk의 다양한 응용 및 디자인에 대한 아이디어를 실험을 통해 구현해보았다.
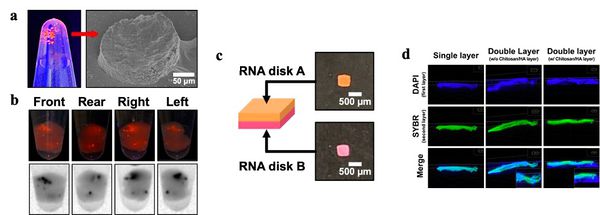
- 35mm 크기의 cell culture dish에 깔린 micro-patterned MPs를 plate에서 회수하였을 때, 구조가 유지된 채로 solution 내로 회수됨을 확인하였다. disk의 controllability가 좋다는 장점을 살리기 위해 disk의 운반체로 DNA hydrogel을 사용하였으며, 2시간 동안 반응기에 넣어 rotation시켰다. DNA hydrogel은 18시간 동안의 RCA(Rolling circle Amplification)을 통해 제작하였다. 그 결과 Figure 12의 (a)와 (b)에서 확인할 수 있듯이 DNA-based scaffold 내에 disk가 encapsulation된 상태로 injection됨을 확인할 수 있었다.
- 역시 같은 맥락에서 disk의 우수한 controllability 특성을 바탕으로 janus disk를 제작해보았다. 기능성이 다른 두 마이크로 입자를 이용하여 양면성을 가진 disk의 제작을 시도하였으며 chitosan/HA를 이용하여 두 층을 분리시킬 수 있는 시스템을 구현하였을 때, double layer가 구분되어 제작됨을 확인할 수 있었다.
- 이처럼 핵산 기반 micro-pattern disk의 조작 용이성을 바탕으로 한 응용에 대한 아이디어를 성공적으로 구현해 내었으며 향후 이를 바탕으로 한 응용의 잠재성이 매우 큰 것으로 기대된다.
개발과제 평가
| 평가항목 | 평가방법 | 적용기준 | 비중(%) |
|---|---|---|---|
| 핵산 입자의 농도,크기에 따른 micro-pattern disk 제작 | 광학 현미경,주사전자현미경 | 육안 이미징 | 30 |
| CpG DNA 입자 제작을 위한 원형 DNA 합성 | 젤 전기영동 | 전기영동 여부 | 10 |
| CpG DNA 입자의 크기 측정 | 동적 광산란, 주사전자현미경 | 크기분포확인 이미징 | 10 |
| CpG DNA 입자의 농도 측정 | 자외선 – 가시광선 분광법 | 농도 확인 | 10 |
| Micro-pattern disk의 serum 내 안정성 파악 | 광학 현미경 | 농도 확인 | 10 |
| RAW 264.7 cell 섭취에 따른 사이토카인 분비 측정 | ELISA(효소결합면역 흡착검사) | 농도 확인 | 10 |
| DNA 하이드로젤을 이용한 micro-pattern disk의 캡슐화 | 형광 현미경 | 농도 확인 | 10 |
| 야누스 micro-pattern disk 제작 | 컨포컬 형광현미경 | 농도 확인 | 10 |
완료 작품의 소개
포스터
개발과제 관련 향후 전망
알려져 있는 모든 생물체에 필수적인 생체 고분자인 핵산은 생체 적합성 면에서 매우 뛰어난 물질이나, 생체 내에 적용하였을 때 안정성이 좋지 못하다는 것이 큰 단점 중 하나이다. 이러한 단점을 보완하고 체내 약물 전달을 효과적으로 하기 위한 방안으로 ‘핵산의 입자화‘ 라는 방법이 이미 고안되었으나, 이 역시 안정성 면에서 한계가 있는 것이 사실이다. 한발 더 나아가 앞서 언급한 핵산 입자를 물리적인 힘으로 압축한 마이크로-디스크 형태의 구조를 개발하였고, 이는 기존의 것보다 안정성이 훨씬 뛰어나며 부가적인 재료가 들지 않아 경제적·시간적 이점이 생길 것으로 예상한다. 뿐만 아니라 핵산이 어떠한 서열을 가지고 있는지에 관계없이 사용자가 원하는 서열의 핵산은 어느 것이던지 입자화하여 마이크로-디스크로 제작할 수 있다는 점이 이전의 기술과 비교하여 가장 큰 장점이자 새로운 점이다. 이번 과제에서 얻은 면역 효과가 뛰어나다고 알려진 CpG DNA입자의 마이크로 디스크 제작의 최적 조건을 이용해 향후 실험실 단계에서의 세포나 실제 체내에 적용해 핵산 기반 약물로 사용하는 시도를 할 수 있을 것이다. 이외에도 다른 다양한 핵산 서열에 대한 마이크로 디스크 제작 기술의 최적화가 이루어진다면 새로운 의공학적인 응용의 패러다임을 제시할 수 있을 것으로 기대된다.
참고 문헌
[1] “항암 화학요법의 이해‘, 대한암협회, http://www.kcscancer.org/bbs/board.php?bo_table=info4&wr_id=5
[2] ”항암 맞춤 표적 치료“, 임호영. 삼성서울병원, http://www.samsunghospital.com/home/healthInfo/content/contenView.do?CONT_SRC_ID=27554&CONT_SRC=HOMEPAGE&CONT_ID=3655&CONT_CLS_CD=001027
[3] 한경환, “공대 교수가 쓴 면역항암제 이야기”, 2020.01.04., https://news.joins.com/article/23672790
[4] “화학요법”, 위키백과, https://ko.wikipedia.org/wiki/%ED%99%94%ED%95%99%EC%9A%94%EB%B2%95
[5] 이승우, “CpG ODN : The Novel Agent For Immunotherapy” , 포항공과대학교 생명과학과 바이러스면역학 실험실
[6] “회전 바퀴형 복제(Rolling circle replication), 분자·세포생물학백과, https://terms.naver.com/entry.nhn?docId=5568931&cid=61233&categoryId=61233
[7] Jong Bum Lee, Heejung Jung, Daieong Kim, Yoon Young Kang, Hyejin Kim, “CpG incorporated DNA microparticles ”, Royal Society of Chemistry, 2018,8, 6608-6615
[8] Kwang Jac Cho, “Therapeutic Nanoparticles for drug delivery in cancer”, Korean J Otolaryngol, 2007,50,562-72
[9] Michael G. Mohsen, Eric T. Kool “The Discovery of Rolling Circle Amplication and Rolling Circle Transcription” , HHS Public Access, 2016,49(11), 2540-2550
[10] Gunatillake, P. A., & Adhikari, R. (2016). “Nondegradable synthetic polymers for medical devices and implants”, In Biosynthetic Polymers for Medical Applications (pp. 33–62).
[11] Kyungsun, P., Kiseok, L., & Myungmo, S. (2012). “소프트 리소그래피(Soft Lithography)를 이용한 마이크로/나노 패터닝 기술”, Polymer Science and Technology, 23(6).
[12] Choi, D.-G., Yu, H. K., Jang, S. G., & Yang, S.-M. (2003). “Arrays of Binary and Ternary Particles and Their Replica Pores on Patterned Microchannels.”, Chemistry of Materials, 15(22), 4169–4171.
[13] 콜리 파마슈티칼 게엠베하, "면역 자극 활성이 증강된 소수성 T 유사체를 함유하는 CpG 올리고뉴클레오티드 유사체", 특허등록 1012517070000 (2013)
[14] 한림대학교 산학협력단, "리포좀에 포집된 올리고뉴클레오타이드 및 에피토프를 포함하는 면역증강용 조성물(Immunostimulatory Compositions Comprising Liposome―Encapsulated Oligonucleotides and Epitopes)", 특허등록 1014359530000 (2014)
[15] 한국과학기술연구원, "RCT에 의한 siRNA 다량체의 제조방법 및 상기 방법에 의하여 제조된 siRNA 다량체", 특허등록 10153305900000 (2015)
[16] 삼성전자 주식회사, “변형된 RCA 및 2차 프라이머에 의한 핵산 증폭 방법 (Amplification method of nucleic acid sequence usingmodified RCA and second primer)”, 특허출원 1020060073815(2006)
[17] Stephen KingsmoreR. Steven WiltshireJeremy P. Lambert, “Poly-primed amplification of nucleic acid sequences(핵산의 염기서열의 Poly-primed 증폭)”, 특허등록 06670126 (2003)
[18] 한국생산기술연구원, 한국기계연구원, “나노입자 패터닝 방법”, 특허등록 1020040109984 (2004)
[19] 성균관대학교산학협력단, “계층적 은나노 구조체 및 이의 제조방법”, 특허등록 1020160124482 (2016)
[20] 박해인, 김미진, 곽민석. (2015). DNA 나노구조와 혼성소재. 고분자 과학과 기술, 26(5), 423-429.
[21] Krieg, Arthur M., et al. “CpG motifs in bacterial DNA trigger direct B-cell activation.”, Nature, 374.6522(1995): 546-549.
[22] H. Jung, D. Kim, Y. Y. Kang, H Kim, J. B. Lee and H. Mok, RSC Advances, 2018, 8, 6608-6615.
[23] “다케다알보칠콘센트레이트액(폴리크레줄렌).”, 식품의약품안전처, https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetail?itemSeq=201506617
[24] “오라메디”, 동국제약, https://dkbrand.co.kr/brand/oramedy/story.php
[25] “아프니벤큐 액.”, 코오롱제약, http://www.kolonpharm.co.kr/product/product_info_view.jsp?pk_seq=170&page=1
[26] “아프타치 정.”, 동화약품, https://www.dong-wha.co.kr/product/content.asp?t_idx=93&b=20&s=24
[27] Diehl, Kari-Heinz, et al. “A good practice guide to the administration of substances and removal of blood, including routes and volumes.”, Journal of Applied Toxicology: An International Journal 21.1(2001): 15-23.