간담상조
프로젝트 개요
기술개발 과제
국문 : 이중 인화 전이 금속 조촉매 부착 광촉매를 통한 수소 생산 및 경제성 평가
영문 : Evaluation of photocatalyst using binary transition metal phosphide for their Hydrogen production & Economic Values
과제 팀명
간담상조
지도교수
김정현 교수님
개발기간
2021년 9월 ~ 2021년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학부·과 2018890032 박수연(팀장)
서울시립대학교 생명공학부·과 2017560001 강빈
서울시립대학교 화학공학부·과 2018890013 김도현
서울시립대학교 환경공학부·과 2016890009 김동현
서울시립대학교 환경공학부·과 2016890074 한주영
서론
개발 과제의 개요
개발 과제 요약
내용
개발 과제의 배경
내용
개발 과제의 목표 및 내용
내용
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
- 전 세계적인 기술현황
내용
- 특허조사 및 특허 전략 분석
내용
- 기술 로드맵
내용
시장상황에 대한 분석
- 경쟁제품 조사 비교
내용
- 마케팅 전략 제시
내용
개발과제의 기대효과
기술적 기대효과
내용
경제적, 사회적 기대 및 파급효과
내용
기술개발 일정 및 추진체계
개발 일정
내용
구성원 및 추진체계
내용
설계
설계사양
제품의 요구사항
내용
설계 사양
내용
개념설계안
1. 촉매 선정 및 합성 방법 결정
- 광촉매 수소 생산 매커니즘 이해 - 수소 생산을 효율적으로 하기 위한 촉매 선택 조건 조사 - Band gap position을 고려해 가장 수소 생산 효율이 좋은 촉매 물질 선정 - 문헌 조사를 통해 합성 방법 결정
2. 촉매 합성
- 실험 여건, 물질의 위험도, 가격 등을 고려해 가장 적합한 촉매 합성 방법 선정 - 실험 인원 배정 및 실험 진행
3. 촉매 성능 평가
- Ultraviolet–visible spectroscopy로 Absorbance 측정 - Tauc Plot으로 Band gap 계산 - Conduction Band 위치와 측정한 Band gap으로 Band position 파악 - Gas Chromatograpy로 누적 수소 생산량 계산 - Gas chromatograpy data를 보정한 시간 당 수소 생산 속도 계산
4. 문헌 고찰
- 직접 측정한 Primary Data로 설명할 수 없는 데이터 고찰
5. 경제성 평가
- 비교군을 선정해 촉매 1g 당 가격 산정 후 비교 - 가격 대비 성능 개선 능력을 계산해 비교
이론적 계산 및 시뮬레이션
내용
상세설계 내용
3.4.1 광촉매 합성 방법
- nanorod CdS 합성(solvothermal method)
1) cadmium chloride 9.26 g와 thiourea 9.26g 을 계량한 후, ethylenediamine 120mL에 넣고 한 시간 동안 stirring 시켜준다. 2) 잘 섞은 solution은 120mL의 Teflon-lined autoclave로 옮긴 후 hydrothermal method로 36시간 동안 160°C로 유지시킨다. 3) 반응이 끝나면 노란색 침전물을 DI water와 ethanol로 각각 헹궈준 후 80 °C에서 말린다.
- g-C3N4 합성
1) 5g의 melamine을 막자사발에 담고 절구로 곱게 갈아준다 2) 갈은 melamine을 세라믹 도가니에 넣고 알루미늄 포일로 감싼 뒤 muffle furnance에서 5의 heating 속도, 550 에서 4시간 동안 calcin시킨다 3) 가열 후 실온이 될 때까지 식혀준다. 4) 식은 것을 다시 막자사발에 넣고 잘 갈아준다.
- CoNiP 합성
1) NiCl2·6H2O와 CoCl2·6H2O, Urea 0.2g을 20mL DI water와 20mL Glycol 용액에 녹인다. 2) Teflon-lined autoclave로 옮기고 140 °C for 10 h 열처리를 해준다. 3) 침전물을 에탄올과 DI water로 세척해준다. 4) 공기 중에서 400 °C로 2시간 동안 calcinate 시켜 검정색 코발트 니켈 산화물을 얻는다. 5) 과량의 NaH2PO2와 섞어준 후 250 °C로 2시간 동안 가열해준다. 6) DI water와 애탄올로 세척해준다.
- CdS/g-C3N4 composite 합성(chemisorption and self-assembly)
1) 앞서 합성한 g-C3N4 0.06g을 20mL Acetone 에 homogenous하게 disperse시킨다. 2) CdS 1.5g을 추가적으로 넣어준 후 24시간 동안 stirring 시킨다. 3) rotary evaporator를 사용해 Acetone 용매를 날려준다. 4) 노란 고체를 얻어낸 후 60 °C 진공 상태에서 말려준다.
- CoNiP/CdS/g-C3N4 (in-situ hydrothermal synthesis)
1) 앞서 준비된 CdS/g-C3N4 0.2g을 20mL의 ethanol과 12.5mL의 ultrapure water를 혼합한 용매에 넣는다. 2) 앞서 합성한 CoNiP를 혼합 용매에 넣어준다. 3) 10분간 stirring 시켜준다. 4) 얻은 혼합 용매는 Teflon-lined autoclave로 옮긴 후 160 ℃로 6시간 동안 유지해준다. 5) hydrothermal reaction이 끝나면, 생성물을 모은 후 DI water로 세 번 행궈준다.
3.4.2 광촉매 성능 평가
1. Absorbance
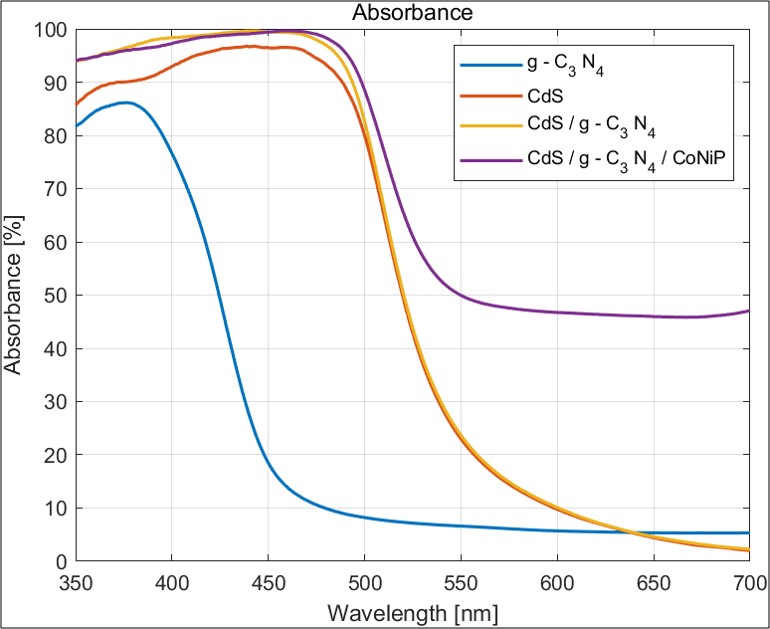
uv-vis spectroscopy를 이용해 Absorbance를 측정하였다. Absorbance란 해당 파장에 해당하는 빛을 얼마나 흡수할 수 있는지를 평가하는 지표로서, 해당 촉매가 수소 생산에 빛을 얼마나 활용할 수 있는지를 나타낸다. Absorbance는 수소 생산 매커니즘의 첫 번째 과정인 빛을 흡수해 전자 정공 분리와 관련이 깊기 때문에 촉매의 성능을 판단한 중요한 지표가 된다.
측정 결과 g-C3N4, CdS, CdS/g-C3N4 , CdS/g-C3N4/CoNiP 순서로 absorbance가 증가했다. 이와 같은 이유가 나온 이유는 다음과 같이 정리할 수 있다.
- g-C3N4보다 CdS의 band gap이 좁음
- Heterojunction type 2가 형성되었을 것임
- 조촉매가 Absorbance 향상에 도움을 주었을 것임
따라서 정확한 고찰을 위해선 Band gap 측정과 Band position을 파악하는 것이 필수불가결하다.
2. Band gap & Band gap position
앞선 Absorbance의 이유를 고찰하기 위해 Band gap을 구하고, 문헌 Conduction Band값을 이용해 Band position을 그려보았다.
Tauc Plot의 x축 : E= hc/λ
Tauc Plot의 y축 : (αhv)^2=2.303*absorbance*E
λ∶ 빛의 파장(nm), h:플랑크 상수, c: 빛의 속도
Absorbance Data를 위의 식에 대입해 Tauc Plot을 얻은 후, 접선의 x절편 값으로 Band gap을 구할 수 있다.
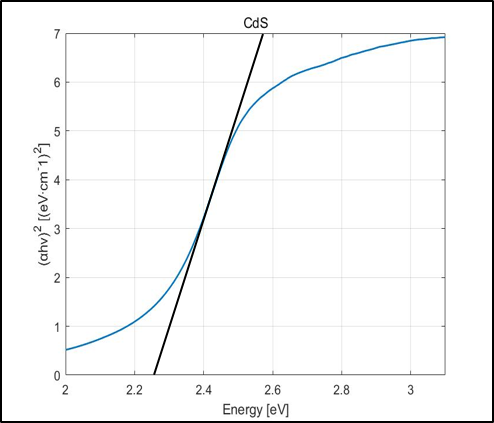
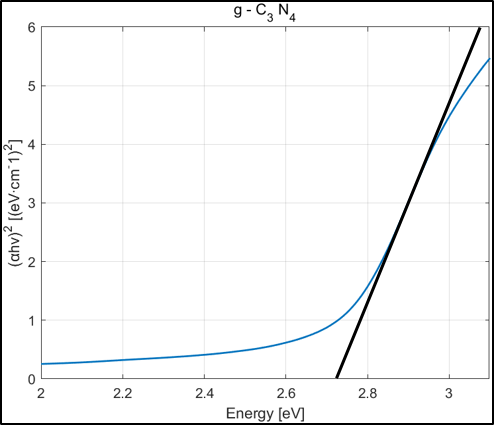
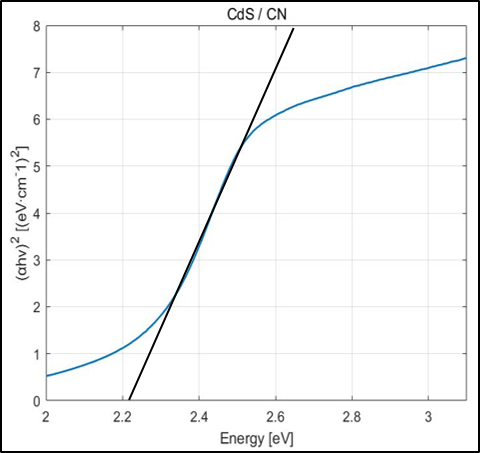
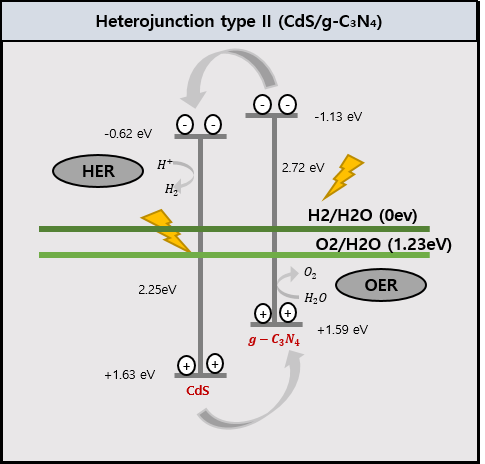
CdS는 2.25eV, g-C3N4는 2.72eV의 Band gap을 가지고 있었으며 Heterojunction을 형성했을 땐 2.21eV로 band gap이 줄어들었다. 이를 토대로 Band Position을 그려본 결과 CdS와 g-C3N4 사이에 Heterojunction type 2가 형성되었음을 확인할 수 있었다.
결론적으로, Heterojunction에 의해 Band gap이 좁아져 더 많은 가시광선을 전자 정공 분리에 이용할 수 있었으며 전자 정공의 재결합율을 줄여 수소 생산 반응이 더 활발히 일어날 수 있었다.
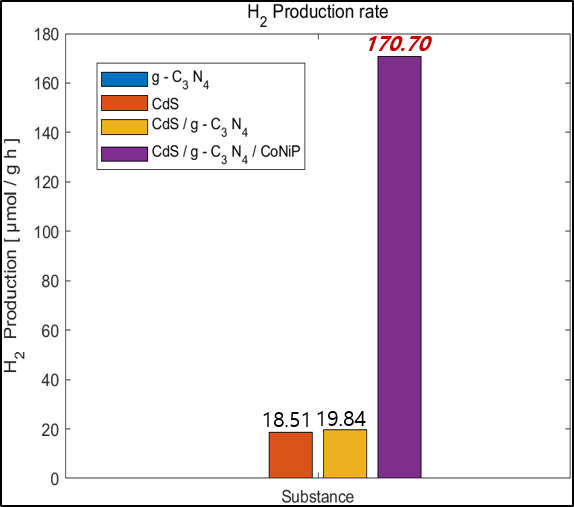
3. 누적 수소 생산량
수소 생산 생산량을 측정하는 기구로는 가스크로마토그래피를 사용하였다. 가스 크로마토 그래피에선 시료의 각 성분과 충전제의 친화력로 생긴 컬럼 속 이동 속도차가 발생하는데 이용한 캐리어 가스와의 열전도율차에 의해 농도에 비례해 불평형 전위차가 생기고 그 전위차를 기록으로 얻을 수 있다. 시간 마다 측정해 얻은 피크 면적을 얻었으며 피크 면적은 캐리어 가스 속의 분리 성분의 농도에 비례하기 한다. 다음은 얻은 데이터로 그린 누적 수소 농도이다.
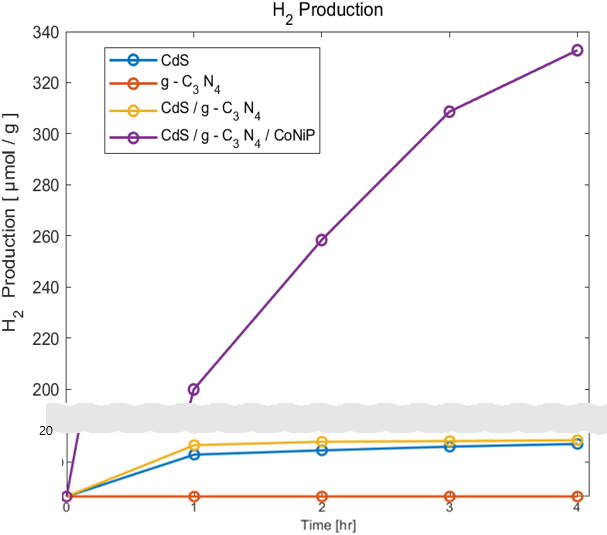
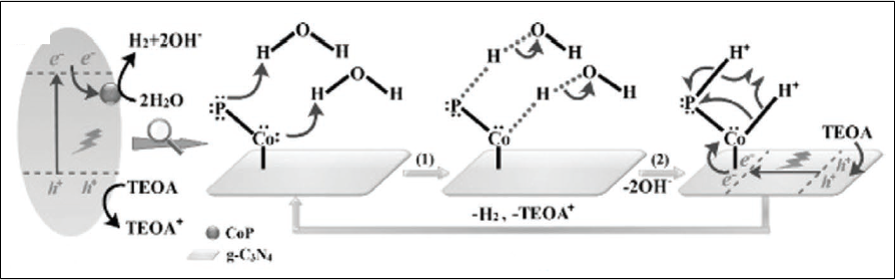
앞서 Band position을 그려보았을 때 수소 생산 Potential에 미치지 못했던 g-C3N4는 수소를 생산하지 못했으며 CdS는 소량 수소가 발생하였다. Heterojunction을 형성하면 수소와 산소 생산 포텐셜에 conduction band와 valence band가 더 가까워지므로 더 많은 수소가 생산되었다. 조촉매인 CoNiP를 부착하였을 때 수소 생산 속도는 약 8~10배 증가하였다. 조촉매 부착시 수소 생산 증가는 g-C3N4의 N과 CoNiP 속 Co,Ni 그리고 P가 결합을 통해 직접적인 전자 전달을 활성하고 active site를 제공하기 때문에 발생한 결과이다.
4. 시간 당 수소 생산 속도
가스크로마토그래피에서 각 성분의 면적으로 수소 생산량을 구했다. 그러나, 개개의 성분의 열전도율이 다르기 때문에 기계 감도차로 피크 면적에 오차가 발생한다. 따라서, 얻은 피크 면적의 보정이 필요하다. 사용한 캐리어 가스인 질소 면적을 이용해 생산된 수소의 면적을 보정을 해 가스 속 수소의 함량을 구했다. 추가적으로, 순수한 수소 1,4% 로 reference를 잡아 fitting을 해주고 이상 기체 방정식을 이용해 오차가 보정이 된 수소 생산 속도를 구해주었다.
그 결과 CoNiP를 조촉매로 이용했을 때 CdS/g-C3N4 Heterojunction 광촉매 대비 8.60배 수소 생산 속도가 향상되었다.
5. 경제성 평가
본 연구의 가장 큰 목표는 수소 생산 속도를 높여줄 경제적인 광촉매를 합성하는 것이다. 경제성 부분에서 가장 문제가 되는 부분은 조촉매로 이용하는 귀금속이다. 귀금속은 비쌀 뿐만 아니라 그 자원의 양이 한정적이다. 이를 대체할 조촉매로 TMP가 주목 받고 있으며 우리는 CoNiP라는 binary TMP로 경제성과 성능을 모두 갖춘 광촉매 개발을 목표로 하였다. 따라서 촉매 1g당 가격과 가격대비 성능을 계산하였고 Secondary Data로 문헌값을 이용해 다른 조촉매와 비교해보았다.
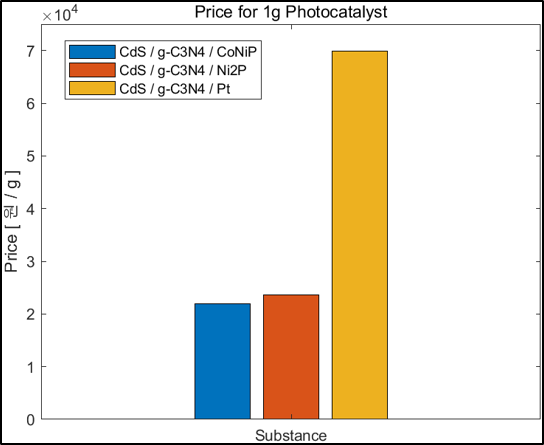
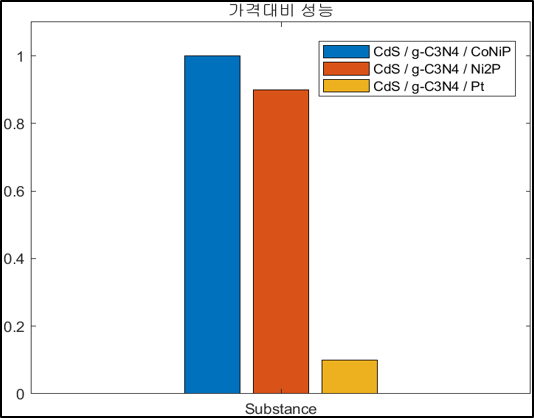
결과 및 평가
완료 작품의 소개
프로토타입 사진 혹은 작동 장면
내용
포스터
내용
관련사업비 내역서
내용
완료작품의 평가
내용
향후계획
내용
특허 출원 내용
내용