김앤장
프로젝트 개요
기술개발 과제
국문 : Density functional theory 계산을 통한 Protonic ceramic electrolysis cell의 air electrode로 사용되는 PrBa0.5Sr0.5Co1.5Fe0.5O5+δ의 촉매적 특성 파악
영문 : Understanding catalytic properties of PrBa0.5Sr0.5Co1.5Fe0.5O5+δ for the air electrode of Protonic Ceramic Electrolysis Cell using Density Functional Theory calculations
과제 팀명
김앤장
지도교수
유종석 교수님
개발기간
2020년 9월 ~ 2020년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20153400** 장*환(팀장)
서울시립대학교 화학공학과 20173400** 김*수
서론
개발 과제의 개요
개발 과제 요약
- Density functional theory(DFT) 계산을 통한Protonic ceramic electrolysis cell(PCEC)의 air electrode로 이용되는 PBSCF 물질의 촉매적 특성파악
- PBSCF 물질의 특성인 oxygen vacancy(OV) formation 경향성을 파악하고, 이 OV가 전체적인 촉매 성능에 어떠한 영향을 미치는지 파악
- PBSCF 물질의 촉매적 특성인 산소, 수소 이온 전도도 분석
- PCEC에서 수소를 생성하기 위한 반응의 일환으로 발생하는 oxygen evolution reaction(OER) 메커니즘 파악 및 특성 분석
개발 과제의 배경
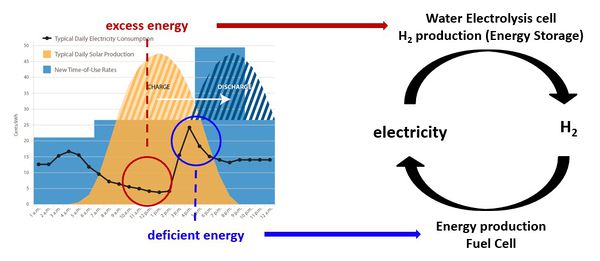
- 세계적으로 친환경적인 에너지를 개발하기 위한 관심이 매우 증가하고 있는 상황. 이와 관련하여 태양에너지나 풍력 에너지 등 신재생 에너지를 통한 전기 생산이 증가하고 있음. 신재생 에너지는 일정하게 전기를 생산할 수 있는 기존의 방식과 다르게 환경에 영향을 받기 때문에 일정한 전기 생산이 불가능하다는 단점이 있음. 따라서 신재생 에너지를 통해 생산한 전기를 효율적으로 저장할 수 있는 기술이 필요하고, 현재 수소를 이용한 방법이 주목을 받는 중임.
- 현재 수소를 생산하는 대부분의 방식은 화석 연료를 정제하는 과정에서 나오는 수소를 이용하는 부생수소 방식으로 엄밀하게 친환경적이라고 할 수 없음. 친환경적으로 수소를 생산하는 방식으로는 전기를 이용한 물의 전기분해를 통해 수소를 생산하는 방법이 있음. 따라서 전기분해를 통한 수소 생산의 효율성을 높이는 분야의 연구가 활발하게 이루어지고 있는 중임.
- 기존에 물의 전기분해를 통한 수소 생산의 촉매로 가장 좋은 성능을 보인 촉매는 이리듐과 같은 귀금속 촉매로 가격이 비싸다는 단점이 존재함. 전기 분해를 통한 수소 생산의 다양한 방식 중 PCEC의 경우 고온(500-700℃)에서 반응이 진행되기 때문에 귀금속 촉매가 아닌 페롭스카이트 물질을 이용한 셀도 기존의 귀금속 촉매와 비견할만한 성능을 보인 기존 연구 결과들이 존재함. PCEC에서 페롭스카이트 물질들이 좋은 성능을 보였다는 실험적 결과는 있지만 이론적으로 해당 물질의 특성이나 반응 메커니즘을 규명한 연구는 부족함. 따라서 이번 연구는 Vienna Ab initio Simulation Package(VASP)을 이용하여 실험을 통해 PCEC의 air electrode로 좋은 성능을 보인 PBSCF 물질의 다양한 특성을 분석하여 왜 좋은 성능을 보일 수 있는지, 어떻게 하면 더 좋은 성능을 보일 수 있을지 파악하고자 함. 이러한 연구결과를 바탕으로 PCEC에 대한 더 깊은 이론적 이해가 가능할 것으로 예상됨. 이러한 이해를 바탕으로 더 좋은 성능을 내는 촉매를 개발할 수 있을 것으로 기대됨.
- 이러한 연구를 진행함에 있어서 주목해야 할 것은 PBSCF 물질의 특성인 OV formation임. PBSCF는 물질을 합성하는 과정에서 OV가 자연적으로 발생함. 따라서 PBSCF를 컴퓨터 상에 모델링할 때 역시 OV가 존재하는 위치와 개수를 파악해야 더 정확한 시뮬레이션이 가능할 것으로 예상됨. 또한 OV가 또 중요한 이유는, 기존 연구 결과 OV formation을 통한 pore channel의 존재가 PBSCF 내부에서 산소 이온의 전도도에 큰 영향을 미친다는 결과가 있기 때문임. 따라서 이번 연구를 통해 vacancy concentration의 변화에 따른 산소 이온의 전도도를 계산적으로 파악하여 검증해보고 나아가서 수소 이온의 전도도에 미치는 영향 역시 파악할 수 있음.
개발 과제의 목표 및 내용
- 더 정밀한 물질 구조를 표현하기 위해 PBSCF 물질의 특성인 OV formation을 계산적으로 확인하여 OV가 어느 위치에, 얼마나 존재하는지 파악
- 다양한 vacancy concentration 조건에서 산소, 수소 이온의 전도도가 어떻게 바뀌는지 파악하여 OV가 이온 전도도에 미치는 영향 파악
- 물의 전기분해를 통한 산소와 프로톤의 형성 메커니즘을 규명하여 반응에 영향을 끼치는 요소를 파악하고 그 중 가장 큰 영향력을 지니는 요소는 무엇인지 파악
- PBSCF에 존재하는 OV가 물질의 촉매적 특성인 이온 전도도와 OER 활성도 등에 어떤 영향을 미치는지 파악
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
전 세계적인 기술현황
- Sihyuk Choi et al.은 Solid oxide fuel cells(SOFC) 시스템에서 PrBa0.5Sr0.5Co2-xFexO5+δ 물질의 pore channel 생성과 관련하여 pore channel이 산소 이온의 전도도의 향상에 매우 큰 영향을 미친다는 사실을 발견함. 산소 이온의 전도도 향상과 더불어 표면에서의 산소 교환 역시 향상되었으며 물질의 안정성 역시 유지되는 것을 확인함. 이는 상업적인 SOFC 기술의 발전에 큰 발견이라고 할 수 있음.
- 이를 바탕으로 최근에는 500-650℃에서 구동하는 steam electrolysis 시스템 중 protonic ceramic electrolysis cell(PCEC)를 사용하는 경우 PrBa0.5Sr0.5Co2-xFexO5+δ 물질을 공기극으로 하여 높은 수소 이온 전도도를 보임. 특히 electrolysis cell과 fuel cell을 가역적으로 reversible하게 구동할 수 있다는 결과를 보여 전기가 과도하게 생산되는 경우 이를 이용해 수소 기체를 생성하고, 에너지가 필요할 때 다시 수소 기체를 이용하여 전기를 생산할 수 있는 차세대 에너지 저장 방법을 가능하게 함. 이 연구 결과에서 보인 성능은 600℃에서 구동하여 –1.80 A/cm2를 보였고 구동 전력은 1.3 V 인 결과를 보임. 이는 전기화학적인 효율로 76%에 도달하는 경우임.
- Chuancheng Duan et al.은 에너지 전환과 저장 능력에 주목하여 reversible fuel cell에 기반한 PCEC를 yttrium and ytterbium co-doped barium cerate–zirconate 물질을 전해질로 이용하고 세 개의 air/steam (reversible) 전극을 이용하여 좋은 성능을 보이는 cell 개발에 성공함. 이들의 전기화학적 cell은 효율을 90-98%까지 보였으며 흡열과정으로 최대 97%의 전기-수소 전환 효율을 –1000 mA/cm2에서 보임.
- 한국과학기술연구원 고온에너지 재료연구센터에서는 PCEC 용 고성능 전해질 재료로 BaCeO3-BaZrO3 고용체(BCZY)의 개발에 성공함. Soid oxide fuel cells (SOFCs)의 경우 일반적으로 높은 온도에서 작동하기 때문에 여러 제약이 존재함. 따라서 PCFC 에서는 작동온도를 낮추려는 여러 연구들이 있었고, 이 연구에서는 페로브스카이트 종류 중 하나인 BaCe0.85-xZrxY0.15O3-δ (BCZY, x=0.1, 0.3, 0.5, and 0.7)을 합성하여 open-circuit voltage (OCV) 1.05 V를 얻어내었고 650℃에서 최고 에너지 밀도를 370 mW/cm2 로 얻어냄.
특허조사
1. Perovskite oxide catalyst for oxygen evolution reactions
- - 미국 특허
- - 출원 번호 : US2016/0348257A1
- - 출원 날짜 : Dec.1,2016
- - 출원인 : OSAKA PREFECTURE UNIVERSITY PUBLIC CORPORATION, Sakai-shi (JP); FUJI DIE CO., LTD., Tokyo (JP)
- - 요약 : OER(Oxygen Evolution Reaction)을 위한 촉매는 RuO2 및 IrO2와 같은 보편적이고 비싼 귀금속 산화물 촉매보다 좋은 반응성과 긴 수명을 가지고 있음. OER 촉매로서 A-site ordered perovskite 산화물 촉매 (CaCu3Fe4O12 및 CaMn3Mn4O12 등)는 경제성이 우수함. 이 촉매는 귀금속 산화물 촉매에 비해 촉매의 활성이 높으며, 산화 반응 조건에서도 매우 안정적이므로 사용 수명이 김. 촉매로 인해 금속-공기 전지의 전하 반응, 직사광선에 의한 직접적인 물 분해 반응에서의 anode OER 등과 같은 중요한 에너지 변환 반응이 예상됨.
2. Methods and system for hydrogen gas production through water electrolysis, and related electrolysis cells
- - PCT (국제 특허)
- - 출원 번호 : WO 2016/079746 A1
- - 출원 날짜 : 2018.02.01
- - 출원인 : Battelle Energy Alliance, LLC
- - 요약 : 수소 가스를 생산하는 방법은 양극, 음극 및 양극과 음극 사이의 양성자 전도 막을 포함하는 전기 분해 셀에 기체 물을 도입하는 것을 포함함. 양성자 전도성 막은 약 150 °C 내지 약 650 °C 범위 내의 하나 이상의 온도에서 약 10-2 S / cm 이상의 이온 전도도를 갖는 전해질 물질을 포함함. 전기 분해 셀을 사용하여 수증기를 환원시킴. 수소 가스 생산 시스템과 전기 분해 셀도 설명하고 있음.
3. 이중층 페로브스카이트 구조를 가지는 부분 산화제, 이를 포함하는 수소 발생장치
- - 대한민국 특허
- - 출원 번호 : 1020150037380
- - 출원 날짜 : 2015.03.18
- - 출원인 : 울산과학기술원
- - 요약 : 강한 상 안정성과 빠른 산소 환원 속도를 가지는 이중층 페로브스카이트 구조를 가지는 부분 산화제를 제공함. 본 발명의 일실시예에 따른 부분 산화제는 화학식 RBaMn2O5+δ의 화합물을 포함할 수 있음. 상기 화학식에서, 상기 R은 희토류족 또는 란탄족에서 선택된 하나 또는 그 이상의 원소들을 포함하고, O는 산소이고, 상기 δ는 0 또는 1 이하의 양수로서, 상기 화학식 1의 화합물을 전기적 중성으로 하는 값임.
4. Electrochemical cells for hydrogen gas production and electricity generation, and related structures, apparatuses, systems, and methods
- - PCT (국제 특허)
- - 출원 번호 : WO 2020/092203 A1
- - 출원 날짜 : 2019.09.04
- - 출원인 : Battelle Energy Alliance, LLC
- - 요약 : 전기 화학 전지는 제 1 전극, 제 2 전극, 및 제 1 전극과 제 2 전극 사이의 양성자 전도성 막을 포함함. 제 1 전극은 Pr(Co1-x-y-z, Nix, Mny, Fez)O3-δ를 포함하며, 여기서 0≤x≤0.9, 0≤y≤0.9, 0≤z≤0.9, δ는 산소 결핍임. 제 2 전극은 하나 이상의 금속 및 하나 이상의 페로브스카이트를 포함하는 서멧 재료를 포함함. 관련 구조, 장치, 시스템 및 방법도 설명됨.
특허 전략
- 현재 페로브스카이트 촉매는 태양 전지 분야에 대해서만 주로 특허가 출원되고 있음. 하지만, 페로브스카이트를 이용하여 수소를 생산하는 방법은 아직 다양한 특허가 출원되지 않고 있음.
- PCEC에서 좋은 성능을 보인 페로브스카이트 물질인 PBSCF 물질의 다양한 특성을 분석하여 왜 좋은 성능을 보일 수 있는지, 어떻게 하면 더 좋은 성능을 보일 수 있을지 파악하고자 함.
- 이 연구를 통해 얻은 계산 결과와 추후 실험을 통해 얻은 결과를 비교했을 때 그 경향성과 결과가 동일하다면 계산 결과가 타당하다고 볼 수 있음. 따라서 일반적으로 특허를 실험 결과를 이용하여 출원하지만, 이번 연구에서 얻은 DFT 계산 결과를 포함하여 특허를 출원한다면 더 근거 있는 특허를 출원할 수 있을 것이라 생각됨.
개발과제의 기대효과
기술적 기대효과
- 수소 이온의 전도도 및 산소 이온의 전도도가 OV의 비율에 따라 변하는 경향성을 파악하였으므로 이 결과를 통해 더 좋은 이온 전도성을 가지는 페로브스카이트 물질의 개발에 이용될 수 있을 것으로 판단됨.
- 조건을 모두 충족시키는 PBSCFO 물질의 조건을 파악함으로써 PCEC 시스템 및 PBSCFO 물질의 이해도가 증가할 것으로 보임.
- PCEC 시스템에서 최고의 활성을 가지는 PBSCFO 물질의 개발을 이끌어 낼 수 있음.
경제적, 사회적 기대 및 파급효과
- 화석 연료를 사용하지 않고 전기분해를 통한 수소 생산 방법으로 환경 친화적인 방법임.
- 수소 생산의 촉매로 가장 좋은 성능을 보인다고 알려진 이리듐과 같은 비싼 귀금속 촉매 대신 페롭스카이트 물질들을 이용하여 더 경제적으로 수소를 생산할 수 있음.
- 연구결과를 바탕으로 PCEC에 대한 더 깊은 이론적 이해가 가능할 것으로 예상됨. 이러한 이해를 바탕으로 더 좋은 성능을 내는 촉매를 개발할 수 있을 것으로 기대됨.
기술개발 일정 및 추진체계
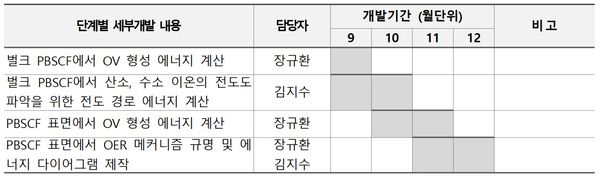
개발 일정
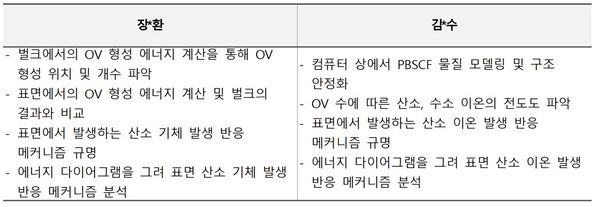
구성원 및 추진체계
설계
설계사양
제품의 요구사항
- PCEC의 공기극으로 사용되는 PBSCFO 전극의 이해도 향상을 위한 이온 전도도, 표면 반응 활성 등 촉매적 특성 분석
- PBSCFO의 물질적 특성인 산소공극 (oxygen vacancy) 형성이 촉매적 특성에 미치는 영향 파악
설계 사양
- VASP 프로그램을 이용하여 PBSCFO를 컴퓨터 상에 구현
- 이전 연구를 참고하여 페롭스카이트 구조를 모델링할 수 있음
개념설계안
- 벌크 PBSCFO 내부에서 Oxygen vacancy(OV) 형성 에너지를 계산하여 기존의 실험 결과와 동일하게 OV가 물질 내부에 자연적으로 형성이 되는지 확인. 이 과정을 통해 PBSCFO 내부에 OV가 어디에, 얼마나 생길 것인지 파악할 수 있음.
- 위 과정을 통해 얻어진 OV 위치를 이용해서 OV가 산소, 수소 이온의 전도도에 어떤 영향을 미치는지 확인하기 위해 먼저 전도 경로를 파악. 이후 에너지 다이어그램을 그려 내부의 OV concentration에 따른 이온전도도의 변화를 파악할 수 있음.
- 이후 표면에서의 OER 메커니즘을 규명하기 위해 PBSCFO 표면 모델을 모델링함. 이후 표면에서의 OV 형성에너지를 계산하여 벌크에서의 값과 비교해서 벌크와 표면 중 어디에서 OV가 더 잘 형성되는지 비교함.
- 표면의 OV를 이용해서 물 분해가 산소 이온과 수소 이온을 형성하는 메커니즘을 규명하여 에너지 다이어그램을 통해 어느 메커니즘이 에너지적으로 유리한지 비교.
이론적 계산 및 시뮬레이션
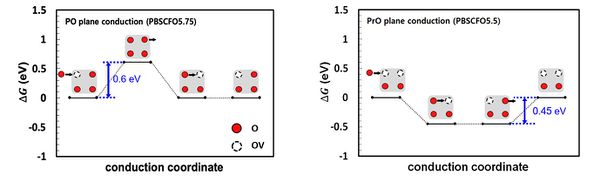
- 벌크에서의 OV 형성 에너지를 계산한 결과 첫 번째 OV를 형성하는 것은 PO plane에서 발생하는 것으로 확인되었으며, 깁스자유에너지가 음수로 자발적으로 발생하는 반응인 것이 확인됨. 이후 두 번째 OV 형성 에너지를 계산한 결과 모든 산소 사이트에서 깁스자유에너지가 양수로 두 번째 OV는 형성되지않는 것으로 확인되었음.
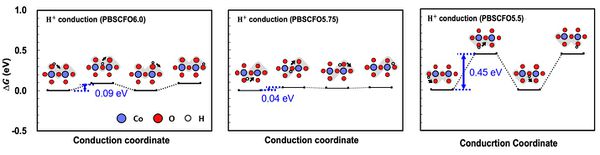
- 얻어진 OV 위치를 바탕으로 다양한 OV concentration 조건에서 산소 이온의 전도도와 수소 이온의 전도도를 파악하기 위해 전도 경로를 파악함. 이후 해단 전도 경로를 따라 이동할 때의 에너지 다이어그램을 그려 OV가 이온 전도도에 미치는 영향을 파악함. 산소 이온의 경우 OV가 많을수록 전도가 쉬웠으며, 수소 이온의 경우 내부에 2OV가 존재할 때 급격히 전도도가 낮아지는 것으로 확인되었음. 두 이온 모두 온도 조건(500℃)에서 전도가 쉽게 발생하는 조건임.
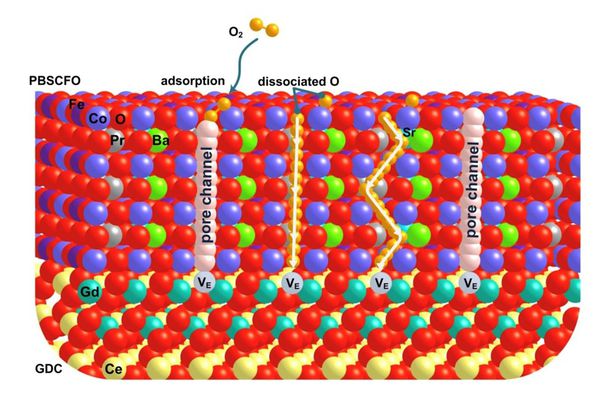
- 지금까지의 결과를 통해 PBSCFO 벌크에서의 다양한 특성을 확인함. 나아가 PBSCF의 표면에서의 다양한 반응 메커니즘을 파악하여야 PCEC에서 PBSCFO가 어떤 특성을 지니는지 파악할 수 있음. 이를 위해 표면을 아래 그림과 같이 모델링 하였음.
- 이와 같이 모델링된 표면 모델에 대해 우선 산소 vacancy 형성 에너지를 계산하였음. 표면에서의 반응 역시 OV의 농도에 따라 영향을 받을 것으로 예상되기 때문에 자연적으로 형성되는 OV 농도와 위치를 먼저 파악하는 것이 중요함. 산소 vacancy 형성 에너지를 실제로 계산한 결과 벌크에서보다 많은 두 개까지의 OV가 형성되는 것을 확인함. 이와 더불어 OV가 형성되는 위치는 벌크에서의 경향성과 동일하게 Pr plane에서 형성되는 것이 안정함을 확인하였음.
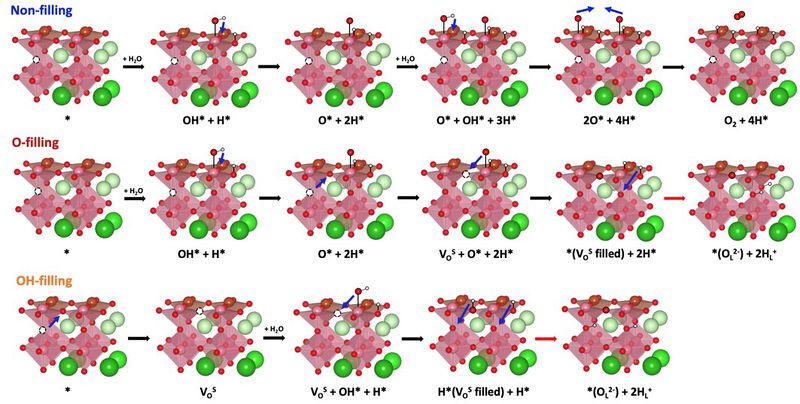
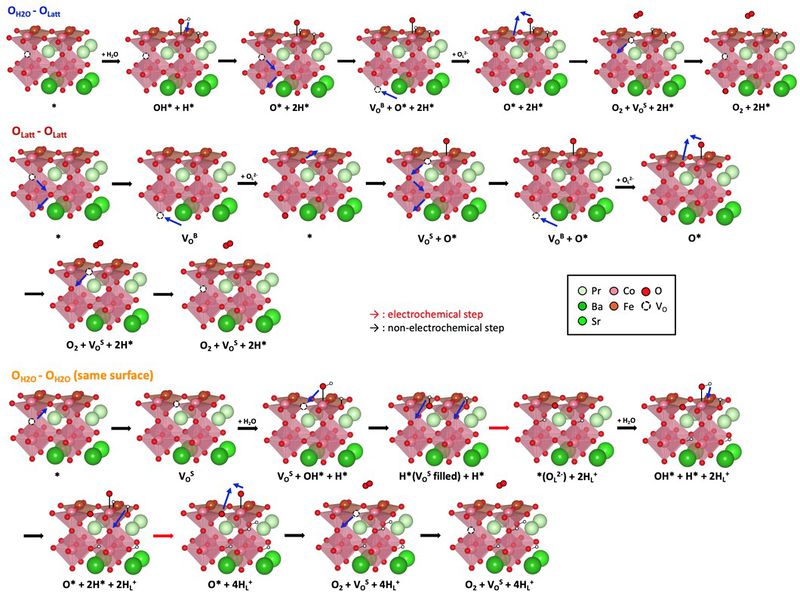
- OV 형성 에너지를 토대로 표면에서의 반응인 OER 반응에 대해 연구할 수 있음. 기존 연구에서 자주 사용되는 OER 메커니즘은 알칼리 수용액 내에서 진행되는 표면 반응으로 물에서 분해되는 수소는 수소 이온 형태로 수용액에 용해됨. 하지만 PCEC 같은 경우 수용액 상에서 진행되지 않는 steam electrolysis임. 또한 공기극 물질의 이온 전도도가 높아야 전체적인 성능이 높다는 것이 알려져 있기 때문에 반응 과정에서 산소 이온과 수소 이온의 형성이 진행될 것으로 예상할 수 있음. 따라서 이를 설명하는 새로운 메커니즘이 필요함.
- 새로운 메커니즘에서 비교를 위해 먼저 기존의 OER 메커니즘과 유사하지만 수소가 수용액으로 용해되지 않고, 표면에 흡착하는 반응을 생각해볼 수 있음 (Non-filling). 다음으로 산소 이온 형성 같은 경우 PBSCFO 내부에 존재하는 OV를 표면에 흡착한 OH* (O-filling) 또는 O* (OH-filling)이 채우면서 발생하는 메커니즘을 구상하였음. 이 세가지 메커니즘끼리의 비교를 위해 에너지 다이어그램을 그려 살펴보면 아래 그림과 같음. 이 결과를 통해 표면 반응을 통한 산소 형성 보다 vacancy를 채우면서 산소 이온이 형성되는 두 메커니즘이 에너지적으로 유리하다는 것을 확인할 수 있음. 그 중에서도 OH*가 OV를 채우는 것이 유리함.
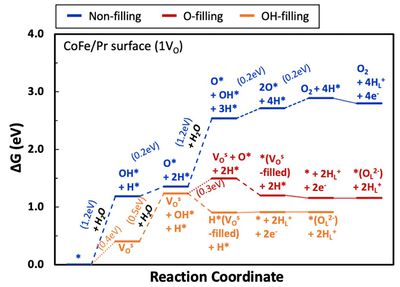
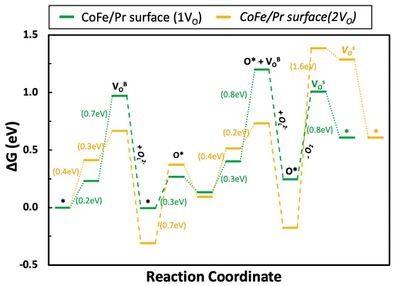
- OV가 두 개인 경우 역시 동일하게 OH*가 OV를 채우면서 진행되는 반응(OH- filling)이 에너지적으로 가장 유리했음. OV의 농도 영향을 확인해보기 위해 OV가 1개인 경우와 2개인 경우를 비교해 봐야함. 그 결과를 아래 그림에 나타내었음. 해당 결과를 통해 OV가 적은 경우(1VO)가 산소 이온 형성에 유리하다는 것을 확인할 수 있었음.
- 이런 메커니즘을 통해 형성된 산소 이온은 전도를 통해 물질 내부를 이동하다 결국 다른 표면으로 이동해 산소 기체를 형성할 것임. 따라서 다른 표면에서 형성된 산소 이온의 전도를 통한 OER 반응 메커니즘을 구성하여 비교해야함.
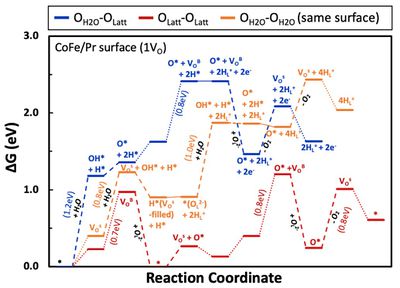
- 이를 위해 첫 번째로는 표면에서 물 분해가 이루어져 형성된 O*이 존재할 때 산소 이온의 전도가 이루어지고, 이후 격자 산소와 표면의 O*가 반응하여 나가는 반응을 구상하였음 (OH2O-OLatt). 다음으로는 표면에서 물 분해가 이뤄지지 않고, 산소 이온의 전도만으로 진행되는 반응을 구상하였음 (OLatt-OLatt). 마지막으로 산소 이온이 형성되고 다른 표면으로 전도되는 것이 아니라, 산소 이온이 형성된 표면에서 다시 해당 산소 이온이 물 분해를 통해 형성된 O*와 반응하여 산소 기체를 형성하는 메커니즘을 구상하였음 (OH2O-OH2O). 이 세가지 메커니즘의 에너지 다이어그램을 아래 그림에 나타내었음. 해당 결과를 통해 산소 이온의 전도만을 통해 산소 기체를 형성하는 빨간색 메커니즘이 에너지적으로 가장 유리하다는 것을 확인할 수 있었음. 이러한 경향성은 표면에서의 물 분해 반응이 다른 반응에 비해 많은 에너지를 요구하는 (~1.2eV) 반응이기 때문인 것으로 판단됨.
- 이를 토대로 산소 기체 형성 반응 역시 1OV 상태와 2OV 상태일 때 산소 이온의 전도만을 통한 산소 기체 형성 반응의 비교를 통해 OV의 영향을 살펴볼 수 있음. 해당 결과를 아래 그림에 나타내었음. 해당 결과를 통해 산소 기체가 탈착하는 반응이 OV가 적은 경우(1VO)에서 에너지적으로 유리한 것으로 파악되었음.
- 결론적으로 PBSCFO에서의 OER 메커니즘을 다양한 방면에서 살펴보았으며 표면에서 물 분해를 통해 산소 이온과 수소 이온이 형성되는 것이 에너지적으로 유리하는 것을 확인했음. 이러한 메커니즘을 통해 형성된 산소 이온은 내부를 전도하여 이동해 다른 표면으로 도달해 결국 산소 기체를 형성함. 이 때 산소 기체를 형성하는 것은 다양한 메커니즘 중 산소 이온의 전도만을 통한 메커니즘이 에너지적으로 가장 유리하다는 것을 확인함. 또한 산소 이온의 형성과 산소 기체 발생 반응 모두 OV가 적을 때(1VO) 에너지적으로 유리하다는 것을 확인함.
결과 및 평가
완료 작품의 소개
포스터
완료작품의 평가
- DFT 계산을 통해 PBSCFO 내부에 oxygen vacancy가 자연적으로 발생하는 것을 확인함.
- PBSCFO 내부의 oxygen vacancy 농도가 이온 전도도에 미치는 영향을 확인함. oxygen vacancy가 많을수록 프로톤 전도도는 저해, 산소 이온 전도도는 향상.
- 표면 메커니즘 분석을 통해 표면 반응 메커니즘을 규명함. 물 분해를 통해 물질 내부에 산소 이온이 형성됨.
- 산소 기체 발생 메커니즘 역시 규명함. 산소 이온의 전도가 반응에 참여하며, 결과적으로 발생한 산소 기체는 PBSCFO의 격자 산소로 구성되어있음.
향후계획
- Nudged elastic band (NEB) 계산을 통해 에너지 배리어 결과를 얻어 더욱 자세한 결과 분석이 가능함.
- 실험적으로 isotope H2O를 이용하여 발생한 산소가 실제로 PBSCFO의 격자 산소로 구성되어있는지 확인해야함.