바늘이
프로젝트 개요
기술개발 과제
국문 : 마이크로 니들 제작과 탐구
영문 : Microneedle Production and Exploration
과제 팀명
바늘이
지도교수
이종범 교수님
개발기간
2023년 9월 ~ 2023년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학부·과 2017340004 김규근(팀장)
서울시립대학교 화학공학부·과 2017340019 설용훈
서울시립대학교 화학공학부·과 2019340019 문채린
서울시립대학교 생명공학부·과 2018560025 이희섭
서울시립대학교 환경공학부·과 2019890041 이서준
서론
개발 과제의 개요
개발 과제 요약
1. PDMS를 이용한 Microneedle mold 제작
2. PVA microneedle 제작
3. 전자현미경을 통한 PVA microneedle 제작
4. Microneedle의 성능 개선 방안 논의
개발 과제의 배경
Microneedle (MN)은 수십 개에서 수백 개의 마이크로미터 크기의 바늘을 사용하여 높은 피부 투과성을 가지고 고통없는 경피 투과를 가능하게 한다.
MN 패치 제조 방법은 크게 mold-free 방법과 micro-molding 방법으로 나뉜다. MN의 종류에는 solid microneedles, hollow microneedles, coated microneedles, swellable microneedles, and dissolving microneedles이 있다. 이 보고서에서 우리는 micro-molding 방법을 사용하여 Polyvinyl alcohol (PVA) based hydrogel을 사용하여 dissolving microneedle을 제작했다.
PVA는 FDA에서 GRAS(Generally Recognized As Safe)로 분류되며 높은 생체 적합성, 생분해성 및 약물 적재 능력을 가지고 있다. 고분자 PVA를 물에 녹여 사용하였으며, PVA 비율은 높을수록 그 물리적 특성이 강해지나 PVA 비율이 과도하게 높으면 PVA MN에서 기포가 잘 빠져나가지 않게 되어 기포를 제거하는데 과도한 시간이 필요해지거나 불량품이 만들어지게 될 수 있다. 20% 미만에서는 그 물성이 너무 약하고 그보다 위에서는 기포를 제거하기 힘들어 대개 20~25vol% 정도의 PVA 수용액이 사용되며 이번 실험에서는 20vol%의 PVA 수용액을 사용했다.
Polydimethylsiloxane (PDMS)은 저렴하고 광투과성이 뛰어나며 쉽게 제조할 수 있는 실리콘 기반의 고분자이다. Microneedle mold 제작을 위한 PDMS 혼합 비율을 결정하기 위해, 우리는 10:1, 10:2 및 10:3 (w/w, Sylgard A : Sylgard B, base : cross linker) 비율에 대한 tensile test 및 hardness test를 수행한 논문들을 조사했다.
논문 조사 결과, cross linker (경화제) 비율을 높이면 tensile strength가 감소하는 경향을 보였다. 또한, Young’s modulus 값은 10:1 및 10:2 혼합 비율에 대해 각각 E=1.527MPa 및 E=1.334MPa였다. 이러한 경향들은 Kim et. al. (2015) 연구와 관련이 있으며, 이 연구에 따르면 과도하게 cross linker를 혼합할 경우, PDMS가 덜 유연해진다고 말하며, 일반적으로 PDMS 합성에 사용되는 비율은 10:1 (w/w, base : cross linker)이라고 말한다.
또한, 10:1 비율의 PDMS에 대한 hardness average는 41.7±0.95 Shore A로 얻어졌으며, 10:2 비율의 PDMS의 hardness average는 43.2±1.03 Shore A로 얻어졌다. 이는 제조업체인 Dow Chemical Company에서 2017년 공표한 값인 44 Shore A와 근접한 값이다.
위와 같은 조사 내용을 바탕으로, 이번 프로젝트에서는 10:1 (w/w, base : cross linker) 비율의 PDMS를 사용했다.
개발 과제의 목표 및 내용
1. PDMS microneedle mold를 이용하여 PVA microneedle을 제작하고 전자현미경을 통해 그 형태를 관찰한다.
2. PVA microneedle에 Alexa 488 (염색약)을 포함한 DNA molecule을 주입하여 DNA molecule을 포함한 microneedle을 제작한다.
3. 형광현미경을 통해 주입한 DNA molecule이 PVA microneedle의 tip 부위에 주입되었는지 관찰한다.
4. Image J 프로그램을 이용하여 형광현미경으로 관찰한 사진을 합성한 후, Polymer base와 DNA molecule의 비율을 측정한다.
관련 기술의 현황
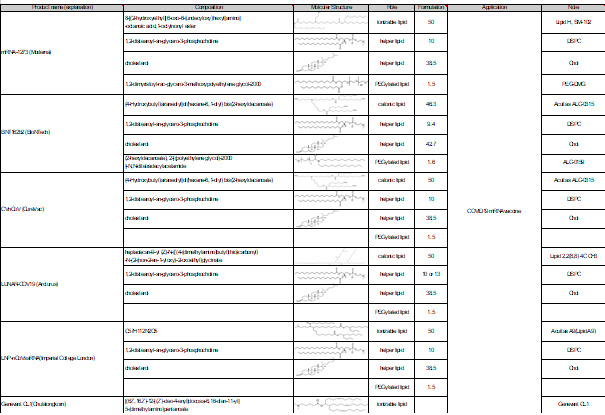
질병의 치료를 위한 Lipid nano particle의 활용 사례
개발과제의 기대효과
기술적 기대효과
1. 센서를 통한 건강 모니터링 : 약물뿐만 아니라 센서를 MN을 통해 전달하므로써 병의 치료뿐만 아니라 병의 예방과 관리 및 추적까지 가능하게 한다.
2. Iot 기술과의 결합 : MN에 의한 체내 센서는 다양한 장치들과 연결되어 손쉽게 데이터를 교환하는, 새로운 방식의 일상생활을 가능하게 한다.
3. 후행 기술로의 영향 : 기술의 보편적 특성상 공통된 분야의 기술 간의 유기적 관계를 가지므로 약물전달로서의 MN은 차후 발전된 기술의 개발에 영향을 줄 것이다.
경제적, 사회적 기대 및 파급효과
1. 의료비용 절감 : MN을 통해 효과적으로 약물을 전달하게 된다면 병을 치료하기 위한 시간이 단축될 것이고, 의료비용 절감의 효과를 기대할 수 있다.
2. 의료의 접근성 향상 : 병원에 방문하기 힘든 지역에 사는 이들에게도 병의 치료가 가능해진다.
3. 생산의 활성화 : 새로운 기술의 활성화는 새로운 제조, 유통 산업의 활성화를 뜻하기도 하며 새로운 일자리를 창출하여 경제가 활성화될 것이다.