암쏘쿨조
프로젝트 개요
기술개발 과제
국문 : 효과적인 암치료를 위한 생체세포막 코팅 핵산 입자
영문 : Cell membrane coated nucleic acid particles for effiecient cancer therapy
과제 팀명
암쏘쿨
지도교수
이종범 교수님
개발기간
2019년 9월 ~ 2019년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20143400** 문*현(팀장)
서울시립대학교 화학공학과 20143400** 김*우
서울시립대학교 화학공학과 20143400** 고*인
서울시립대학교 화학공학과 20143400** 양*현
서론
개발 과제의 개요
개발 과제 요약
약물 전달을 통한 효과적인 암치료를 위해서는 약물을 전달하는 약물 전달체 시스템의 적절한 디자인을 통해 우리 몸 내의 청소 작용을 피하여 안정적으로 암세포까지 전달되는 것이 필수적이다. 최근 이러한 약물 전달체로서 세포막을 이용하는 것이 주목받고 있다. 인체 내에서 유래한 세포막은 생체적합성, 세포 간 상호작용 역할, 인체 내 순환 시간 향상 등 다양한 특성을 부여할 수 있다. 그중에서도 특히 우리 몸을 돌아다니며 청소 작용을 하는 면역세포에서 유래한 세포막을 약물 전달체로 사용하게 되면 인체의 면역반응을 피해 혈액 내를 안정적으로 순환하다가 암세포가 보이면 근처로 몰려들어 효과적으로 약물을 전달하는 시스템으로서 사용할 수 있다는 것이 가장 큰 장점이다. 이번 프로젝트에서는 기존 RNA interference 현상을 이용한 암세포 증식 억제 및 제거 역할을 하는 RNAi microsponge를 면역세포막으로 감싸 혈액 내에서 안정적으로 순환하며, 암세포를 표적화하여 RNAi microsponge를 효과적으로 전달하는 시스템을 개발하는 것이 목표이다.
개발 과제의 배경
1. RNAi Microsponges
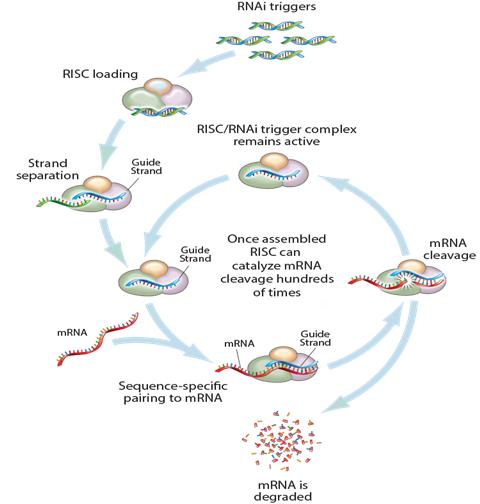
1-1. RNAi 현상이란? 세포핵은 DNA와 RNA로 이루어져 있다. 이중나선으로 이루어져있고 오직 두 개의 -OH기를 포함하고 있어 안정성과 정보기억력이 높은 DNA와 달리, 단일나선과 세 개의 -OH기를 가지고 있는 RNA는 안정성과 정보기억력이 현저히 떨어진다. 안정성과 정보기억력이 떨어지는 RNA를 치료제로 쓰는 주된 이유는 RNA의 한 종류인 siRNA를 통한 단백질 생산 억제 능력이다. 세포가 생장을 하기 위해서는 DNA와 RNA가 상보적으로 결합하여 mRNA를 통해 정보를 전달하고, 그 정보를 바탕으로 단백질을 분비하는 과정이 필요하다. 그러나 siRNA가 세포핵 속으로 들어가면 mRNA와 결합하면 mRNA를 분해하는 RISC가 siRNA/mRNA에 결합하여 siRNA/mRNA/RISC complex를 형성하고, 효소 작용을 통해 mRNA를 분해한다. 이런 현상을 RNAi 현상이라하며 이를 통해 세포의 단백질 생산을 저해시킬 수 있다.
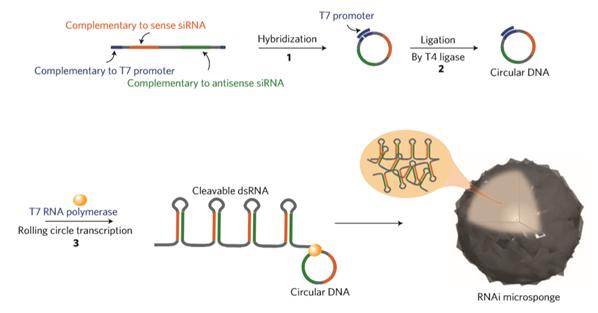
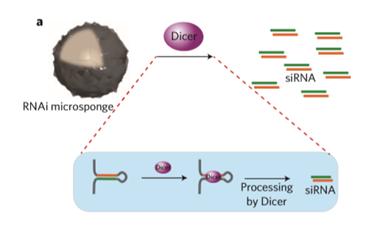
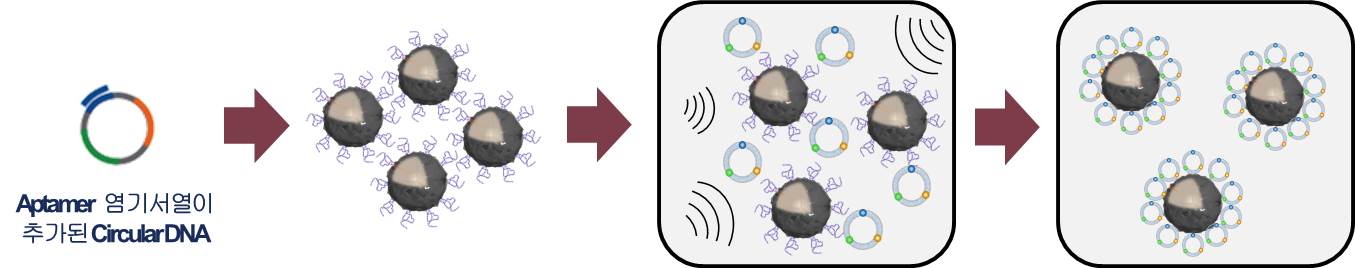
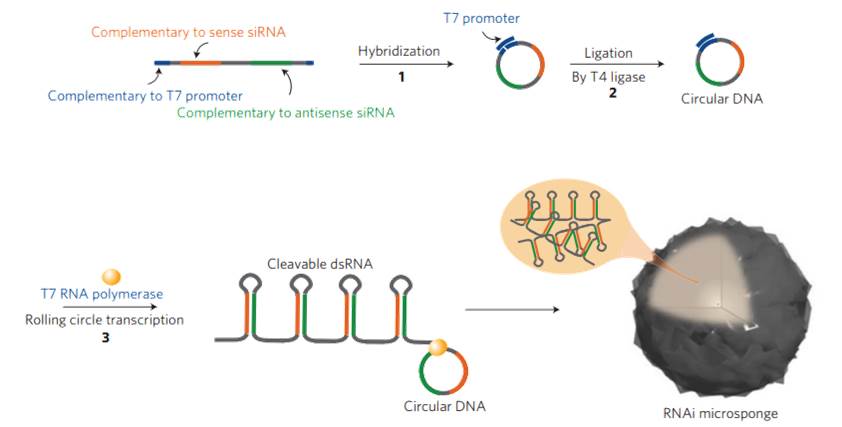
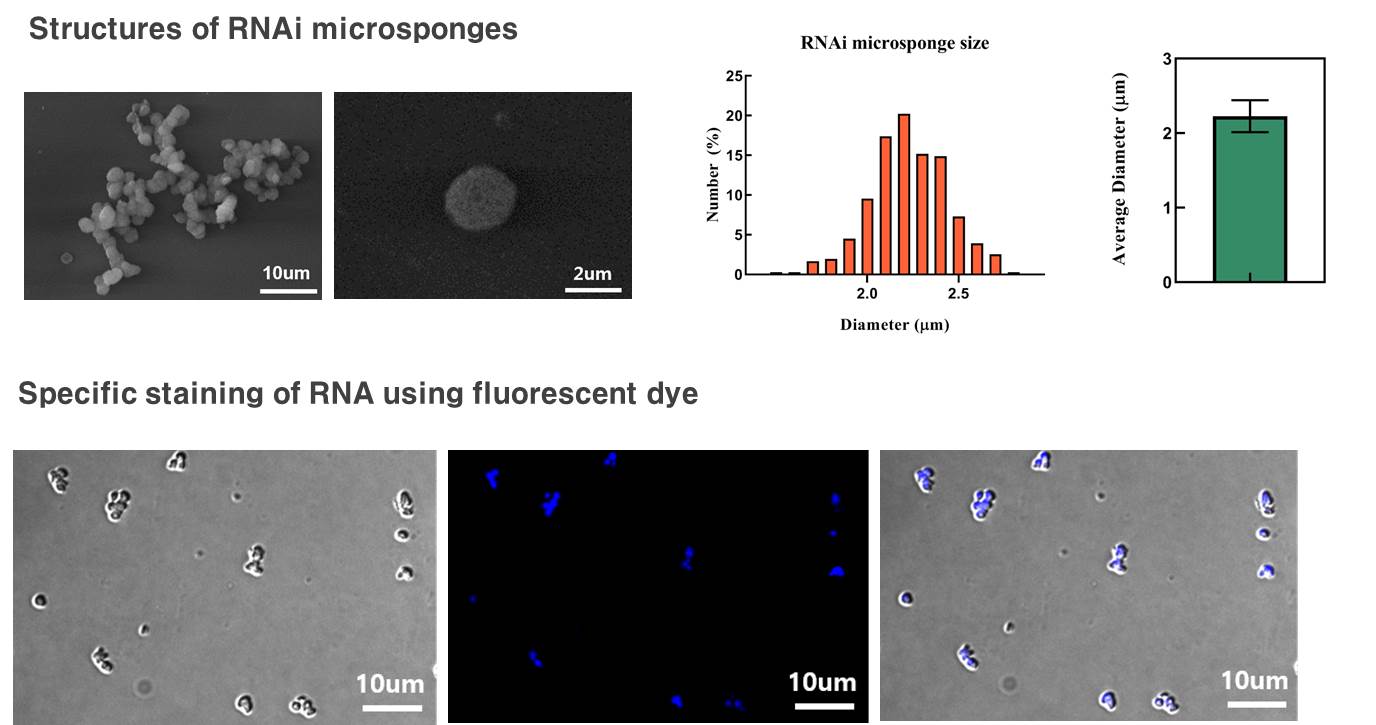
1-2. RCT(Rolling circle transcription : 회전 증폭 전사) 기술을 통한 RNAi microsponge 합성 RNAi microsponge는 RCT 기술을 통한 RNA 복제에 의해 합성할 수 있다. RCT를 이용한 RNAi microsponge의 합성은 다음과 같다(그림 1). siRNA가 Hairpin 구조를 이루어 dsRNA가 되도록 하고 양 끝에 T7 promoter sequence가 존재하도록 Template DNA sequecne를 짠 뒤에 T7 promoter와 상보적인 가닥을 넣어주면 원형으로 감긴다. 그 후에 T4 ligase를 이용하여 틈을 메꿔주면 circular DNA를 합성할 수 있다. 그 뒤에 T7 RNA polymerase가 T7 promoter를 인식하여 RNA를 증폭시키기 시작하면 아래 그림과 같이 Hairpin 구조가 매우 많이 증폭되어 입자와 같은 형태를 이루게 된다. RCT를 통해 합성된 RNAi microsponge는 세포 내의 Dicer라는 분해효소에 의해 siRNA 가닥으로 분해된다. Dicer는 세포질 내에 주로 존재하는 분해효소로서, RNAi microsponge가 세포질 내로 전달되었을 때 siRNA로 분해되어 RNAi 효과를 나타내게 된다.
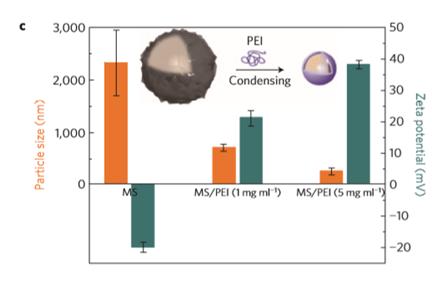
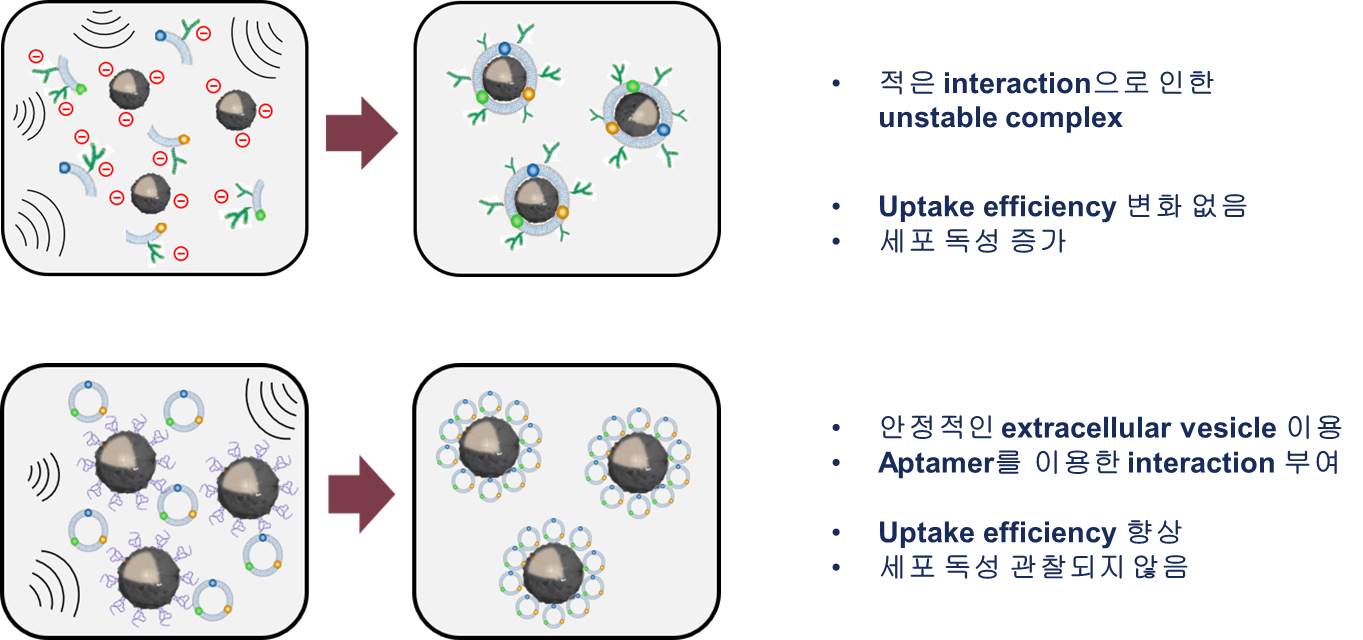
1-3. RNAi microsponge의 한계 RNAi microsponge는 위의 그림과 같이 음전하를 띈다. 일반적으로 세포막은 음전하를 띄는 것으로 알려져 있다. 따라서 RNAi microsponge는 전기적 반발력으로 인해 세포 내로 Uptake되는 효율이 매우 낮다. 선행 연구에서는 이러한 문제를 해결하기 위해 양전하를 갖는 Polyethlyenimine(PEI)로 코팅하여 압축시켰다. 하지만 이 방법의 문제점은 양전하를 띄는 입자가 갖는 공통적인 특성인 세포 독성을 띈다는 점이다. 즉, 표적이 되는 암세포가 아닌 다른 정상세포로도 전기적 인력으로 인해 쉽게 Uptake되어 영향을 끼칠 수 있는 가능성이 커진다. 또한 RNAi microsponge 형태는 RNA의 안정성을 어느정도 늘렸지만 실제로 혈액 내에 주사하였을 때 30분 이내로 분해된다. 이는 인체 내에서 순환하며 암세포를 찾아가기에는 매우 짧은 시간이라고 할 수 있다. 이러한 이유로 인해 PEI 코팅을 해준 후에도 Liposome 기반의 약물전달체를 이용해 안정성 및 Uptake 효율을 늘려주었다. RNAi microsponge가 가지고 있는 한계를 극복하기 위해서는 혈액 내에서 안정적으로 순환할 수 있도록 안정성을 더욱 높여야 하며, RNA의 음전하로 인한 Uptake 효율 저하 문제를 해결하여야 한다.
2. 면역세포막
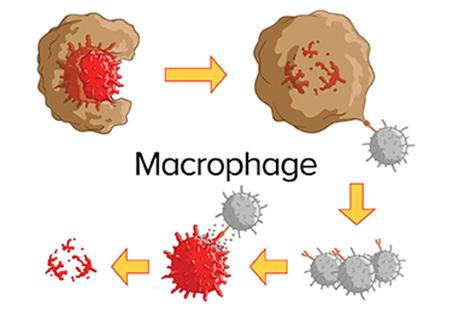
2-1. 세포막에 대한 일반론 세포는 오랜 시간을 거듭하면서 다양한 기능을 발전시켜왔으며 주변 환경과의 상호작용을 통해 여러 대사활동 및 기능을 유지한다. 이를 가능하게 하는 세포의 고유한 특성 중 하나는 세포막에 존재하는 다양하고 복잡한 항원 및 단백질 분포이다. 세포막에 존재하는 항원과 단백질은 세포가 인체 내에서 서로를 인식하거나 다양한 역할을 수행하고 의사소통 할 수 있도록 도와준다. 세포가 외부물질을 흡수하기 위해서는 먼저 해당 물질을 세포막으로 감싼 후 Endosome을 형성시켜 입자와 세포막 간의 상호작용을 통해 분해시키고, 세포질 내로 분해 작용의 결과물을 분비한다.
2-2. 대식세포의 역할 및 대식세포막의 장점 대식세포는 인체의 선천 면역을 담당하는 백혈구이다. 인체 내에 병원균이 침입하면 그 주위로 대식세포가 몰려들기 시작한다. 이들은 병원균을 잡아먹거나 독소를 분비하여 죽이고 소화시키는 역할을 하며, 수지상세포가 하는 일을 수행하기도 한다. 대식세포가 다른 면역세포인 수지상세포나 T세포 및 NK세포와 다른 점은 항원제시를 받지 않아도 외부에서 들어온 세포를 인식하고 제거한다는 점이다. 또한 대식세포는 암조직 주위로 몰려드는 특성을 가지고 있는 것으로 알려져 있다. 세 개의 -OH기로 인해 불안정한 RNA는 체내에서 매우 빠르게 분해되는데, RNA를 입자화하여 대식세포막 내에 담체하여 체내 체류시간을 높이고 비정상세포 표적화 및 면역회피와 같은 특성을 이용하여 암세포의 생장을 막는 역할을 한다. 또한 대식세포는 세포독성물질인 사이토카인을 인식하고 증가를 억제하는 역할을 하는데, 염증성 사이토카인과 독성 LPS를 흡수하는 대식세포막을 코팅함으로써 해독작용 개선의 효과를 기대 할 수 있다.
3. Sonication을 이용한 세포막 코팅 기술
Sonication을 통한 코팅은 코팅하고자 하는 입자와 면역세포막을 함께 넣고 강력한 초음파에너지를 가하여 주는 방법이다. 초음파 에너지를 받은 두 성분은 진동하게 되고 안정적인 형태로써 성질을 보존하기 위해 Core-shell 모양으로 형성 된다. Sonication 방법은 물리적 압출을 통한 코팅보다 재료의 손상이 적다는 이점이 있다.
개발 과제의 목표 및 내용
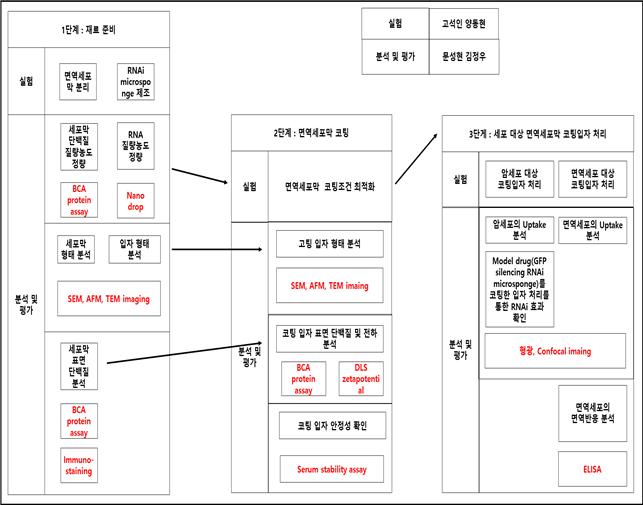
1. 면역세포막 분리
1-1. 면역세포막을 분리하는 프로토콜 확립 세포는 세포막뿐만 아니라 세포핵, 미토콘드리아, 세포질 등 다양한 세포 내 소기관을 가지고 있다. 면역세포로부터 세포막을 얻어내기 위해서는 다양한 세포 기관들의 질량 및 밀도 차이를 이용한 분리가 필요하다. 또한 세포막 표면의 다양한 표면 단백질들이 고유한 특성을 부여해주므로 이들을 파괴시키지 않는 온건한 방법을 통해 세포를 분쇄하고 분리해내는 프로토콜을 확립해야한다.
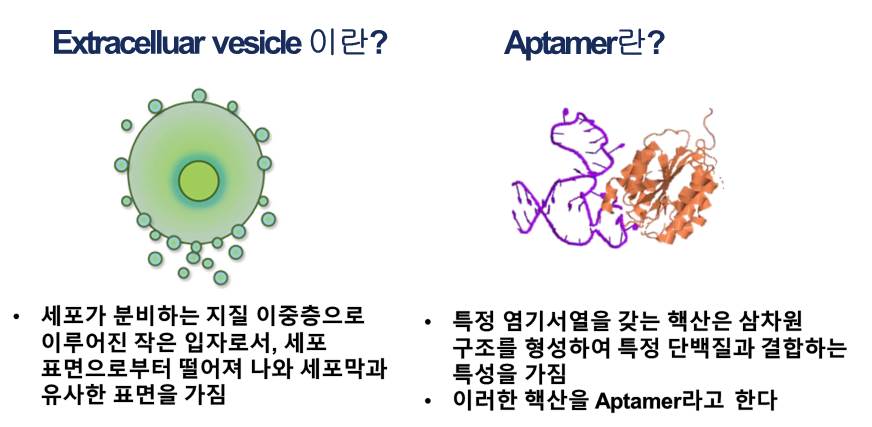
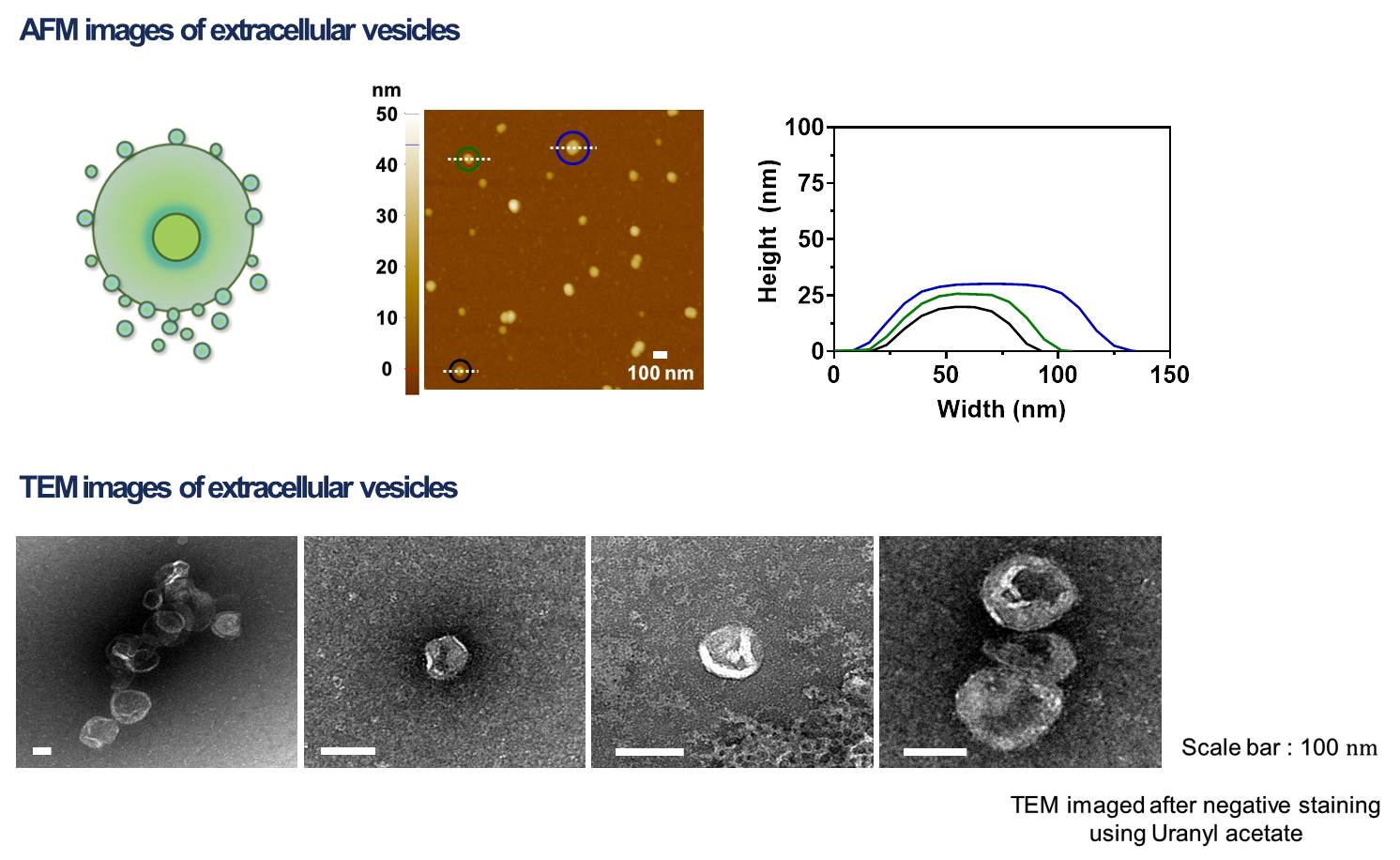
1-2. 면역세포막 분리 확인 프로토콜을 확립한 후에 세포막이 성공적으로 분리되었는지 확인하는 과정이 필요하다. 우선적으로 SEM 및 TEM 이미지를 통해 세포막의 가장 큰 특징인 지질 이중층을 가지고 있는지 확인한다. 다음으로는 분리한 세포막과 분리 전 세포의 표면단백질을 비교분석하여 분리 후에도 세포막 표면단백질을 여전히 가지고 있는지 파악한다.
2. 면역세포막 코팅
2-1. 면역세포막을 이용한 RNAi microsponge 코팅조건 최적화 Sonicaion을 통해 세포막을 RNAi mcirosponge에 코팅하는 코팅조건을 최적화하는 작업을 진행한다. 최적화할 조건에는 RNA와 세포막의 코팅 비율, Sonication 시간이 있다. 이 조건들을 바꾸면서 가장 효율적으로 코팅되는 조건을 찾아낸다.
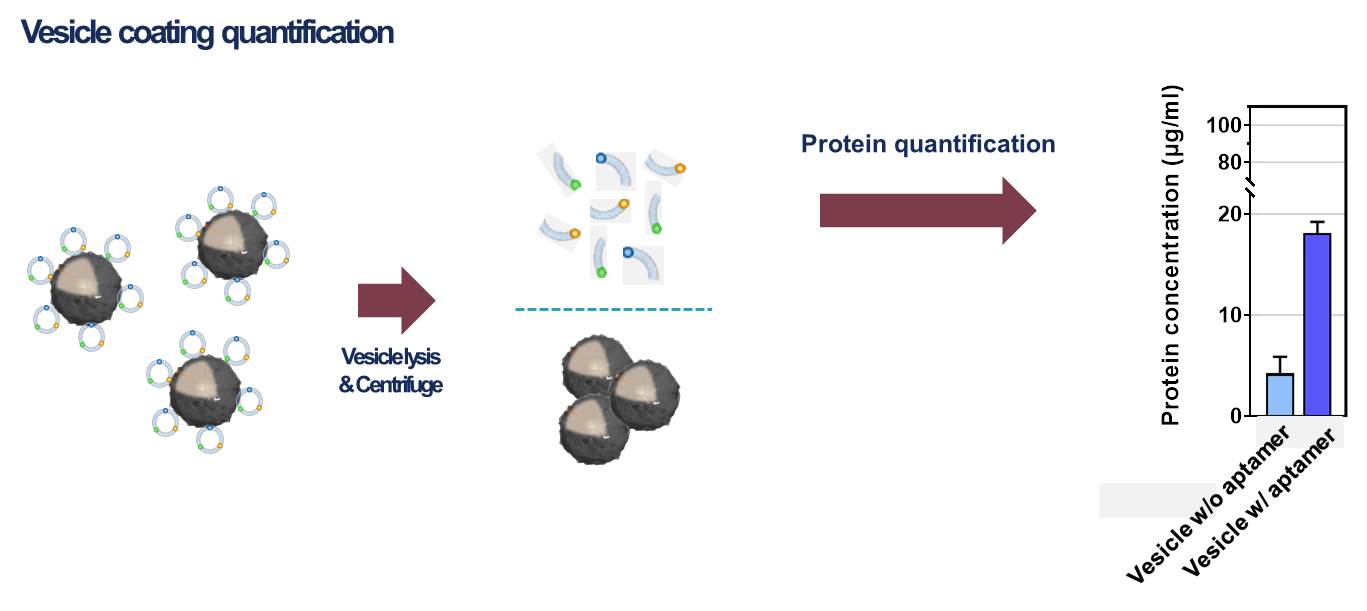
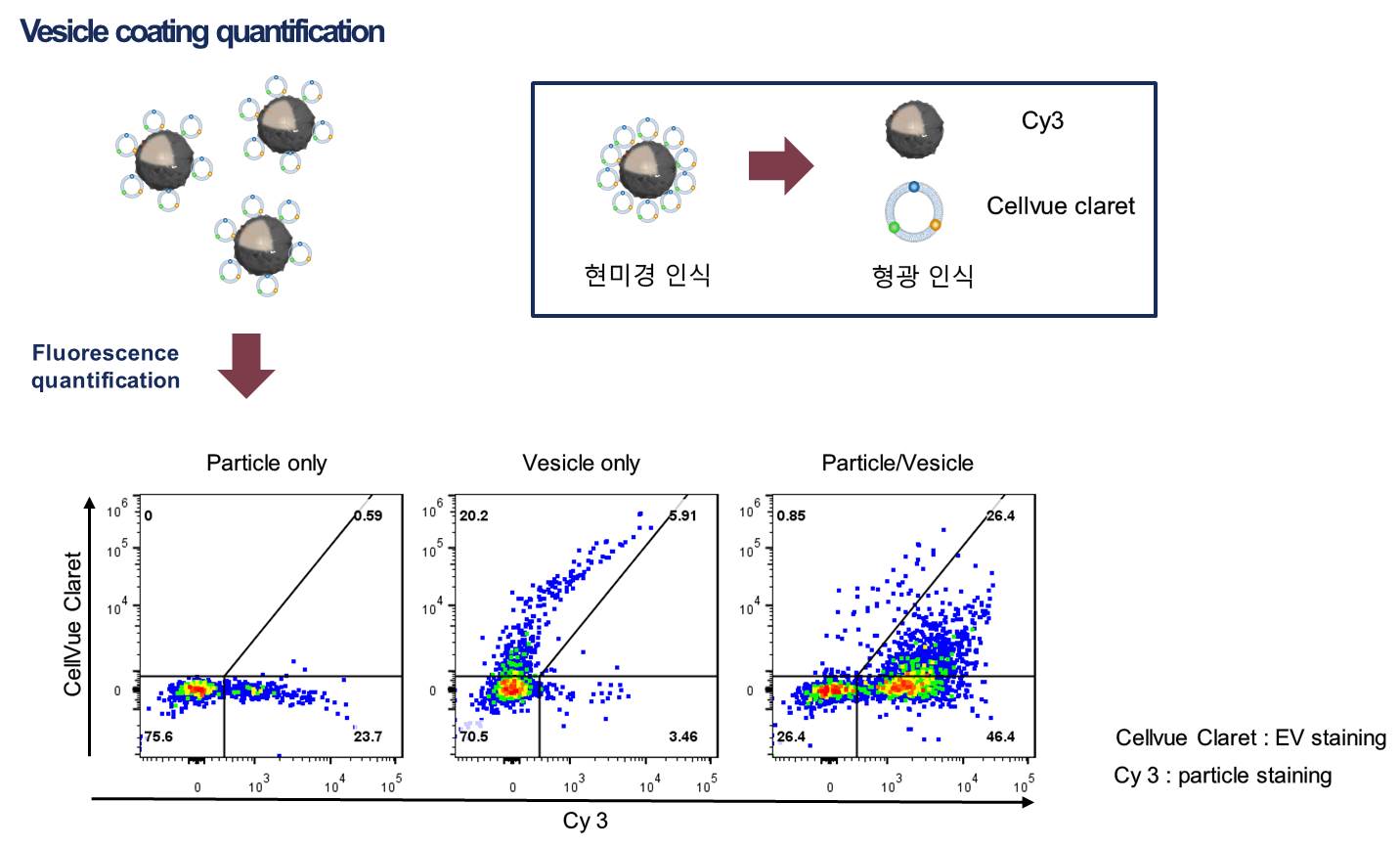
2-2. 세포막 코팅된 입자 characterization 코팅 조건을 최적화한 뒤에 코팅된 입자의 characterization을 진행한다. 코팅된 입자의 크기 분포, 표면 전하 변화, 전자 현미경 imaging, 표면 단백질 분석을 통해 코팅 전 RNAi microsponge와 비교하여 코팅 후에 입자가 갖는 성질을 파악한다.
2-3. 세포막 코팅으로 인한 면역반응 감소 및 체내 안정성 증가 확인 면역세포막으로 코팅한 입자의 장점 중 하나는 면역세포에 의해 외부 물질로 인식되지 않는다는 점이다. 이 점을 확인하기 위해 코팅된 입자를 면역세포에 처리하여 면역세포에 인식되는지 확인한다. 또한 RNAi microsponge의 단점으로 지적되었던 낮은 blood circulation time이 증가되었는지 확인하기 위해 사람의 혈액과 비슷한 조성을 갖는 serum에서 코팅된 입자가 얼마나 오래 견디는지 비교분석을 진행한다.
3. 암세포 제거 효과 확인
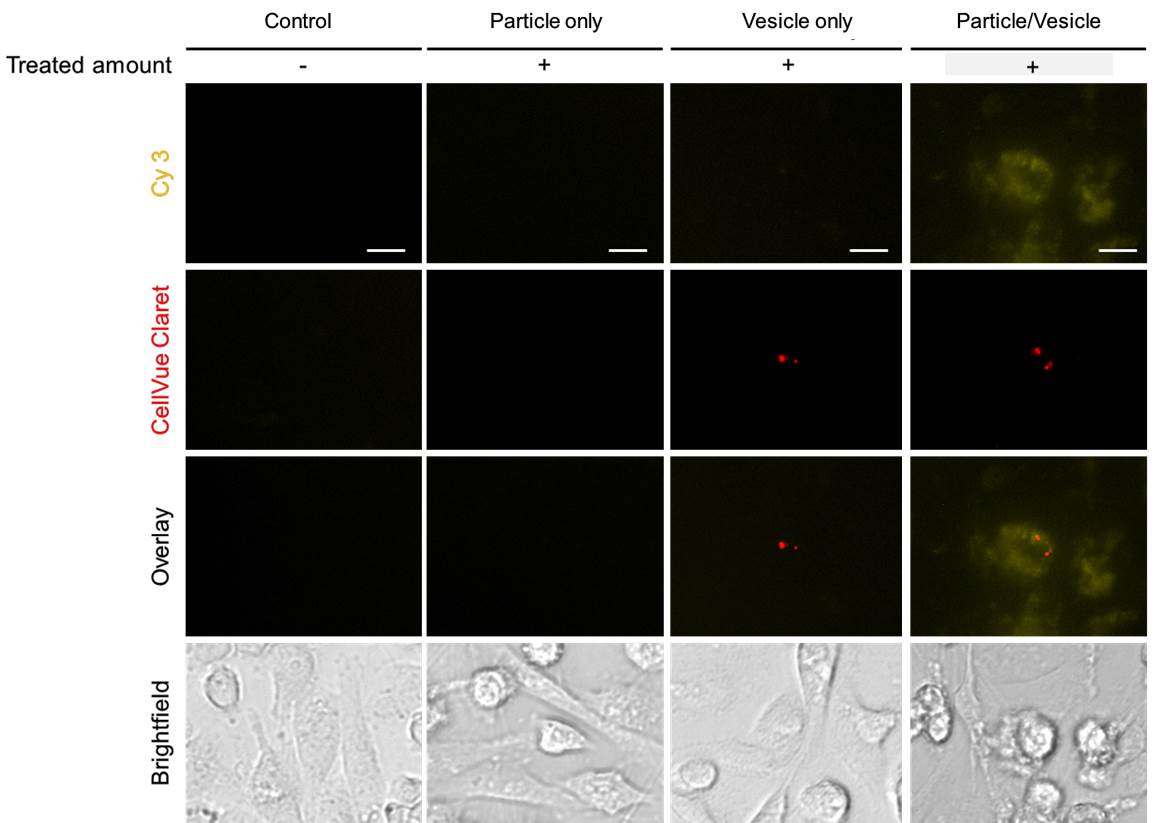
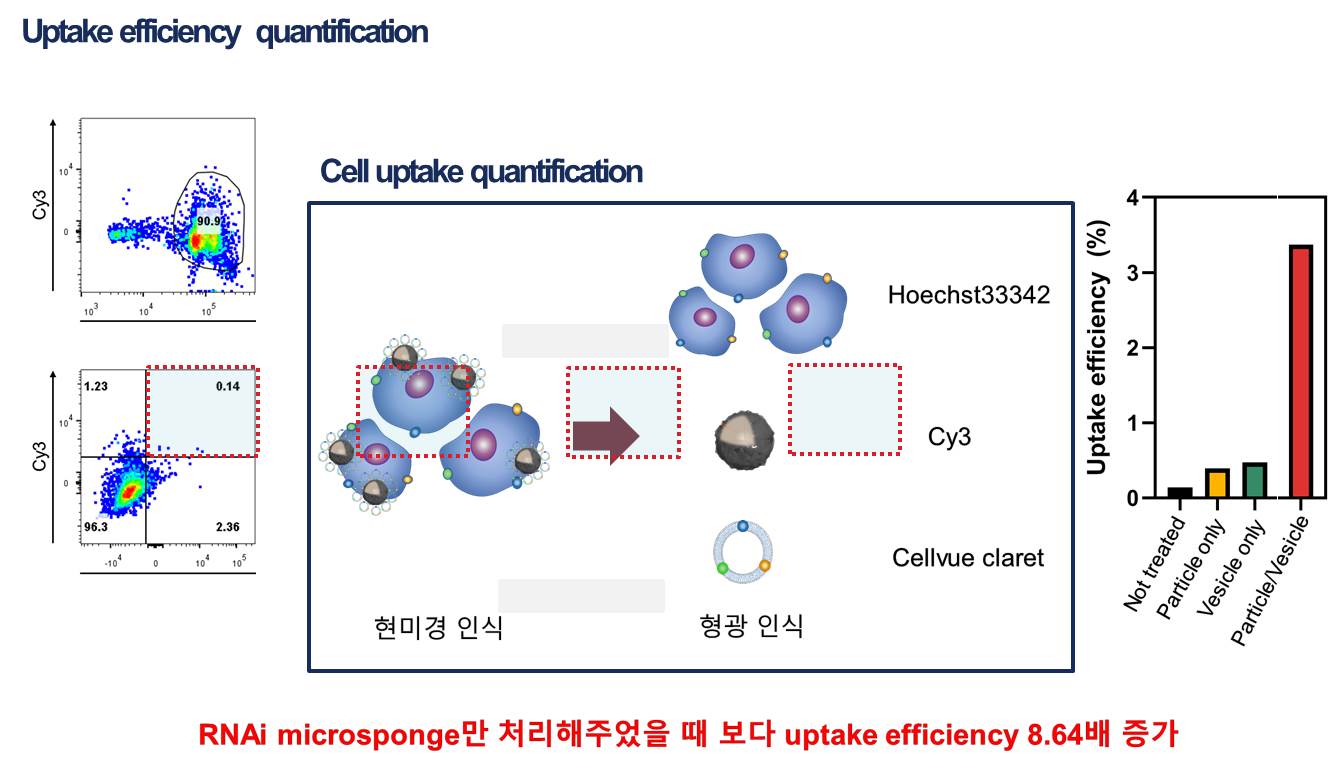
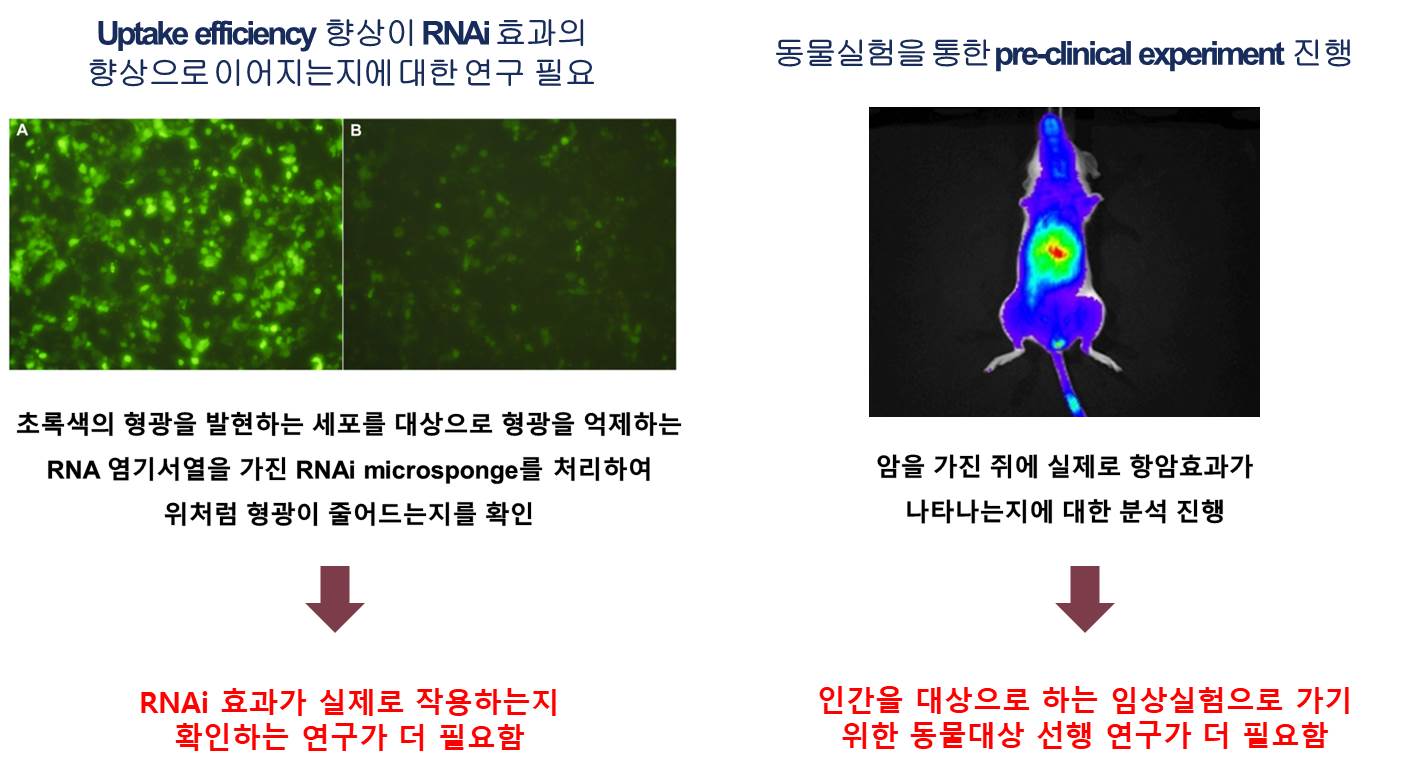
3-1. GFP targeting sequence RNA를 이용해 Uptake 및 RNAi 효과 확인 암세포 제거 효과를 확인하기 전, 면역세포막으로 코팅된 입자가 암세포에 효과적으로 전달되는지 먼저 확인하는 작업이 필요하다. 그러기위해 GFP 형광이 나도록 유전적으로 변형된 암세포에 GFP targeting sequence를 갖는 RNAi microsponge를 코팅한 입자를 처리하여 Uptake 효율이 증가하는지, RNAi 효과를 나타내는지 확인한다.
3-2. 암세포 생장을 억제하는 sequence를 가진 RNA를 이용해 암세포 제거 효과 확인 위의 실험을 통해 암세포의 Uptake 효율이 증가하고, RNAi 효과가 있다는 점이 입증되면 RNA sequence를 실제 암세포의 생장에 관여하는 mRNA와 상보적으로 결합하도록 바꿔 암세포 제거 효과를 확인한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
- 전 세계적인 기술현황
가. State of the art 1. 약물전달체 시스템으로서 대식세포막을 이용하기까지
1-1. PEGylation 나노 및 마이크로 입자 기반 약물전달에서 가장 큰 한계는 인체 내 순환시간이다. 이런 측면에서 지금까지 체내 순환시간을 늘리는 황금률은 나노입자의 표면에 합성 폴리머인 Poly(ethylene glycol) (PEG)를 코팅하는 것이었다. 이러한 방법은 입자 표면에 수화막을 형성하여 입자가 인체 내 환경 내에서 반응하지 않도록 도와주어 구조적 안정성을 높여주었다. 나아가 특정세포에 대한 표적화 능력을 부여하기 위해 다양한 종류의 Ligand들, 예를 들어 항체, aptamer, 펩타이드 등이 PEG에 Conjugation 되었다. 하지만 다양한 연구들에서 PEG 기반의 나노입자 전달에 의한 면역반응 증가, PEG와 결합하는 항체 생성으로 인한 PEGylated 나노입자의 성능 저하 등이 보고되고 있어 그 한계가 뚜렷하다고 할 수 있다. 더불어 표적화 능력 부여를 위한 bottom-up conjugation 전략은 대량생산에 부적합하며, Heterogeneous한 암세포의 특성을 고려할 때 나노 입자의 표면 개질을 하는 측면에서 시간과 노동력, 자원 등이 상당히 소요된다.
1-2. 적혈구 기반 세포막의 활용 2011년 세포막 코팅 기술을 이용한 연구가 최초로 보고되었다. 해당 연구에서는 혈액 내의 적혈구로부터 세포막을 얻어 나노 입자를 코팅하였다. 나노 입자 표면에 세포막을 직접적으로 코팅하여 세포막 표면의 다양한 항원, 단백질 등을 그대로 보존하였으며, 유래 세포의 특징을 나노 입자에 부여하였다. 적혈구는 인체 내를 순환하면서 산소를 전달하는 역할을 담당하며, 인체 내에서의 수명이 4개월인 것으로 알려져 있다. 적혈구의 세포막으로 코팅된 나노 입자는 기존 PEG 기반 나노 입자 전달에 비해 인체 내 순환시간이 증가하였으며, 면역반응이 감소하였다. 또한 Top-down 전략으로서 다양한 표면 단백질을 이미 가지고 있는 세포막을 활용하는 것은 대량생산에 적합하며 표면 개질에 투입되는 자원을 효과적으로 줄일 수 있다는 장점을 가지고 있다. 이를 통해 PEG 기반 나노입자 전달이 가지고 있던 한계점을 보완하였다.
1-3. 면역세포막의 활용 가장 최근들어 면역세포로부터 세포막을 분리하여 암치료에 활용하는 연구가 이루어지고 있다. 세포핵과 세포소기관이 없는 적혈구와 달리 세포핵과 다양한 세포 소기관을 가지고 있는 면역세포의 경우 세포막을 분리하는 과정에서 좀 더 복잡한 분리과정이 필요하다. 하지만 면역세포는 염증 및 암세포 표적화 능력과 면역세포의 청소작용으로부터 자유로운 특성을 가지고 있어 암세포 약물전달체 재료로서 각광받고 있다. 최초로 면역세포를 활용한 연구는 대식세포의 세포막을 분리하여 항암제 화학약물이 포함된 나노 입자를 코팅하여 전달한 사례가 있다. 이를 통해 인체 내 청소작용으로부터 회피하여 암세포에 나노 입자가 축적되었으며 향상된 암치료 효과를 나타내었음을 보고하였다.
2. 세포막 코팅 기술의 현황
2-1. Co-extrusion 방법 Co-extrusion 방법은 400nm의 구멍에 세포막과 입자를 함께 통과시킴으로써 코팅하는 방법이다. 앞선 적혈구 세포막을 코팅한 연구사례에서 최초로 적용된 방법이다. 그러나 Co-extrusion 방법은 물리적 압출에 의한 세포막 손상의 우려가 크다. 또한, 400nm의 구멍크기는 코팅하고자 하는 입자의 크기를 제한시킴으로써 상황에 따른 유동적인 대처가 힘들다는 단점이 있다.
2-2. Electroporation 방법 Electroporation은 세포막에 전기적 충격을 가하여 세포막을 불안정하게 하고 일시적으로 구멍을 만든 후, 그 구멍을 통하여 코팅하는 방법이다. Electropolation 방법은 세포막에 가하는 전기적 충격의 강도를 조절함으로써, 코팅하고자 하는 입자의 크기를 상황에 맞게 유동적으로 적용 시킬 수 있다는 장점이 있다. 그러나 Scale-up에 한계가 있고, 그 효율이 낮다는 점이 단점으로 지적되고 있다.
2-3. Sonication 방법 Sonication은 코팅하고자 하는 입자와 면역세포막을 함께 넣고 강력한 초음파 에너지를 가해주어 코팅하는 방법으로 가장 최근 각광받는 코팅 방법이다. 이 방법은 암세포막을 이용한 면역보조제 코팅 연구에서 사용되었다. 초음파 에너지를 받은 두 성분은 진동하게 되고 안정적인 형태로써 성질을 보존하기 위해 Core-shell 모양으로 형성 된다. Sonication 방법은 물리적 압출을 통한 코팅보다 재료의 손상이 적다는 이점이 있으며, 세포막과 나노입자를 섞어주고 Sonicator에서 적은 시간동안 처리해주기 때문에 편리하며, Scale-up이 용이하다는 장점이 있다.
- 특허조사 및 특허 전략 분석
나. 특허조사
1. 약물 운반체 시스템을 통한 약물의 안정성 증대 및 암세포 표적화
1-1. 세포 표적화 및 약물 방출 기능이 있는 약물운반체
● 요약 – 특정 세포 표면에 결합하는 물질과 엔도좀 구조 변화를 유도하는 물질을 사용하여 약물 방출을 증가시킨다. 특정 세포를 표적하는 동시에 엔도좀에서 약물의 방출을 증가시킴으로써, 특정 세포를 특이적으로 사멸시키는 약물운반체를 제조한다. ● 유사점 – 세포 표적화 기능을 가진 부분을 약물 전달체에 Conjugation하여 siRNA의 암세포 표적기능을 탑재시킨다. ● 차이점 – 약물전달체로서 세포 표적화 물질이 부착된 고분자 물질을 이용하였다. 이러한 형태는 인체 내에서 부작용의 가능성이 매우 크고, siRNA가 돌출되어 있어 보호를 크게 받지 못해 금방 분해되어버릴 가능성이 크다는 점이 차이점이다.
1-2. 이중 항암제를 봉합한 리포좀
● 요약 – 세포의 생장을 막는 EGFR 경로 억제제와 세포 구조를 파괴하는 DNA 손상 화학요법제를 리포솜에 봉입하여, 두 가지 항암제를 병용 처리함으로써 치료 효율을 개선하였다. ● 유사점 – 리포솜은 인지질 이중층으로 이루어진 구형의 막으로, 약물을 담체한 형태가 생체세포막을 코팅한 모습과 매우 유사하다. 인체 내 세포막을 잘 통과하며 신체 내 대사 작용에 의한 분해의 우려가 적다. 세포막을 이용한 코팅의 prototype 형태로 생각해 볼 수 있다. ● 차이점 – 세포의 보호를 목적으로 하는 세포막과 달리 외부물질을 신체 내로 전달하기 위한 목적인 리포솜은 표면에 표적화 및 안정적인 생체 내 순환을 위한 표면 단백질 등이 결여되어 있다. 따라서 표적화를 위한 표적화 물질 첨가 과정이 추가적으로 필요하며, 세포막에 비해 안정성이 떨어진다.
2. siRNA를 이용한 암세포 치료
2-1. 약물 전달용 캐리어를 이용한 생체 내 체류시간 증가
● 요약 – siRNA를 보호해주는 스캐폴드(PEG)와 표적화 기능을 가진 물질을 부착하여 Kidney clearance와 응집을 감소시키고, 궁극적으로 바람직하지 않은 면역 인식을 방지함으로써 siRNA의 인체 내 순환시간을 증가시키고 암세포 표적화 능력을 증대시킨다. ● 유사점 – 약물전달체를 통해 siRNA를 보호하여 siRNA의 안정성을 증가시키고 표적화 물질을 통해 siRNA 전달효율을 증가시킨다. ● 차이점 – 약물전달체의 안정성을 증대시키기 위한 스캐폴드 위에 표적화 기능을 가진 물질을 부착하는 형식으로서 제조과정이 복잡하고 고분자 기반의 약물전달체는 인체 내 청소 작용에 의해 체류시간 증가에 한계가 있으며 역반응을 일으킬 수 있는 가능성이 있다
2-2. siRNA의 종양 표적화된 전달을 위한 siRNA 다량체-글리콜 키토산 나노복합체 및 이의 제조방법
● 요약 - 종양세포(암세포) 내에서 특정 유전자의 발현을 억제하기 위한 siRNA의 전달을 위해 siRNA 다량체-글리콜 키토산 나노복합체를 형성시킨다. 형성된 나노복합체는 EPR(Enhanced Permeability and retention) 효과를 통해 종양세포로 전달되며, 종양세포 근처에서 많이 분비되는 Gluthatione 효소에 의해 분해되어 전달된 siRNA에 의한 표적 유전자의 발현을 억제한다. ● 유사점 - 생체 내에서 매우 불안정하고 분해가 쉬운 siRNA를 복합체화하여 siRNA의 생체 안정성을 증가시켜 종양세포의 성장을 억제한다. ● 차이점 - siRNA와 글리콜 키토산을 전기적 인력을 통해 복합체를 형성하였으며, 가닥으로 전달되기 때문에 전달되는 siRNA의 양이 한정적이고, 인체 내 순환시간에 한계가 있으며, 특정한 종양세포 표적화 능력 없이 EPR 효과와 종양세포에서 특이적으로 발현되는 효소에 의한 분해를 통해 전달한다.
2-3. 망막질병 치료를 위한 효과 지속성(Long-term) siRNA 기반 나노메디슨 및 이의 제조방법
● 요약 - 자기조립되어 응축된 고분자량의 siRNA 코어입자와 외부를 양이온성 고분자와 히알루론산으로 순차적으로 코팅하여 망막내부로 다량의 siRNA를 효율적으로 전달하는 입자를 제조한다. 매우 응축된 구조의 siRNA 코어입자를 포함하므로 종래에 비해 많은 양의 siRNA를 전달할 수 있으며 음전하를 띄고 있는 히알루론산은 음전하를 띄고있는 대부분의 인체 내 세포 혹은 조직과의 상호작용을 억제시켜준다. ● 유사점 - siRNA가 응축된 siRNA 코어입자를 특정 물질을 이용하여 코팅하여 기존 siRNA 코어입자가 가지고 있던 한계점을 극복했다는 점이 본 연구와 매우 유사하다고 볼 수 있다. ● 차이점 - siRNA 코어입자를 히알루론산으로 코팅하여 히알루론산을 인식하는 망막수용체를 표적화하고 안정성을 늘렸다는 점이 차이점이다. 히알루론산 코팅은 세포막에 비해 그 안정성과 표적화 능력이 떨어진다는 단점이 있다.
다. 특허전략
기존 기술들의 내용을 종합해 볼 때, 약물전달체를 통한 siRNA의 생체 안정성 증대 및 암세포 표적화 기술은 여러 가지 문제점 및 한계점을 가지고 있음을 파악하였으며, 면역세포막을 약물전달체로서 사용한 특허는 존재하지 않음을 확인하였다. 이번 프로젝트를 통해 개발될 기술은 앞서 제시된 장점을 유지한 채로 문제점에 대한 해결책을 제시할 수 있다는 점에서 기존 기술과의 차별성과 중요성을 가진다. 첫째로, 세포막을 통해 siRNA를 완전히 코팅함으로써 생체 내 핵산 분해효소로부터 siRNA를 효과적으로 보호할 수 있으며, 인체 내 청소작용으로부터 자유로워 생체 내 안정성을 극대화할 수 있다. 두 번째로, 자신의 면역세포로부터 유래한 세포막은 면역반응에 대한 부작용이 거의 없을 것이라고 예상할 수 있으며, 면역세포 자체가 가지고 있는 암세포 표적화 기능을 별다른 제조과정 및 conjugation, complexation 없이 부여할 수 있다. 따라서 완전히 새로운 약물전달체로서 면역세포막의 활용은 기존 기술의 문제점을 효율적으로 보완하고 개선시킬 수 있기 때문에 진보성과 신규성을 모두 획득할 수 있다.
개발과제의 기대효과
기술적 기대효과
(1) 생체 세포를 활용한 약물 전달 치료의 발전 효과적인 질병 치료에 있어서, 약물 전달 효율은 가장 핵심적인 동시에 난관이 많은 요소이다. 뛰어난 치료제를 개발하였어도 해당 약물이 적재적소에 전달되지 않으면 기대보다 현저히 낮은 효율을 보일 수 있을 뿐만 아니라 오히려 부작용이 발생할 수 있기 때문이다. 그러나 생체 세포를 활용한 치료법은 환자 본인의 세포를 활용하기 때문에 부작용을 최소화 시킬 수 있다.
(2) 생체 세포의 다양성과 합성 비율 조정을 통한 범용성의 발전 질병을 치료하는 방법에는 신체 내 면역기능의 강화뿐만 아니라 바이러스 세포를 직접적으로 제거하는 방법 등 다양한 치료법이 존재한다. 다양한 치료법만큼, 사용되는 세포의 종류와 합성 비율도 넓은 선택의 폭을 가져야만 한다. 생체 세포 코팅을 통한 약물 전달은 어떤 생체 세포를 사용하는지에 따라서, 면역기능을 강화 할 수도 있고 암세포를 직접적으로 제거 할 수도 있다. 또한, 질병의 진행 척도에 따라 약물의 농도가 결정되어야 하는데, 코팅 및 합성 비율 조정을 통해 능동적으로 대처가 가능하다.
경제적, 사회적 기대 및 파급효과
(1) 적은 부작용으로 인한, 부가적인 치료비용의 감소 기존 항암 치료는 높은 부작용 발생 확률 및 치료 후 관리 기간으로 인해, 입원비나 간병비와 같은 부가적인 치료비용이 높았다. 이는 암 투병 환자들에게 경제적으로 큰 부담으로 다가왔고 삶의 질을 저하시키는 큰 요인으로 작용했다. 그러나 생체세포를 활용한 치료법은 부작용이 적고 치료과정이 간략하여 전반적인 비용이 감소되는 효과가 있다.
(2) 암 투병 환자들에 대한 부정적 인식 개선 및 조속한 사회 복귀 높은 사망률 및 낮은 완치율로 인하여 기존의 암 투병 환자들에 대한 사회적 인식은 부정적이었다. 이로 인해 암 환자들은 사회 구성원으로써 제 역할을 수행하기 어려웠고, 치료 과정에서 소비된 비용 또한 환자들의 사회적 소속감을 저하시켰다. 하지만, 새로운 치료법을 통한 신속한 완치로 암 환자들의 조속한 사회복귀 및 부정적 인식 개선을 기대 할 수 있다.
(3) 기존의 치료법을 대신한 차세대 의료산업 활성화의 기반 구축 생체 세포 코팅이라는 새로운 단계가 도입됨으로써, 관련 기술에 관한 연구가 진행되어야만 한다. 그 과정에서 자본 및 인력 유입 등 긍정적인 효과를 기대 할 수 있다. 오랜 시간 정복하지 못한 질병이 아직 많이 존재하는 만큼, 새로운 치료법의 등장은 산업 전반적으로 활력을 불어넣고 경제적으로도 일자리 창출 등 선순환 효과를 기대 할 수 있다.
기술개발 일정 및 추진체계
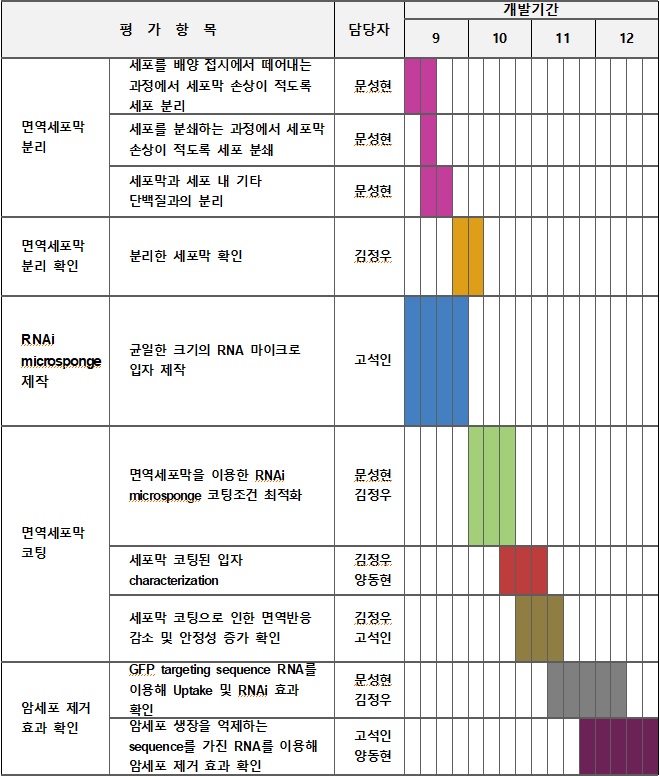
개발 일정
구성원 및 추진체계
설계
설계사양
제품의 요구사항
- 기존 RNA interference 현상을 이용한 암세포 증식 억제 및 제거 역할
- RNA particle을 면역세포막으로 감싸 혈액 내에서 안정적으로 순환
- 암세포를 타겟팅하여 RNA particle을 효과적으로 전달하는 시스템을 개발
설계 사양
내용
개념설계안
이론적 계산 및 시뮬레이션
상세설계 내용
내용
결과 및 평가
완료 작품의 소개
프로토타입 사진 혹은 작동 장면
포스터
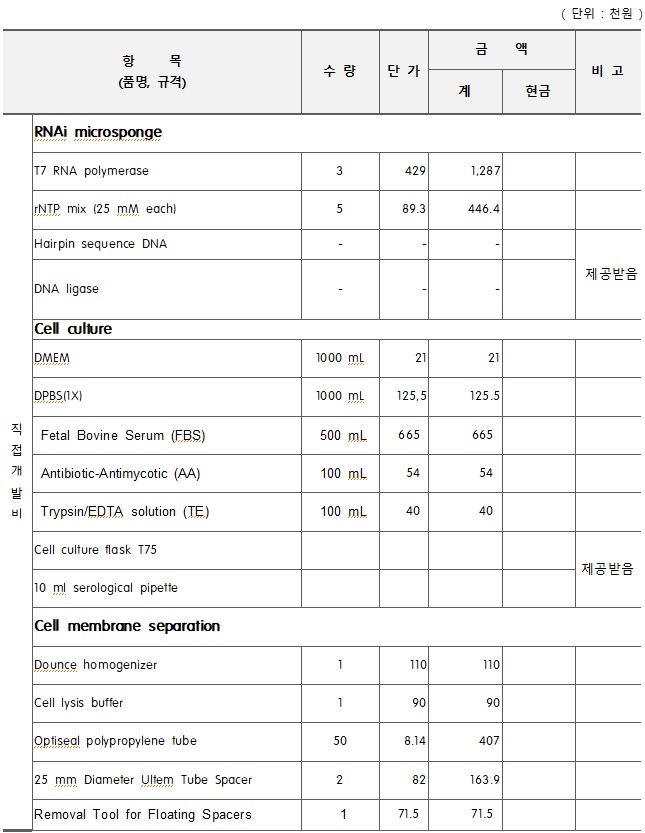
관련사업비 내역서
완료작품의 평가
향후계획
특허 출원 내용
내용