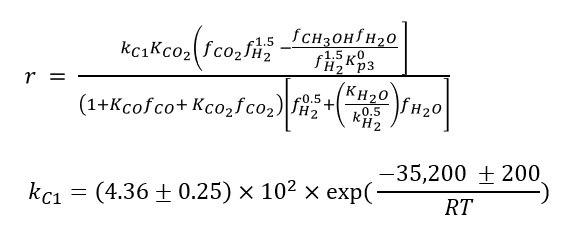유준재 교수님 1팀
프로젝트 개요
기술개발 과제
국문 : Coke Oven Gas를 이용한 알데하이드 생산 공정 모델링
영문 : Modeling an Aldehyde Production Process Using Coke Oven Gas
과제 팀명
유준재교수님 1팀
지도교수
유준재 교수님
개발기간
2025년 9월 ~ 2025년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20223400** 전*진(팀장)
서울시립대학교 화학공학과 20193400** 최*현
서울시립대학교 화학공학과 20203400** 남*현
서울시립대학교 화학공학과 20223400** 김*영
서울시립대학교 화학공학과 20223400** 이*민
서론
개발 과제의 개요
개발 과제 요약
◇ 인구의 기하급수적인 증가와 이에 따른 산업 발전으로 인해 에너지 수요가 급격히 증가함에 따라 과거에는 주로 화석연료를 통해 에너지가 공급되어 왔다. 현재의 탄소 기반 에너지 시스템은 글로벌 연료자원의 고갈과 기후변화에 대응해야 하며, 이에 따라 새로운 재생 가능 에너지원의 탐색과 화석연료의 지속가능한 활용이 에너지 공급망의 핵심 과제로 부상하고 있다. 산업 부문 중 철강산업은 가장 많은 에너지를 소비하는 분야로, 전 세계 CO₂ 배출량의 약 9%를 차지한다. 이 산업에서 생성되는 COG(Coke Oven Gas)는 연료이자 환원제로 사용되며, 석탄을 Coke Oven Battery에서 고온으로 산소 없이 가열해 생산된다. COG는 높은 함량의 수소와 유용한 화합물을 포함하고 있어, 여러 산업 폐가스 중에서도 특히 주목받는 자원이다.
◇ Formaldehyde는 전 세계적으로 연간 약 2,500만~3,000만 톤 이상이 생산되어 소비되는 대표적인 기초 화학물질로, 산업적 가치가 매우 큰 물질이다. 높은 반응성과 저렴한 원가 덕분에 다양한 부가가치 화학제품의 전구체로 활용되며, 특히 Melamine - Phenol 수지·요소 수지 등 고부가가치 수지 생산에 핵심적으로 사용된다. 이러한 수지는 접착제, 합판, 파티클보드, MDF, 단열재 제조에 필수적인 성분으로, 건축·가구 산업 전반에서 막대한 수요를 차지한다. 경제적 측면에서도 Formaldehyde는 매우 중요한데, 특히 COG와 같은 철강 산업 부생가스를 원료로 활용할 경우 저부가가치 가스를 고부가가치 화학물질로 전환할 수 있어, 자원 활용 효율을 높이는 동시에 온실가스 저감 효과까지 달성할 수 있다.
◇ 본 연구는 화석연료의 지속가능한 활용을 목표로, Coke Oven Battery에서 생산된 raw COG를 기반으로 Syngas를 생산하여, 최종적으로 고부가가치 물질인 Aldehyde를 얻는 것을 목표로 한다.
◇ 먼저, raw COG는 냉각 공정을 거쳐 온도를 낮춘 후, H₂S/NH₃/BTX scrubber를 통해 해당 물질들을 제거한다. 이후, desorption 공정을 통해 흡수된 성분을 탈착시켜 용매를 재순환한다. 이 일련의 purification 과정을 통해 clean COG를 생산하게 된다. 정제된 clean COG에는 합성연료 (Syngas)와 Olefin을 포함하고 있다. 본 연구는 크게 두 경로로 Formaldehyde를 생산하고자 한다. 먼저, Syngas를 Methanol로 합성하여 Formaldehyde를 생산하고자 한다. 두 번째로는, 대표적 Olefin 물질인 Ethylene을 합성하여 Formaldehyde를 생산하고자 한다. 이처럼 COG를 활용하여 Formaldehyde를 생산해내는 공정을 통합하여 구성하고자 한다.
◇ 마지막으로, 구축된 Aspen Plus 시뮬레이션 모델을 바탕으로 TEA를 수행하여 경제성을 평가하고, 이를 통해 공정의 실현 가능성을 검토한다. 더 나아가, 해당 공정이 관련 산업 전반에 미칠 수 있는 경제적 파급 효과를 분석한다.
개발 과제의 배경
◇ 그림 1을 보면 20세기 이후 인구의 빠른 증가와 산업화의 가속으로 글로벌 에너지 수요는 빠르게 증가하는 추세이다. 이러한 수요는 주로 화석연료의 연소 및 활용으로 충당되었으나, 지구온난화와 환경오염 문제의 발생으로 친환경 에너지 공급원의 개발, 기존 화석 연료의 개질을 통한 탄소 배출 저감 및 환경오염 감축이 요구되고 있다.
그림 1. Global direct primary energy consumption (Energy Institute - Statistical Review of World Energy (2024))
◇ Coke Oven Gas (COG)는 철강 산업의 주요 열원인 코크스의 주 부산물로, 석탄을 무/저산소 조건에서 고온 가열하는 공정에서 생성된다. 과거 COG는 다량의 수소, CH4 등의 가연 성분에 집중하여 단순히 연료로 사용하였다 (그림 2). 그러나 기술의 개발로 CH4를 활용한 SMR (Steam Methane Reforming), WGS (Water-Gas Shift) 등의 공정이 도입되어 Syngas와 수소 생산의 가능성이 입증되었고, COG 내 성분을 다양하게 활용한 고부가가치 생산 공정 연구가 관심을 모으기 시작하였다.
그림 2. Composition of COG (이전 연구에서 발췌)
◇ Syngas는 COG를 통해 얻을 수 있는 대표적인 핵심 원료로, 수소와 CO의 혼합 가스이다. Fisher-Tropsch 합성, Methanol 합성 등 다양한 공정의 원료로 활용되며 꾸준한 산업적 수요를 보이고 있다. 대표적인 Syngas의 생산 원리는 상술한 SMR (Steam Methane Reforming)과 부분 산화 (Partial oxidation)이다. SMR은 CH4를 수증기와 함께 개질하여 Syngas를 얻는 방식이고, 부분 산화는 제한된 산소량에서 CH4를 반응시켜 Syngas를 얻는 방식이다. 본 연구에서는 일차적으로 가치 있는 Olefin 성분을 분리한 후, 남은 COG를 Syngas로 변환하는 공정을 제시할 것이다.
◇ Formaldehyde는 1859년 발견되어 1868년 생산법이 확립된 이래, 가장 중요한 화학적 중간체의 일종으로 간주되어 왔다. 접착제, 고분자 화합물, 페인트, 코팅제 등 산업적으로 광범위하게 활용되는 Formaldehyde의 수요를 충족하기 위해 다양한 생산 공정이 고안되었고, 최초 생산법이었던 Methanol-공기 혼합 증기의 백금 촉매 반응을 시작점으로 수율 제고를 위한 촉매 개발과 공정 개발이 지속되어 왔다.
◇ 다양한 연구에도 불구하고, formaldehyde의 주 생산 방법은 여전히 Methanol을 원료로 한다. 현재 주로 활용되는 BASF 공정 (Water Ballast Process)는 Methanol-물의 혼합물을 사용하며, ICI/Degussa 공정은 Methanol-공기 혼합물을 사용한다. 하지만 두 공정 모두 700K 이상의 고온을 필요로 하기에 대량의 에너지를 요구하는 문제가 있다. 이를 극복하기 위해 최근 주목받는 Formox Process는 Methanol-공기 혼합물을 기존 silver 촉매가 아닌 철-몰리브덴 촉매에 통과시키는 방식으로 550~600 K의 상대적 저온의 반응 조건을 확보하며 에너지 효율을 제고하였다. 하지만 선행 연구에서는 단일 반응기에 대한 반응 조건을 위주로 연구하였기에, 공정 전반에 대한 경제성 및 에너지 분석이 부족한 상태이다.
◇ 따라서 본 연구는 COG – Syngas – Methanol – Formaldehyde까지의 전 생산 공정을 Aspen Plus를 통해 모사 및 연결하고, Formaldehyde 생산 효율을 분석한다. 또한 Syngas 생산 공정 이전에 Olefin을 선제적 분리하여 이를 활용한 고부가가치 부산물 공정을 모사한다. 그림 2에서 활용되는 Olefin인 Ethylene (C2H4)와 Propylene (C3H6)를 각각 분리하여, 가치 있는 물질을 생산하는 Oxidation 공정을 설계한다.
◇ 이를 통해 COG로부터 고부가가치 생산물을 만드는 다양한 공정의 흐름 포트폴리오를 완성한다. 또한 각 공정의 효율 및 경제성 평가를 통해 공정의 현실성과 기술적 타당성을 평가한다. 본 연구로 COG 통합 활용 공정 구조를 완성함으로써 COG를 보다 가치 있게 활용하는 방법론을 제시하고 지구온난화 예방, 탄소 배출 저감에 기여할 수 있을 것이다. 또한 고부가가치 화학제품 전환의 방향 제시로 순환경제 구현과 지속가능한 화학 산업의 패러다임 구축을 돕는다. 궁극적으로 온실가스 배출 저감과 경제적 효율성을 달성하고 탄소 중립 사회로의 전환 가속에 힘을 싣고자 한다.
개발 과제의 목표 및 내용
◇ 따라서 본 연구는 2가지의 큰 갈래로 진행된다. 먼저 첫 번째로 COG – Syngas – Methanol – Formaldehyde까지의 전 생산 공정을 Aspen Plus를 통해 모사 및 연결하고, Formaldehyde 생산 효율을 분석한다. Methanol – Formaldehyde 공정에 기존 연구된 반응기를 도입하여 세부 모사하면서, 차세대 반응기가 도입된 신공정의 운용 효율 검증을 통해 공정의 현실성을 보인다. 위 공정을 구현하는 과정에서, 정제하지 않은 COG에는 NH₃, H₂S, 고체 불순물이 포함되어 있으므로 이를 H₂S 0.01 ppmv 이하, NH₃ 0.1 ppmv 이하, BTX 5 ppmv 이하로 제거하는 것을 목표로 한다. 또한 Methanol 합성 비율에 맞는 Syngas를 제조하기 위하여 CH4를 chemical looping 공정을 통해 H2, CO 비율을 조절한다. Methanol로부터 Formaldehyde를 메탄올 잔존 0.5 wt% 이하, 금속 불순물 1 ppmv 이하로 생산하는 것을 목표로 한다.
◇ 또한 두 번째로 COG 내 Olefin 성분을 활용한 고부가가치 부산물 공정을 모사하고 그 효용을 확인한다. 이를 위해 COG에서 Syngas 생산 공정으로 진행하기 이전 Olefin 성분을 선제적 분리한다. Figure 2에서 확인되는 Olefin인 Ethylene (C2H4)와 Propylene (C3H6)를 각각 활용, Ethylene으로는 Formaldehyde 생산 공정을, Propylene으로는 Propylene oxide, Acrylic acid 등의 생산 공정을 선택하여 연구한다.
◇ 앞선 두 갈래의 공정 모사로 COG를 원료로 하는 고부가가치 물질 생산 공정을 구현한 후, 기술-경제성 평가 (Techno-Economic Analysis, TEA)를 통해 설계한 공정의 현실적, 경제적 타당성을 검토하여 공정 완성도를 종합적으로 판단한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
◇ COG off-gas에 존재하는 다량의 CH₄를 Reforming하여, Syngas를 제조하는 연구가 활발히 진행되어 왔다. 이 공정은 Steam Reforming, Autothermal Reforming, Dry Reforming으로 구분된다. 가장 상업적으로 사용되는 공정은 Steam Reforming(SMR)이다. 주된 반응은 아래와 같다.
CH₄ + H2O → CO + 3H2 (1)
이 반응은 Ni/Al₂O₃ 촉매 상에서 수행되며, 일반적으로 800–900 °C의 고온과 20–30 bar의 고압 조건에서 운전된다. 흡열반응으로, 외부 열원을 필요로 하며, 반응 평형은 온도가 높을수록 Syngas 생성량이 늘어나지만 과도한 온도에서는 촉매 열화 및 탐소침적이 촉진된다.
◇ COG off-gas에 존재하는 다량의 Syngas(H2, CO2)로부터 Methanol을 생성하는 연구는 활발히 진행되어 왔다. Methanol의 경우 H2와 마찬가지로 차세대 연료로 주목받고 있으며, 최근에는 단순 화학원료의 범위를 넘어 탄소중립 시대의 핵심 에너지 캐리어 및 전환 플랫폼으로서 그 중요성이 재조명되고 있다. Syngas로부터 Methanol을 합성하는 주된 반응은 아래와 같다.
CO + 2H2 → CH3OH (2)
CO2 +3H2 → CH3OH + H2O (3)
CO2 +3H2 ↔ CO + H2O (RWGS) (4)
이 반응들은 모두 Cu/ZnO/Al₂O₃ 촉매 상에서 수행되며, 일반적으로 200–300 °C의 중온과 40–100 bar의 고압 조건에서 운전된다. 온도가 지나치게 높으면 Methanol이 열분해되거나 CO₂ 전환율이 저하되고, 온도가 낮으면 반응속도가 급격히 떨어지므로 이 범위가 최적 영역으로 평가된다. 반응물의 몰비는 통상적으로 H₂/(CO + CO₂) 의 비율을 수율과 운전 조건에 따라 2-3 정도로 조정하며, 미반응 가스는 재순환(recycle)하여 원료 활용 효율을 높인다. 상업적 Methanol 생산 공정은 Lurgi 및 ICI(Imperial Chemical Industries) 공정이 대표적이다. 초기의 고압(250 bar 이상) 공정은 높은 장치비를 요구했으나, Cu계 촉매의 도입 이후 저압 공정(50–100 bar) 으로 전환되며 에너지 효율이 크게 개선되었다. 일반적으로 다관형 고정층(multitubular fixed-bed) 반응기를 이용하며, 반응 후 생성된 Methanol·물 혼합물은 응축 및 저압 증류를 통해 순수 Methanol로 분리된다.
그림 3. Reaction mechanism of methanol production from Syngas
◇ Ethylene(C2H4)으로부터 Ethanol(CH3OH)을 생산하는 대표공정은 Ethylene direct hydration이다. 산업적으로는 고체 담지형 인산(Phosphoric Acid) 촉매를 실리카/규조토 등에 담지한 SPA(H₃PO₄/SiO₂) 를 고정층 반응기에 충전하여, Ethylene과 수증기 혼합물을 고압·중온에서 통과시키는 방식이 표준이다. 생성물은 주로 Ethanol이며, 부반응으로 디에틸 에테르(di-ethyl-ether)가 소량 형성될 수 있다. SPA는 강한 브뢴스테드 산성점과 안정한 담지 구조 덕분에 상업 공정에서 오랫동안 주력으로 쓰여 왔다. 공정은 250–300 °C, 70–80 bar 범위에서 운전되며, Ethylene:Steam 몰비는 촉매 탈활성(인산 용출)과 에테르 형성 억제를 동시에 고려하여 수증기를 과량이 되지 않게 설정한다. 논문에 따르면, 몰 기준 수증기/Ethylene = 0.6 조건에서 단일 패스의 전환율은 4–25%로 보고되며, Ethanol selectivity가 98%라고 보고된다. 단일 패스의 전환율이 낮으므로 미반응 가스를 Recycling하여 전체 수율을 높인다. Indirect hydration 라고 불리는 황산 흡수–가수분해 2단계 공정(Ethyl hydrogen sulfate/Diethyl sulfate 중간체 경유)이 먼저 상업화되었지만, 부식·폐산 처리·에너지 비용 등의 한계로 현재는 직접 수화 공정이 주류로 자리 잡았다.
◇ Formaldehyde 생산의 주요 경로는 Formox 공정과 은 촉매 공정으로 구분된다. Formox 공정은 Methanol을 산화철–몰리브덴(Fe–Mo) 복합 산화물 촉매 위에서 부분 산화시켜 Formaldehyde를 생성하는 방식이다. 해당 반응은 세 단계로 구분된다. 먼저 Methanol이 촉매 표면에서 해리 흡착되어 메톡시–몰리브덴(Mo–OCH₃) 종을 형성하고, 다음으로 이 메톡시 리간드가 산화되어 Formaldehyde로 탈리되며 촉매가 환원된다. 마지막으로 산소에 의해 촉매가 재산화되어 순환이 완결된다. Waters은 이러한 3단계 메커니즘이 실제 Formox 고체 촉매에서 일어나는 반응과 본질적으로 동일함을 기상 질량분석 기반 촉매 주기 실험으로 검증하였다. 특히 Mo₂O₆(OH)⁻ 이온 쌍이 Methanol을 Formaldehyde로 산화하는 과정에서 이원자 몰리브데이트 중심이 핵심적으로 작용함을 규명하였으며, 단핵체 시스템에 비해 훨씬 높은 반응성을 보인다고 보고하였다. 이는 Fe–Mo 산화물계 촉매의 이중 금속 산화 중심이 공정의 선택도와 활성 향상에 기여함을 뒷받침한다.
그림 4. Gas-phase catalytic cycles for the oxidation of methanol to formaldehyde
◇ Ethanol로부터 Acetaldehyde를 생산하는 주요 경로는 비산화 탈수소화(dehydrogenation) 공정이다. 이 공정은 일반적으로 Cu 기반 촉매를 사용하며, 500 K 이상에서 높은 전환율과 선택도를 확보할 수 있다. 탈수소화 반응은 흡열성이며, 부생성 수소를 동시에 얻을 수 있기 때문에 COG 기반 통합 공정과의 연계성이 높다. Pang은 계층적 구조의 Cu-MFI Zeolite catalyst를 설계하여, 523 K에서 97%의 에탄올 전환율과 93%의 아세트알데하이드 선택도를 500시간 이상 유지함을 보고하였다.이는 촉매 표면의 Cu⁺와 Cu⁰ 간의 전자 이동이 탈수소화 반응 주기를 안정적으로 유지함을 의미한다. 연구진은 Cu⁺가 에탄올의 O–H 결합을 활성화하여 에톡시 중간체를 형성하고, 이후 β-C–H 절단을 통해 Acetaldehyde를 생성하며, 생성된 H 원자가 Cu⁰로 이동해 H₂로 탈리되는 Cu⁺/Cu⁰ 이원 활성 메커니즘을 제시하였다. 이러한 Cu 기반 비산화 탈수소화 공정은 귀금속 촉매를 대체할 수 있는 경제적이고 지속 가능한 경로로 평가된다. Pang의 연구에 따르면, Cu-MFI의 높은 안정성은 제올라이트 내 미세공극이 Cu 종의 소결을 억제하기 때문이며, 이는 기존 Cu/SiO₂ 촉매보다 장기 운전 성능이 우수함을 보여준다. 또한 동일 논문은 ZnO, Al₂O₃, 탄소 지지체 등과의 복합 구조 설계를 통해 Cu⁺의 전자밀도 조절 및 선택도 향상 가능성을 제시하였다. 이러한 연구는 향후 COG-기반 Ethanol 탈수소화를 통한 Acetaldehyde 생산 공정의 상용화에 필요한 촉매 수명 및 공정 통합 설계 방향성을 제공한다.
그림 5. Typical reaction networks for Ethanol dehydrogenation
◇ COG off-gas에 포함된 C2계 Olefin 중 Ethylene을 활용하고자 하는 연구는 꾸준히 진행되어 왔다. 특히 Ethylene을 Acetaldehyde로 반응시키는 산업적 process인 Wacker process(Hoechst-Wacker process)는 1960년 첫 공정 설립 이래 꾸준히 Acetaldehyde 생산의 주요 path로 여겨져 왔으며, PdCl2 수용액과 CuCl2 촉매를 기반으로 한다. 더 높은 수율의 반응 조건을 찾고 공정 성능 향상을 위해 Lambert et al. 은 Wacker process에 대한 C2-C4까지의 Olefin-Aldehyde 반응의 PdCl2 촉매에서의 kinetics을 연구하였다. 연구에서는 Pd과 O2의 농도 변화에 따른 C2-C4의 전화율을 확인하고 반응 속도 및 활성화 에너지 값을 제안하였다. 실험 결과에 따르면 올레핀/O2 비율은 화학양론적인 2:1의 비율이 유지되어야 하며, Pd 이온의 재생 반응이 병목이 될 가능성을 제시하였다.특허 에 의하면 현재 산업적으로 가장 활발히 사용되는 촉매는 PdCl2 – CuCl2 – HCl 액상 Wacker process이며, 본 연구의 Ethylene-Acetaldehyde 공정 모사에서도 동일한 촉매 조건을 사용한다.
그림 6. Catalytic Cycle of Wacker Process
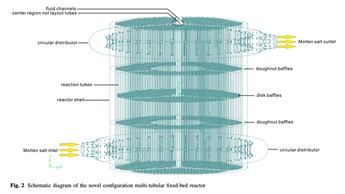
◇ COG의 off-gas 내 Olefin 중 C3H6 (Propylene)을 활용하고자 하는 연구 또한 진행되고 있다. C3H6를 Acrolein (C3H4O) 으로 선택적 부분 산화 (Selective Partial Oxidation) 하는 반응은 Acrylic Acid 생산의 첫 번째 단계로서 산업적으로 매우 중요한 경로이다. 이 반응은 높은 발열성을 가지므로 이 공정 구현의 핵심 과제는 반응기 내에서의 효율적인 열 관리와 촉매 비활성화 및 부산물 생성 방지라고 할 수 있다. 그림 7에 나와 있는 Multitubular Fixed-bed Reactor을 사용하며, 최적의 열 제거를 위해 최대 30,000개의 튜브로 구성될 수 있다.
그림 7. Multitubular Fixed-bed Reactor의 diagram
촉매로는 우수한 selectivity를 보이는 Bismuth Molybdate (Bi(MoO4)3) 기반 촉매가 사용된다. C3H6 전환율 95% 이상, 튜브 압력 강하 10% 미만, 반응 온도 633-703 K 유지 등의 설계 제약 조건을 충족하도록 공정을 구현해야 한다. 반응열을 제거하기 위해 냉각재로 높은 열용량과 우수한 열전달 계수를 가진 Molten Salt를 이용한다. 이 반응은 Redox Mechanism, 즉 Mars-van Krevelen Mechanism을 따르는 것으로 확인되었으며, 이는 lattice oxygen을 산소원으로 사용하여 분자 산소보다 선택적 산화에 유리하다. 목표 물질인 Acrolein 외에도 연속적인 산화 반응을 통해 Acrylic acid가 생성되거나, Acetaldehyde, CO2, CO 등의 부산물이 생성된다. 복잡한 반응 관계를 담은 반응 네트워크 모델이 개발되었고 31개의 운동 매개변수를 통해 공정의 동적 거동과 제어 전략 수립에 이용된다.
그림 8. Reaction networks for Propylene selective partial oxidation
나. 특허조사
◇ US 9102532 B2 (“Method for producing synthesis gas for methanol production”) 이 특허는 천연가스를 원료로 하여 Syngas를 생산하는 방법에 관한 것이다. 기존의 Steam Reforming 공정은 800–950 °C의 고온과 Ni 촉매가 필요한 흡열반응이지만, 생성가스 내 수소가 과잉되고 CO/CO₂ 비가 낮아 메탄올 합성 공정 효율이 떨어지는 한계가 있었다. 본 발명은 이러한 문제를 개선하기 위해, 원료 가스의 일부를 촉매 부분산화(Catalytic Partial Oxidation, CPO)로, 나머지를 수증기 개질과 Water-Gas Shift (WGS) 반응으로 각각 처리한 뒤, 두 스트림을 재결합하는 이중 경로 개질 방식을 제안한다. 이 공정에서는 첫 번째 스트림이 CPO 반응을 거쳐 H₂, CO, CO₂ 등을 포함하는 혼합가스를 형성하고, 두 번째 스트림은 SR과 WGS를 통해 추가적인 CO와 H₂를 생성한다. 이후 두 혼합가스를 혼합하여 최종 Syngas의 (H₂ − CO₂)/(CO + CO₂) 비율(R ratio)을 약 1.95 ~ 2.05로 조정한다. 이는 메탄올 합성 반응에 가장 적합한 조성 범위로 알려져 있으며, 공정 전체의 수소 과잉 문제를 완화하고 열효율을 높일 수 있다.
◇ Johnson Matthey Davy Technologies: “Process and plant for the production of methanol” (EP 1262228 A1) 이 특허는 Syngas의 대용량 처리에서 반응기 내 열 제거(핫스폿)와 압력강하 문제를 줄이기 위해, 촉매층을 수평 방향으로 얕게(“shallow bed”) 배치하고, 기체 유동을 수직 방향으로 통과시키는 독특한 촉매 볼륨 레이아웃을 제안한다. 얕은 층은 같은 촉매량에서 단면적을 넓혀 열전도·복사에 의한 온도 평탄화를 돕고, 하부의 상대적으로 뜨거운 영역에서 상부의 차가운 영역으로 열을 빠르게 전달하여 온도 구배를 완화한다. 이 배치는 대형기에서의 열관리 안정성과 장치 내 압력강하 저감을 동시에 노려, 기존 수직 용기·깊은층 설계 대비 운전 윈도우를 넓히는 것이 포인트다. 대규모 루프에서 고압 분리기–재순환과 결합하면, 고부하에서도 촉매 수명과 선택도 유지에 유리하다.
◇ Luyben, William L. "Design and control of a methanol reactor/column process." Industrial & engineering chemistry research 49.13 (2010): 6150-6163. Luyben (2010)의 “Design and Control of a Methanol Reactor/Column Process” 논문은 Syngas로부터 메탄올을 생산하는 공정의 설계·운전 통합을 체계적으로 분석한 대표적인 선행연구이다. 이 연구는 고정된 Syngas 유량에서 경제성을 극대화하기 위해 반응기 압력·온도, 플래시탱크 압력, 리사이클 비율, 증류단수 등을 변수로 설정하고 Aspen Plus 시뮬레이션을 통해 최적 조건을 도출하였다. 반응기는 Cu/ZnO/Al₂O₃ 촉매를 적용한 다관식 튜브형 구조로, LHHW( Langmuir–Hinshelwood–Hougen–Watson ) 형태의 Vanden Bussche–Froment 속도식을 사용하였다. 반응은 264 °C 의 중온 조건에서 고압 증기를 발생시키며, 약 110 bar 에서 운전되어 에너지 회수와 생산효율의 균형을 이룬다. 이때 전체 탄소전환율은 약 96%에 달하며, gas recycle ratio는 3.36, purge ratio은 2.2%로 설정되었다. 또한 2 bar 저압 플래시 드럼과 42단 증류 컬럼을 통해 MeOH/물 분리를 단순화하였다. 경제성 분석 결과 에너지 및 자본 비용보다 제품 수율이 수익성에 지배적임을 보였고, 반응기 압력 상승은 전환율 증가 효과와 압축 비용 증가 효과 사이의 절충점에 의해 결정됨을 밝혔다. Luyben은 또한 플랜트 전체의 조작성 향상을 위해 공정 압력을 직접 제어하지 않고 부동시켜 상호보완적 루프제어를 적용하는 새로운 Plant-wide Control 전략을 제시하였다. 이는 공정 교란이나 Syngas 조성 변동에도 제품 규격을 유지하는 제어 구조로 검증되었다. 따라서 이 논문은 반응기–증류–재순환 시스템을 하나의 통합 체계로 접근한 첫 사례로서, 이후 메탄올 공정의 에너지 통합, 재순환 최적화, 제어 전략 수립 연구들의 기반이 되었다.
◇ US 4181629A (“Catalyst for the oxidation of methanol to formaldehyde …”) 미국 특허, 발행일 1980-01-01 이 특허는 Methanol을 Formaldehyde로 전환하기 위한 산화촉매 조성 및 그 제조방법을 제안한다. 구체적으로는 알루미나 또는 실리카 지지체 위에 철산화물(Fe-oxide) 및 몰리브덴산화물(Mo-oxide)를 조합해 코팅한 촉매를 사용하며, 지지체의 비표면적과 공극 부피를 낮게 유지함으로써 과산화(완전산화)로의 진행을 억제하고 높은 선택도 확보가 가능하다고 기술되어 있다. 핵심 포인트는 (i) 지지체의 특성(비표면적 ≤ 1 m²/g, 공극부피 ≤ 0.2 mL/g) 제어, (ii) Mo:Fe 원자비 ≈ 1.5-2.5:1 설계, (iii) 기상 반응 온도 약 300 °C 조건에서 메탄올 전환율 ≈ 95% 및 선택도 ≈ 80%를 보고한 점이다. 이로써 Formox형 산화철–몰리브덴 산화물 촉매 적용 가능성과 고유한 설계 변수 제시가 특허의 의의이다.
◇ 유연식, 신현종, 최병렬, 최영현, 조영진, 김덕기, 박주연, 박광호, "불포화 알데히드 및/또는 불포화 산의 제조방법," 대한민국 특허 KR10-0714606B1, 출원일 2006년 2월 20일, 공고일 2007년 5월 7일, 특허권자: 주식회사 엘지화학.
본 특허는 Propylene으로부터 불포화 Aldehyde (Acrolein) 및 불포화 Acrylic Acid를 제조하는 Shell-and-Tube 반응기에 관한 것으로, 촉매 유효성분 내부의 세공 밀도 및 크기 조절을 통해 촉매 활성을 단계적으로 제어함으로써 Hot spot 문제를 해결하고 고수율의 생성물 제조를 가능하게 하는 기술이다. 전통적인 Mo-Bi계 촉매를 사용하되, 반응기 입구에서 출구로 갈수록 촉매 비표면적이 증가하도록 다층 충진하여 발열 반응을 효과적으로 제어하는 것이 핵심이다. Propylene을 Acrolein 및 Acrylic Acid로 전환하는 공정은 일반적으로 두 단계로 구성된다. 제1단계에서는 Mo-Bi계 촉매를 사용하여 Olefin을 불포화 Aldehyde로 전환하고, 제2단계에서는 Mo-V계 촉매를 이용해 불포화 Aldehyde를 불포화산으로 산화시킨다. 이 반응은 매우 강한 발열 반응(–347 kJ/mol)으로 반응기 입구에서 Hot spot이 발생하여 COx 부산물이 증가하고, 고온에 노출된 촉매의 비활성화가 가속화되어 촉매 수명이 단축되는 문제가 발생한다. 본 특허는 촉매 제조 시 요소, 나프탈렌 등 승화성 또는 열분해 물질을 첨가하여 건조·소성 과정에서 이들이 제거되며 세공을 형성하도록 함으로써 촉매 비표면적을 5-100 m²/g 범위에서 정밀 조절한다. 반응기 입구에는 저활성 촉매, 중간에는 중활성 촉매, 출구에는 고활성 촉매를 다층 충진하여 반응물 농도 분포에 따라 촉매 활성을 최적화한다. 실험 결과 다층 충진 시 프로필렌 전환율 98.9%, 선택도 97.3%, 수율 96.2%를 달성하였으며, 최대 발열부 온도도 340 ℃로 단일 촉매 대비 19 ℃ 낮았다. 4,000시간 장기 운전 후에도 수율 96.1%를 유지하여 안정성과 내구성이 입증되었다. 본 기술은 촉매 크기를 균일하게 유지하면서 세공 조절만으로 활성을 정밀 제어하여 반응관 막힘 없이 높은 전환율과 선택도를 동시에 달성하며, 상업적으로는 2-3단 촉매층으로 충분한 효과를 얻을 수 있다.
◇ US 4220803A (“Catalytic dehydrogenation of ethanol …”) 미국 특허, 발행일 1980-12-30 이 특허는 Ethanol을 Acetaldehyde 및 Acetic acid로 전환하는 기상 산화적 탈수소화(Oxidative Dehydrogenation, ODH) 공정을 제안한다. 여기서는 산소와 Ethanol 혼합가스를 Cu-크롬 산화물 지지 촉매(바륨 제외) 위에서 접촉시키며, 산소:Ethanol 몰비를 약 0.1 ~ 0.5 범위로 제시하고 있다. 주요 기술 포인트는 (i) 고농도 Ethanol 투입 가능성 확보, (ii) 바륨이 없는 촉매 조성으로 수명 및 선택도 개선, (iii) Acetaldehyde와 Acetic acid을 높은 선택도로 동시에 생산하는 공정 구조이다. 본 특허는 특히 Ethanol→Acetaldehyde 경로에서 촉매 설계 및 반응조건(산소/Ethanol 비율, 온도) 조정에 관한 산업 적용 가능성 높은 기술을 담고 있다.
◇ Hoechst AG. Verfahren zur Oxydation von Olefinen zu Aldehyden, Ketonen oder den Aldehyden entsprechenden Säuren. German Patent DE 1190451 B, issued April 8, 1965. 해당 특허는 Olefin을 Aldehyde/Ketone/Carboxylic acid로 산화하는 공정을 제안하며, 현대적 Wacker process의 핵심 아이디어를 제시하고 있다. Ethylene 등 Olefin을 air 등 산소 함유 가스로 산화시키는 흐름으로, 수용액 하에 Pd계 촉매와 구리 산화물 등 산화/환원 보조계를 촉매로서 포함한다. Pd계 촉매 외 주기율표 8족 귀금속이 사용될 수 있으며, 이러한 촉매 조성은 수용액 내 8족 귀금속과 그 염이 올레핀과 착물을 형성하고 산화/환원 보조계와 함께 촉매로 작동하는 Wacker-Hoeschst형 수(水)계 Pd/Cu/HCl 시스템의 토대이다. 즉 Pd계(주기율표 8족계) 촉매와 산화/환원 보조계를 결합한 연속 운전이 가능한 균일계(Homogeneous) 촉매 공정을 제시하는 데에 의의가 있다. 촉매-레독스(산화/환원) 조합 반응 조건을 기-액 접촉이 보장되는 흡수탑/버블탑/충전탑류 장치에 적용 가능함을 시사하며, 2단 운전 등 전화율 제고를 위한 방향성을 제시한다. 뿐만 아니라 공기 사용, 재순환, 분무/비말 회수, 부식/촉매 손실 억제 등 개량 특허의 출발점으로 위치하고 있다. 해당 촉매 구조는 현재 Wacker process에 적용되어 Aldehyde 생산에 사용되고 있으나 경우에 따라 케톤, 탄소 개수에 상응하는 Carboxylic acid 제조까지 가능함을 시사하고 있다.
다. 특허전략 ◇ 본 연구는 COG로부터 Aldehyde군 고부가가치 생산물을 제조하는 통합 공정을 설계한다는 점에서 기존 연구와 명확한 차별성을 갖는다. 기존 연구들이 COG를 단순 연료로 활용하거나 수소 생산에 집중한 반면, 본 연구는 COG 내 다양한 성분(Syngas, olenfin)을 체계적으로 분리·활용하여 Formaldehyde를 포함한 Aldehyde군 화합물을 생산하는 전체 공정 포트폴리오를 구축한다는 점에서 독창적이다.
◇ 특히, COG에서 Aldehyde군 고부가가치 화합물을 생산하는 연구는 선행 사례가 거의 없으며, 본 연구가 이 분야의 선구적 연구가 될 것으로 예상된다. 기존 Formaldehyde 생산 연구들이 단일 반응기 수준의 촉매 개발이나 반응 조건 최적화에 집중한 것과 달리, 본 연구는 촉매 개발이 아닌 공정 전체의 설계, 통합, 경제성 및 환경성 평가에 초점을 맞춘다.
◇ 본 연구는 크게 두 가지 전략적 접근으로 진행된다. 첫 번째 전략은 COG 정제 후 Syngas 기반 Formaldehyde 생산 경로이고, 두 번째 전략은 Olefin 선제적 분리 및 Aldehyde군 생산 경로이다.
◇ 첫 번째 전략은 COG를 정제하여 Syngas를 생산하고, 이를 기반으로 Methanol을 거쳐 최종적으로 Formaldehyde를 생산하는 경로이다. 먼저 coke oven에서 생성된 raw COG를 정제하여 clean COG를 생산한다. 정제된 clean COG에는 H2와 CO를 포함한 Syngas 성분과 Olefin이 함유되어 있다. 본 연구에서는 clean COG로부터 Syngas를 제조하기 위해 다양한 개질 기술을 검토하고, Methanol 합성에 최적화된 H2/CO 비율을 달성할 수 있는 공정을 선정하여 적용한다. 생산된 Syngas는 Methanol 합성 반응기로 공급되며, 여기서 생성된 Methanol은 산화 반응을 통해 최종 목표 생산물인 Formaldehyde로 전환된다.
◇ 두 번째 전략은 clean COG에서 Olefin 성분을 선제적으로 분리하여 고부가가치 화합물을 생산하는 경로이다. Clean COG에 포함된 Ethylene, Propylene 등 Olefin과 기타 탄화수소를 먼저 분리하고, Ethylene은 Wacker process를 통해 Aldehyde를 생성하고 Propylene은 산화 반응을 통해 Acrolein (Aldehyde의 한 종류)을 생성한다. 이러한 접근은 Syngas 전환 경로로 진행하기 전에 보다 직접적이고 효율적인 방법으로 Aldehyde군 화합물을 생산할 수 있다는 장점이 있다.
◇ 이러한 이중 경로 전략은 COG의 모든 가치 있는 성분을 최대한 활용하여 경제성을 극대화하는 동시에, 다양한 시장 수요에 대응할 수 있는 유연한 생산 체계를 구축한다.
◇ 본 연구는 Aspen Plus 소프트웨어를 활용한 전체 공정의 모델링 및 최적화를 핵심 방법론으로 채택한다. 촉매 개발이나 실험실 규모의 반응 연구가 아닌, 산업 현장에 적용 가능한 실제 플랜트 규모의 공정 설계를 목표로 한다.
◇ 공정 설계의 현실적 타당성을 검증하기 위해 TEA(Techno-Economic Analysis)를 수행할 예정이다. TEA를 통해서 투자비, 운전비, 생산원가, 순현재가치(NPV), 내부수익률(IRR), 투자 회수 기간 등의 재무 지표를 산출하고 주요 변수에 따른 민감도 분석을 수행한다. 이를 통해 COG 활용 Aldehyde군 생산 분야의 선구적 연구를 수행하여 저부가가치 산업 폐가스를 고부가가치 화합물로 전환하는 공정 모델을 제시할 수 있고, 단순한 공정 설계를 넘어 실제 산업 현장 적용 가능성을 종합적으로 입증할 수 있다.
개발과제의 기대효과
기술적 기대효과
◇ COG는 H2, CH4, Olefin 등 가치 있는 물질을 다량 함유하고 있기에 여러 방면으로의 활용이 주목되는 물질이다. 특히 최근 가장 주목받는 물질인 수소를 비교적 고농도로 포함하고 있으므로 고부가 화학 원료의 전환이 가능한 자원이다. 또한 Aldehyde는 다양한 화학 물질의 중간체(intermediate)로 사용되며, 후속 공정에 의해 산(Acid), 에스터(Ester), 플라스틱, 수지, 용제 등으로 전환될 수 있는 고부가가치 전구체이다. 본 연구에서는 COG에서 알데하이드까지의 전환 공정을 Aspen Plus로 모사하고, COG 내 물질의 선택적 분리와 Aldehyde까지의 다양한 루트를 제안하여 COG와 Aldehyde 간의 기술적-산업적 연결성을 보이고자 한다.
◇ COG의 처리 및 활용 공정에 관한 연구는 많이 선행됐으나, 이는 공정 내 Scrubbing, Stripping 등 부분 공정에 국한되어 왔다. 본 연구는 raw COG로부터 purification 과정을 거친 off-gas를, PSA(Pressure-Swing Adsorption)와 증류(distillation) 등의 방식으로 분리 후 분리된 물질군(Group) 별로 Aldehyde 생산 공정까지 연결하여 COG-to-Aldehyde 공정 네트워크의 기술적 가능성을 시험한다. 뿐만 아니라 Raw COG부터 생산물(Aldehyde)까지의 전 공정을 통합적으로 모사하여 성능 및 경제성을 평가함으로써 공정 전체에 대한 동시 성능 연구를 진행한다.
◇ 특히 Ethane(C2H6)과 Ethylene(C2H4)의 분리는 두 물질의 비교적 비슷한 끓는점과 물성 등의 이유로 기존에는 membrane, 극저온 증류 등의 까다로운 방식으로 진행되었고, 주기적인 막 교체 비용이나 극저온 상태 유지 비용 등의 단점이 존재했다. 본 연구에서는 Ethane-Ethylene 혼합 기체에서 Ethylene의 선택적 반응을 통해 Ethanol, Acetaldehyde를 생산하여 기체-액체 flash 분리하는 공정을 도입하여, Ethane-Ethylene 분리의 새로운 방식을 제안한다.
경제적, 사회적 기대 및 파급효과
◇ 본 연구에서 제안하는 COG-to-Aldehyde 전환 공정은 철강산업의 부산물인 COG를 부가가치가 낮은 연료용 가스가 아닌 고부가 화학원료 생산 자원으로 재활용함으로써, 산업 내 자원 순환형 가치사슬(Resource Circular Economy) 구축에 기여한다. COG는 기존에 단순 연소 또는 부분산화(SMR, ATR) 등의 용도로 활용되어 왔으나, 본 연구의 공정은 이를 직접 고부가 화합물인 Aldehyde로 전환하므로 원료 단가 대비 부가가치를 약 3~5배 이상 향상시킬 잠재력을 가진다.
◇ 철강 공정과 화학 공정을 통합(Integration) 하는 “철강-화학 융합 공정”을 실현함으로써, 기존 석유계 원료로부터 생산되던 Aldehyde류의 생산비를 절감하고 화석자원 의존도를 완화할 수 있다. 국내 주요 제철소에서 연간 배출되는 COG는 약 8~10 billion Nm³ 수준으로, 이를 활용한 공정이 상업화될 경우 연간 수천억 원 규모의 원료 절감 및 신시장 창출 효과가 기대된다.
◇ 본 공정은 극저온 분리나 고비용의 membrane 시스템을 대체할 수 있는 반응-분리 결합형(reactive separation) 공정 구조를 도입함으로써, 설비 투자비(CAPEX) 및 운영비(OPEX)를 모두 절감할 수 있다. 이로써 산업 전반의 에너지 효율성 향상 및 온실가스 감축에 따른 경제적 보상(ETS credits, LCA benefits) 도 동시에 확보할 수 있다.
◇ 국내 최초로 COG의 정제부터 고부가 화합물 생산까지를 하나의 통합 공정으로 설계 및 모사한 사례로서, COG의 전주기(End-to-End) 활용 가능성을 제시함으로써 산업 구조의 패러다임 전환을 촉진하는 효과를 기대할 수 있다. 지금까지 COG 관련 연구는 탈황, 탈암모니아, PSA 등 “정제 단계”에 머물러 있었으나, 본 연구는 정제 이후 분리·반응·생산까지를 모두 하나의 시스템으로 통합 설계하였다. 이러한 접근은 COG를 단순한 부생가스가 아닌 ‘신규 화학원료 플랫폼(Alternative Feedstock Platform)’으로 인식하게 하는 사회적 전환점을 마련하며, 향후 철강·정유·화학 산업 간의 연계 확대를 촉진한다.
◇ 본 연구는 COG를 고부가 화학제품으로 전환할 수 있는 실질적 공정 설계 로드맵을 제시했다는 점에서 사회적 실현 가능성이 높다. 현재 상용화된 COG 활용 기술이 거의 없는 상황에서, 본 연구의 모사 결과는 향후 실증 프로젝트나 산업 기술이전의 기반이 될 수 있으며, 이는 국내 철강산업의 탈탄소화와 부가가치화 전략을 동시에 달성하는 국가적 모델로 확장될 잠재력을 가진다.
설계
목표 달성을 위한 설계(실험)방법
전체적인 흐름
해당 그림은 정제된 COG를 받아와 최종적으로 Formaldehyde를 생산하는 통합 공정의 Aspen Plus 흐름도를 나타낸다.
(1) 정제된 COG를 feed로 하며, 그중 Steam Methane Reforming(SMR) 과정을 통해 Methane으로부터 추가적인 Syngas를 생산한다. (2) Syngas를 활용하여 Methanol을 생성하는 recycle 공정을 거친다. (3) 생성된 Methanol을 활용하여 Formaldehyde를 생산한다.
Methane to Syngas
그림 10. SMR Flow Sheet
위 그림은 SMR 공정의 흐름을 나타내는 flow sheet이다. 해당 공정은 이전 연구에서 받아온 정제된 COG 중 Methane과 증기를 이용했다. 아래는 CLN-COG와 H2O-1의 조성이다.
그림 11. CLN-COG 조성(mass)
그림 12. H2O-1 조성(mass)
CLN-COG가 이전 연구에서 받아온 조성이며, 참고 논문 13에 근거해 Methane과 steam의 mass ratio를 1:6으로 맞춰주었다.
그 후 inter cooling과 compressor를 이용해 공정에 알맞은 온도와 압력인 900 , 20 bar까지 올려준다. 다음으로 REACTOR1에 넣어 반응시킨다. REACTOR1은 RGibbs를 사용하여 아래 반응들에 대해 평형으로 진행해주었다.
(1) CH4 + H2O →3H2 + CO
(2) CH4 + 2H2O →4H2 + CO2
(3) CO + H2O → CO2 + H2
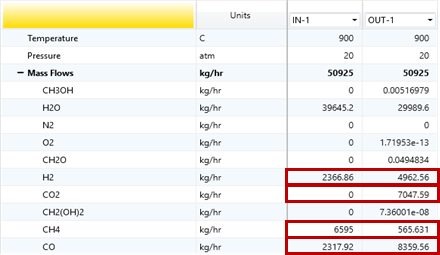
그림 13. REACTOR1 결과
그림 13과 같이 Methane은 conversion 91.43%으로 기존 6,595 kmol/hr 중 565.631 kmol/hr를 제외하고 모두 전환되었다. 그 결과 CO는 2,317.92 kmol/hr에서 8,359.56 kmol/hr, H2는 2,366.86 kmol/hr에서 4,962.56 kmol/hr, 그리고 CO2는 새로 7,047.59 kmol/hr가 생성되었다.
반응이 끝나고 온도를 COOLER-1을 통해 30 까지 낮춰주고, compressor로 시작하는 다음 공정을 위해 FLASH-1을 사용해 액체 상태인 H2O와 Syngas를 분리해준다.
Syngas to methanol
그림 14. Syngas to Methanol flow sheet
위 그림은 앞선 공정에서 생성된 Syngas를 활용하여 Methanol을 생성하는 공정의 흐름을 나타낸 flow sheet이다. 참고문헌 14에 의하면 해당 공정은 50 bar, 200 ~ 250 반응 조건에서 일어난다. 따라서, COMP2를 활용하여 압력을 50bar로 상승시켜준다. 이때, 단열 압축 조건에 의하여 해당 flow는 온도 또한, 25 에서, compressor를 지나 59 로 상승하게 된다. 이후, HEATER-4를 사용하여 230 로 온도를 올려주고, 맞춰준 조건에서 REACTOR2에서 아래와 같은 반응이 일어나게 된다.
(1) CO + 2H2 → CH3OH
(2) CO2 + H2 → CO + H2O (3) CO2 + 3H2 → CH3OH + H2O
위 3가지 반응식에 대해 각각 general-custom reaction을 사용해 kinetic 값을 입력해주었다. 다음 반응에 대한 kinetic 반응식은 아래와 같다.
(1) CO + 2H2 → CH3OH
(2) CO2 + H2 → CO + H2O
(3) CO2 + 3H2 → CH3OH + H2O
해당 kinetic 값을 REACTOR2에 대입한 결과, 그림 15와 같은 결과를 얻을 수 있었다.
그림 15. REACTOR2 결과
이후, 생성된 Methanol을 포함한 OUT-2-2을 COOLER-2에서 40 까지 냉각하여 Methanol을 응축시킨다. 이후, FLASH-2를 활용하여 액상으로 응축된 Methanol은 하부로 배출되며, 상부의 기체는 공정 내 recycle로 재투입된다. FLASH-2에서 배출된 상부의 기체는 FSPLIT을 지나며 일부, 불필요하게 쌓이는 기체는 PURGE STREAM을 통해 0.1의 비율로 배출되며, 대부분의 기체는 다시 반응기로 재순환된다.
이러한 기체 재순환은 전환되지 않은 Syngas를 다시 반응기로 보내어 Methanol 전환율 및 생산량을 극대화하기 위한 핵심 운영 전략이다.
Methanol to Formaldehyde
그림 16. Methanol to formaldehyde flow sheet
위 그림은 Methanol을 이용해 Formaldehyde를 생성하는 공정의 흐름을 나타내는 flow sheet이다. 해당 공정은 세 단계로 진행된다. 첫째, 4.2에서 생성한 Methanol feed를 Formaldehyde production을 위한 inlet stream으로 전환한다. 둘째, REACTOR3에서 Formaldehyde production 반응을 진행한다. 셋째, 불안정한 Formaldehyde를 ABSORBER에 투입하여 목표 용액을 만든다.
첫째, 4.2에서 생성한 METHANOL stream 83.3wt%의 Methanol과 그 외 부산 물질로 이루어져 있다. 물을 추가한 뒤 HEATER-5에 투입하여 vapor fraction이 1이 되도록, 즉 모두 기체 상태가 되도록 가열한다. 그 후 AIR를 추가한 MET+W+A stream을 600 ℃로 가열하면 최종 inlet stream이 되어 REACTOR3로 투입될 준비를 마치게 된다.
둘째, Inlet stream을 REACTOR3에 투입하여 Formaldehyde 생성 반응을 진행한다. REACTOR3는 Packed-bed reactor이고 silver catalyst의 loading은 10 gm으로 설정한다. 600 ℃, 1 atm 조건에서 아래의 RDS (Rate-Determining Step) 반응이 일어나게 된다.
(1) CH3OH + 0.25O2 →CH2O + 0.5H2 + 0.5H2O
(2) CH2O + 0.5O2 → CO2 + H2
참고문헌 16을 참고하여 위 2가지 반응식에 대한 kinetic 반응식을 입력해 시뮬레이션을 진행했다.
(1) CH3OH + 0.25O2 →CH2O + 0.5H2 + 0.5H2O
(2) CH2O + 0.5O2 → CO2 + H2
위의 kinetic 값을 REACTOR3에 입력한 결과, 아래의 결과를 도출할 수 있었다.
그림 17. REACTOR3 결과
Absorber 내에서 Formaldehyde와 물은 liquid-film reaction을 통해 Methylene glycol이 혼합된 수용액(Formalin)이 만들어진다. Simulation을 용이하게 하기 위해 Absorber의 stage를 17단으로 설정하였으며, absorber 내에서 아래의 평형 반응이 일어나도록 했다.
(3) CH2O + H2O → HOCH2OH
위 반응은 평형 반응이므로, 아래의 평형 상수를 입력해 시뮬레이션을 진행했다.
그림 19. ABSORBER 결과
그림 19에서 볼 수 있듯, 최종 FA-SOL는 242.848 kg/hr의 CH2O, 13,552.4 kg/hr의 OHCH2OH, 그리고 532.977 kg/hr의 CH3OH와 그 외 부산물로 이루어진 수용액이다.
Methanol to Formaldehyde 전환율을 계산하기 위해서 아래 stream result의 mole flow를 참고한다.
그림 20. Formaldehyde 조성 (mole flows)
먼저 IN-3와 OUT-3 stream을 보면, 432.214 kmol/hr의 CH3OH가 290.81 kmol/hr의 CH2O로 전환되므로 전환율은 약 78.88%이다. 반면, absorber을 거친 FA-SOL에서 290.81 kmol/hr의 CH2O가 282.098 kmol/hr의 HOCH2OH으로 전환되므로 97.2%의 높은 전환율을 가진다. 이는 참고문헌 16에서도 유사하게 높은 전환율을 확인할 수 있다.
Heat Exchanger Network(HEN)
상술한 전 공정의 원활한 작동과 높은 수율을 확보하기 위해서는 열의 공급과 제거가 필수적이다. 공정 내 스트림의 온도를 변화시키는 방법은 다양한데, 고압/중압/저압 스팀을 통해 열을 공급하고 냉각수(Cooling Water)를 통해 열을 제거하는 식으로 외부 Utility를 활용하거나 공정 내 고온 흐름과 저온 흐름을 열교환 시켜 에너지를 절약하는 열교환 방식이 일반적이다. Utility는 외부에서 추가적인 에너지 흐름을 공급해야 하는 만큼 추가 비용이 들며, 보다 많은 열을 공급/제거하여 고온/저온으로 변경해야 할 경우 그 비용이 기하급수적으로 증대된다. 그러나 공정 내 고온/저온 흐름을 적절히 교차시켜 열을 교환한다면 공급 Utility량을 획기적으로 줄일 수 있기에 이를 적절히 활용하는 것이 공정의 경제성과 현실성을 확보하는 열쇠가 된다. 열교환 네트워크(HEN : Heat Exchanger Network)는 이렇듯 공정 내 여러 스트림 간 열적 상호작용을 최적화하여 공정 효율을 극대화하는 시스템이다. 공정 내 고온 스트림에서 발생하는 폐열을 회수하여 저온 스트림을 가열함으로써 에너지 비용 절약, 탄소 배출량 감소를 목적으로 한다. Aspen Plus 내의 Energy Analysis 기능 및 Pinch Analysis를 통해 공정 내 에너지 흐름을 최적화한 모식도는 다음과 같다.
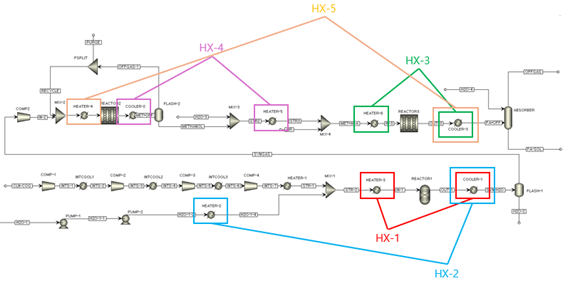
그림 21. 공정의 HEN
그림 21은 5개의 열교환기(Heat Exchanger)를 통해 HEN을 적용한 모식도이다. 각 Reactor의 outlet은 냉각이 필요하며, reactor에 들어가야 하는 inlet은 가열이 필요함에 착안하여 열교환을 진행하였다. 교환되는 스트림과 열교환의 연결은 다음 그림과 같다.
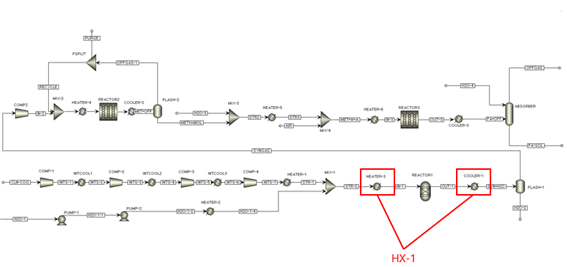
그림 22. 세부 열교환 flow sheet
HX-1 ~ 5까지의 5개 열교환기는 그림 22에 표기되어 있다. 순차적인 열교환 네트워크를 이어 설명하면,
그림 23. HX-1의 도입
먼저 HX-1을 도입하여 SMR의 전-후 스트림의 열을 교환한다. COOLER-1의 746에 달하는 고온 스트림은 최종적으로 10까지 냉각이 필요하기에, 먼저 30에서 100까지 가열이 필요한 HEATER-1에 도입하여 열을 교환한다. 이때 COOLER-1에서 온도 변화가 700 이상 필요하므로, 이 뜨거운 스트림은 1회 더 열교환을 함으로써 에너지를 추가 절감할 수 있다. 따라서 HX-2를 도입한다.
그림 24. HX-1과 HX-2의 도입
HX-2를 통해 압축된 액체인 물을 vaporization 시킨다(HEATER-2). SMR 반응은 기체상에서 발생되어야 하므로, 물 없이 수증기가 타 기체와 mix된 후 reactor에 도입되는 것이 중요하다. 따라서 COOLER-1의 아직 뜨거운 스트림을 고압 액체인 물과 열교환하여 수증기로 변환, 물을 증발시키는 큰 에너지를 절감한다. 이것으로 SMR 전후의 열교환은 종료되며, 다른 공정에서의 열교환을 이어 진행한다. Formaldehyde 공정(REACTOR3)의 전후 스트림을 열교환하기 위해 HX-3을 도입한 것이 그림 25이다.
Formaldehyde 공정의 경우 반응기를 빠져나온 스트림을 냉각시켜 미반응 gas와 Formalin을 기체-액체로 분리하는 과정이 중요하다(ABSORBER). Formaldehyde는 Methylene glycol 수용액인 Formalin으로 상업 판매되기에 빠르고 효율적인 냉각을 위해 열교환을 진행한다(COOLER-3). HEATER-6은 Formaldehyde 생산 반응을 위해 400까지 가열이 필요하고, COOLER-3은 물/Methylene glycol의 액화를 위해 100 혹은 그 이하까지 냉각이 필요하기에 HX-3을 이용해 열교환한다. 이것으로 REACTOR3 주변의 열교환은 종료되며, 마지막 반응기인 REACTOR2의 열교환을 위해 HX-4를 도입한 것이 그림 26이다.
HX-2의 도입과 비슷하게, Formaldehyde 생산 공정을 위해 물이 도입되고 물/Methanol 혼합물의 증발이 필요하다(HEATER-5). 이를 위한 열원을 REACTOR2의 outlet인 COOLER-2에서 얻고자 HX-4를 도입한다. COOLER-2는 Methanol과 off-gas(미반응 Syngas)를 기체-액체 분리하기 위한 냉각이 필요하므로, 이러한 열교환에 적절한 스트림이다. 이로써 HEATER-5의 물/Methanol 스트림을 기화하며, COOLER-2의 스트림은 20가까이 냉각되며 기체-액체가 효율적으로 상분리된다. 여기까지가 기본적인 1:1의 열교환이었으며, 추가적인 에너지 절약을 위해 COOLER-3의 뜨거운 스트림과 HEATER-4의 차가운 스트림을 한 번 더 열교환할 수 있음을 분석을 통해 확인할 수 있었다.
그림 27. HX-5의 추가 도입
HEATER-4는 고압 기체로, Methanol 생산 공정(REACTOR2)을 위해 200 이상의 가열이 필요한 스트림이다. COOLER-3은 앞서 설명하였듯 Formalin과 off-gas의 기체-액체 분리를 위해(FLASH-2) 빠른 냉각이 필요한 스트림이기에, HEATER-6과의 열교환(HX-3)에 이어 HEATER-4와 추가 열교환을 진행하며 이것이 HX-5의 도입으로 진행된다. 상술한 5개의 열교환기의 도입으로, 5개 HEATER와 3개 COOLER의 utility 사용량을 절약할 수 있다.
TEA
공정을 위한 투자 자본에는 한번에 지불하는 설치 투자비 (Capital Expenditure, CAPEX), 공장을 운용하면서 매년 지불해야하는 운영비 (Operating Expenditure, OPEX)로 이루어져 있다. 설치 투자비는 공장을 지을 때 지불해야하는 비용으로 비교적 높은 가격으로 책정되며, 장치 구입비에 간접비, 설치비, 예비비, 세금을 비율로 고려하여 책정한다. 운영비는 공장을 운영하면서 매년 지불해야하는 비용으로 크게 원료 구입비, 인건비, Utility 비용, 촉매 구입비용으로 구성되어 있다.
장치비는 Turton 책 을 참고하여 Bare Module 방법으로 진행하였다. 기준 용량대비 유량을 기반으로 크기를 고려하였고, CEPCI 지수를 통해 시간에 따른 가격상승을 고려하였다. 설치비, 간접비를 포함한 장치 비용은 $54,045,369이며, contingency와 fee는 장치비용의 각각 15%, 3%로 추정되며 총 고정 자본 투자 비용은 $63,773,535이다. 고정 투자 비용의 15%을 운전 자본으로 산정하고, 고정 자본 투자 비용과 운전 자본 비용을 합해 설치 투자비를 구할 수 있으며, $73,339,566이다.
OPEX를 구하기 위해 매년 365일 중 310일 공장을 운용하며, 2024년 기준으로 가격을 산정하였다. 이자율은 10%, 공장 운용 기간은 10년으로 가정하여 경제성 분석을 진행하였다. 정제된 COG는 11355.028 kg/hr로 유입된다. 정제된 COG는 철강 산업에서 Coke Oven Battery에서 방출되는 COG의 불순물을 제거하여 생성되므로 정확한 시장 가격 정보가 없었다. 따라서 이와 성분이 유사한 천연가스 (Natural Gas, NG)의 0.6배로 가정하여 경제성 분석을 진행하였다. 천연가스의 2024년 기준 시장가격은 0.24 $/kg 이므로, clean COG 가격은 0.14 $/kg로 산정하였다. 정제된 COG와 SMR 반응기에 같이 유입되는 물의 가격은 24은 0.002 $/kg 이다. 공정 전체 사용되는 원료는 정제된 COG, 물, 공기이며 공기의 경우 원료가격을 0원으로 산정한다. 연간 원료 구입 비용은 2024년 기준 $20,533,971이다. Utility의 종류에는 온도를 낮출 때 사용하는 cooling water, 온도를 높일 때 사용되는 High Pressure Steam과 230 ℃ 이상으로 가열할 때 사용되는 fired heater, pump와 compressor에 사용되는 전기가 있다. Cooling water의 경우 0.0000044 $/kg로 상대적으로 저렴한 편이고, HP Steam은 0.0043 $/kg, fired heater는 0.0026 $/kg, 전기의 가격은 0.078 $/kg이다. 위 가격은 모두 Aspen plus의 Utility에서 근거하였다. 연간 총 utility 비용은 12,497,632 $이다.
인건비의 경우 2011년 기준 shift operator의 하루 급여는 $43,908이며 이를 2024년 기준 연간 인건비로 환산하면 $998,377이다. 시간에 다른 임금 상승은 ECI 지수로 보정하여 고려하였다. SMR 공정에 사용되는 촉매는 Ni/Al2O3가 사용되었고, 2010년 기준으로 10,554 $/m3 13)이며, Methanol 합성 촉매는 21.36 $/kg 20)이다. formaldehyde 합성 촉매는 정확한 가격 정보의 부재로 귀금속 촉매 가격이 2015년 기준 43-121 $/kg임을 고려하여 50 $/kg으로 가정하였다. 반응기 유량과 시간을 고려하면 연간 촉매 구매 비용은 $118,320이다.
CAPEX와 OPEX를 공장 운용기간, 이자율을 고려하여 매년 판매가격이 동일하다는 가정하에 모든 투자비와 수익을 현재 가치로 환산하여 최소 판매 단가를 구하였고, formaldehyde 37 wt% 기준 0.334 $/kg로 계산되었다.
C2, C3 Olefin
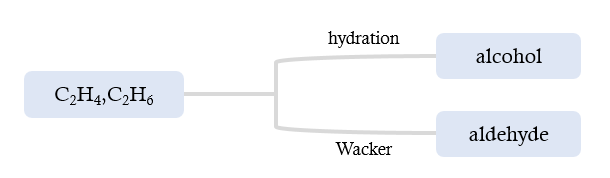
Clean COG의 조성 중 Methane을 제외한 C₂·C₃ 계 Olefin을 부가가치 화학제품으로 전환하기 위한 활용 방안을 추가적으로 제안하였다. 본 연구에서 검토한 공정은 다음과 같다.
1. C₂H₄ hydration을 이용한 Ethanol 생산 2. Wacker process를 통한 Acetaldehyde 생산 3. Propylene 선택적 부분 산화를 통한 Acrolein 생산
그림 28. 가능한 경로
C2 C3 separation
그림 29. De-ethanizer flow sheet
그림 29는 C2-C3의 분리 공정이다. 분리하는 이유는 후반 공정에서 C2를 이용한 Ethanol 및 Acetaldehyde와 C3를 이용한 Acrolein을 생산하기 위함이다. Feed는 이전 연구의 clean COG의 조성을 가져와 PSA를 거쳐 C2H2, C2H4, C2H6 그리고 C3C6만을 받아온다. 다음 공정을 운전하는 기압인 22 bar로 운용하기 위해 미리 25 bar까지 compressor 이용하여 압축시킨다. 그 후 끓는점을 이용한 분리 과정을 거치기 때문에 COOLER를 이용해 미리 –60 까지 온도를 내려준다. Distillation 과정을 거친 후 ‘DIST’와 ‘BOT’ 모두 HEATER를 이용해 상온까지 맞춰준다.
그림 30. DSTWU result
그림 30과 같이 DSTWU 블록을 돌려 ‘Minimum reflux ratio’와 ‘Minimum number of stages’를 확인하여 아래 그림과 같이 Distillation column spec을 정했다.
그림 31. Distillation column spec
Stage수는 15, Reflux ratio는 1.0 그리고 Distillate to feed ratio는 0.83435로 맞춰주었다. 또한 Feed stream은 중간 지점인 stage 7에 넣어주었다.
그림 32. Distillation 결과
결과를 보면 ‘DIST’로는 C2가, ‘BOT’에는 C3가 output으로 나오게 된다. 이때 C2는 C2H2 99.3%, C₂H₄ 99,9% 그리고 C2H6 98.9%의 수율, C3는 97.1%의 수율로 분리되었다.
C2 utilization
앞선 공정을 통해 분리된 C₂H₄, C₂H₆을 활용할 수 있는 추가적인 전환 경로를 검토해보았다. 정리하면, 1) Ethylene을 hydration하여 Ethanol을 생성하는 경로 2) Wacker process를 이용하여 Aldehyde를 생성하는 경로가 있다. 그림 33은 이러한 C₂ 계열 탄화수소의 주요 전환 경로를 도식적으로 나타낸 것이다
그림 33. C₂ 계열 탄화수소의 주요 전환 경로
Ethylene hydration
그림 34. Ethylene to Ethanol flow sheet
그림 34는 C₂–C₃ 분리 공정을 통해 얻어진 Ethylene(C₂H₄)을 이용해 Ethanol을 생산하는 Ethylene Hydration 공정을 나타낸다. 본 공정은 공급된 Ethylene과 수증기를 혼합·가열한 후, 고온·고압 조건의 반응기에서 수화 반응을 진행하여 Ethanol을 생성하는 방식이다. 반응에 사용되는 주요 단위조작은 예열기, 압축기, 고정층 반응기, 냉각기 및 분리기로 구성되며, 생성물 중 Ethanol과 미반응 물질을 후단 분리기에서 회수한다. 반응기는 다음과 같은 주반응을 기반으로 운전된다.
(1) C2H4 + H2O → C2H5OH
해당 반응은 일반적으로 300–350 °C, 60–70 bar의 조건에서 수행된다.
Wacker process
그림 35. Wacker process flow sheet
그림 35는 C₂–C₃ 분리 공정에서 얻어진 Ethylene(C₂H₄)을 Wacker process를 통해 Acetaldehyde로 전환하는 흐름도를 나타낸다.
Wacker process는 PdCl₂/CuCl₂ 촉매를 이용해 Ethylene을 선택적으로 산화하여 Acetaldehyde를 제조하는 촉매 산화 공정이다.
주요 반응은 아래와 같이 표현된다.
(1) C2H4 + 0.5O2 → CH3CHO
Wacker process를 통해 COG에서 유래한 Ethylene을 활용하여 Acetaldehyde를 생산할 수 있다.
C3 utilization
그림 36. Propylene to Acrolein flow sheet
앞선 공정을 통해 분리된 C3H6를 이용하여 Aldehyde군 물질을 생성할 수 있는 추가적인 전환 경로를 검토해보았다. 그림 36은 C3H6 (Propylene)의 선택적 부분 산화 반응을 통해 Aldehyde군 물질 중 한 종류인 C3H4O (Acrolein)을 생산하기 위한 공정이다. 먼저 이전 분리 공정에서 얻은 Propylene과 air, steam을 MIXER와 HEATER에 투입하여 reactor feed를 생성한다.
이때 reactor feed의 조성 몰분율은 C3H6 5%, H2O 30%, O2 13.65%, N2 51.35%이며, 참고문헌 11에서 제시된 반응 조건은 643 K, 5 bar이다. REACTOR은 Pack-bed reactor이고, 10,000개의 multitube reactor이다. 촉매는 bismuth-molybdate oxide catalyst이며 bed voidage는 0.45, particle density는 1,500 kg/m3 으로 설정했다. 이때 REACTOR 내에서 아래의 반응이 일어나게 된다.
(1) C3H6 + O2 → C3H4O +H2O (2) C3H6 + 4.5O2 →3CO2 + 3H2O (3) C3H6 + 2O2 → C2H4O + CO2 + H2O (4) C2H4O + 0.5O2 → C2H4O2 (5) C3H6 + 3O2 → 3CO + 3H2O (6) C2H4O + 2.5O2 →2CO2 +2H2O (7) C2H4O2 + 2O2 → 2CO2 + 2H2O
이렇듯 coke oven gas를 이용하여 Aldehyde군의 다양한 고부가가치 물질을 생성할 수 있다는 시사점이 있다.
결과 및 평가
개발 과제 핵심 결과
Methane to syngas
그림 37. SMR 결과
SMR 공정은 본 연구의 최종 목표인 Aldehyde용 feed를 생산하기 위한 가장 기본 단계이며, 그 결과는 다음과 같다. Methane은 전환율 91.43wt%를 기록해 기존 6,595 kmol/hr 중 565.631 kmol/hr를 제외한 거의 전량이 반응하였다. 또한 CO는 2,317.92 kmol/hr에서 8,359.56 kmol/hr로 증가하였고, H₂는 2,366.86 kmol/hr에서 4,962.56 kmol/hr로 늘어났다. 이와 함께 CO₂도 새롭게 7,047.59 kmol/hr 생성되었다.
Syngas to Methanol
그림 38. Syngas to Methanol reactor 결과
다음 단계에서는 앞서 추가로 생성된 Syngas를 반응시켜 Methanol을 생산할 수 있다. CO, CO2가 함께 존재할 경우, Syngas 반응으로 인한 Methanol 생산량은 더 늘어나게 된다. 해당 reactor를 지나며 새로 생성된 Methanol의 양은 440.6511 kmol/hr이다. 또한, 공정의 Methanol 생성량을 증가시키기 위해 recycle 공정으로 설계하였으며, CO와 CO2는 각각 79.2%, 61.6%의 전환율을 보이는 것을 알 수 있었다.
Methanol to Formaldehdye
그림 39. Formaldehyde 수용액의 Mass Fraction Result
다음 단계에서 최종 목표 물질인 Formaldehyde가 함유된 수용액(Formalin)을 생산할 수 있으며, 그 결과는 그림 39에서 볼 수 있다. Formalin에는 Formaldehyde가 물과 반응한 물질인 Methylene glycol과 소량의 Formaldehyde가 포함되어 있으며, 이를 변환하면 약 36.1 wt%의 Formaldehyde 수용액이 생산되었다는 결론에 다다를 수 있다. 이는 상업적으로 유통되는 Formalin의 질량비와 매우 유사하다.
Heat Exchanger Network(HEN)
그림 40. HEN 도입에 따른 Utility 사용량과 비용 추이
그림 40의 그래프는 공정 전체의 필요 utility량을 에너지 단위로 표기한 것이다. 좌측의 Before HI 그래프는 열교환 없이 모든 가열/냉각을 utility로 공급하였을 때의 필요량으로, 213 Gcal/hr로 나타난다. 이에 반해 After HI 그래프는 그림 22의 세부 열교환 네트워크 형성 및 5개 열교환기를 적용한 공정의 utility 필요량으로, 117 Gcal/hr로 나타난다. 이는 45.1%가량의 에너지 절약 효율이며, HEN이 도입된 공정이 미도입 공정 에너지 소비량의 54.9%만을 필요로 하는 현격한 차이이다. 이는 에너지 효율성을 확보하여 공정의 현실성을 담보하기 위해서는 열교환 네트워크의 도입이 필수적임을 보여준다.
TEA(Techno-Economic Analysis
본 프로젝트에서 설계한 공정이 경제적으로 실현가능한 지 판단하고, 분석하기 위해 TEA를 실시하였다. 2024년 기준으로 clean COG 11355 kg/hr 당 formaldehyde 37 wt% 수용액 23487 kg/hr을 얻을 수 있었다. plant operating days를 310 days, discount rate 10%, plant operating life 10년으로 가정하여 연간 운용비 (OPEX)를 산정하였고, 설계대로 장치비를 계산하여 초기 투자 비용 (CAPEX)를 산정하였다.
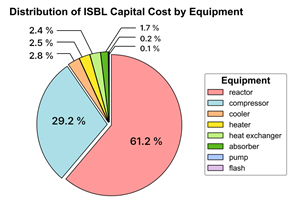
그림 41. 장치 설치 투자 비용의 분포
그림 41에서 확인할 수 있듯이, 설치 투자비 (CAPEX) 중 가장 큰 비용이자 핵심인 장치 설치비에서 장치에 따른 비용 비율에서 reactor가 61.2 %로 가장 큰 비율을 차지하며, compressor가 29.2%로 두 번째로 큰 비중을 차지함을 확인할 수 있다. Reactor의 경우, 유량과 전환율에 따라 크기가 결정되며, 크기에 비례하여 장치비가 산정된다. Reactor의 비용은 전환율, 유량에 영향을 받으므로 조절할 수 있는 범위가 제한적이다. 따라서 compressor의 비용을 줄이는 방향으로 비용의 효율성을 제고할 수 있다.
그림 42. 연간 운용비용의 분류에 따른 비용 분포
그림 42에서 확인할 수 있듯이, 주로 인건비로 이루어진 고정 운용 비용 (Fixed operating cost)이 48.6%로 가장 큰 비율을 차지한다. 보통 원료 가격이 제일 많은 비율을 차지하지만, 본 프로젝트에서 설계한 공정의 경우 산업 부산물을 활용하여 고부가가치 화합물을 만드는 공정이므로 원료 가격의 비율이 비교적 낮다. Utility 비용의 경우 원료 가격과 비슷하게 비교적 높은 비율을 차지하고 있다. Utility 비용의 대부분은 heating cost이므로 최대한 stream의 열을 회수하는 것이 매우 중요하며, 본 연구에서도 pinch analysis를 통해 최적의 heat integration을 진행하여 utility 비용을 최소화하였다.
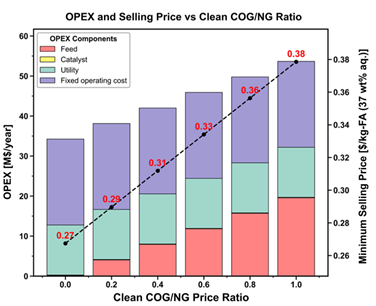
그림 43. 정제된 COG와 천연가스 (NG)의 가격 비율에 따른 OPEX 비용 분율과 최저 판매 비용
그림 43은 정제된 COG와 천연가스의 가격 비율에 따른 연간 운용 비용 (OPEX)와 최저 판매 비용 (Minimum Selling Price)의 경향을 나타낸 그래프이다. 정제된 COG의 경우 철강산업 부산물인 raw COG를 정제하여 얻으며, 원료 가격은 0원이고, 오직 정제공정의 비용을 회수할 수 있는 가격으로 책정된다. 따라서 시장 판매 가격이 정확하지 않아 성분이 비슷한 천연 가스 (Natural Gas) 가격의 비율로 산정하여 계산하였다. 가격 비율을 0-1로 0.2의 간격으로 설정하여 추이를 분석하였다. 앞서 그림 42에서 원료가격이 OPEX의 26.6 %를 차지하는 것을 확인하였고, 그림 43에서 원료가격이 최저 판매 가격에 미치는 영향을 확인할 수 있으며, 가격 비율이 0.2에서 1로 500프로 증가함에 따라 원료 가격이 24.14 % 증가함을 확인할 수 있다. 따라서 raw COG로 부터 정제된 COG를 정제하는 공정을 최소화하여 원료 가격을 최소로 확보하여 raw COG로부터 생산한 fomaldehyde 수용액의 최소 판매 가격을 낮추는게 중요하다.
그림 44. 핵심 지표에 따른 최소 판매 가격의 민감도 분석
각 변수를 독립변수로 설정하여 기준 값에서 +20%, -20%로 조정하여 MSP의 추이를 관찰하였다. Discount rate는 10%, Operating time은 10년, 정제된 COG의 가격은 천연가스 가격의 0.6배로 설정하였고 이때 최소 판매 가격은 0.334 $/kg이다. 이를 기준으로 계산 FCI, fixed operating cost, utility 가격, 전제 OPEX가 기준이 되었다. 그림 44에서 확인할 수 있듯이, discount rate가 ±20 % 변화함에 따라 비슷한 폭으로 변화하며 변화율이 가장 작음을 알 수 있다. total OPEX 지표가 ±20 % 변화함에 따른 변화율이 가장 컸으며, operating life 지표의 경우 감소하는 경우가 증가하는 경우에 비해 더 크게 증가함을 확인할 수 있다. 이를 통해 최소 판매 가격에 가장 민감한 지표와 이 지표를 통해 얼마나 가격을 조정할 수 있는지를 파악할 수 있다. 현 공정의 최소 판매 가격은 0.334 $/kg으로 시장 판매 가격인 0.75 $/kg에 비해 낮은 것을 확인할 수 있다. 다만 정확한 정제된 COG의 가격으로 OPEX를 산정한게 아니라는 점과 disposal 비용 등 자세하게 고려되지 않은 항목들의 영향을 면밀히 검토해야 한다. 그럼에도 불구하고, 현재 산업 부산물로 열 회수에 이용된 후 대기로 배출되는 COG로 고부가가치 화합물인 formaldehyde를 시장 가격에 비해 낮게 혹은 비슷한 가격으로 생산할 수 있는 가능성을 시사한다.
포스터
완료작품의 평가
향후전망
본 연구는 COG를 정제하고 전환하여 Aldehyde를 생산하고, 추가적인 고부가가치 화학 물질로 확장 가능한 통합 공정을 설계한 연구로, 향후 철강, 석유화학 산업 전반에서 높은 응용성과 경제적 가치를 창출할 것으로 기대된다. COG 정제를 통해 얻은 가스를 SMR, Methanol 합성 공정, Aldehyde 전환까지 일관된 흐름으로 통합함으로써, 전체 벨류 체인을 고려한 공정 플랫폼을 구축했다는 점에서 기술적 의의가 크다. 특히 COG의 조성 변동성에 대응할 수 있는 공정 유연성, 정제–개질–전환–분리 단계를 연계한 통합 최적화, 열교환 네트워크 기반의 에너지 효율 향상 등은 향후 상업 규모로의 확장 가능성을 높여준다. 추가적으로, C₂·C₃ 성분의 분리·정제 기술을 고도화하고 이를 다양한 산화·전환 공정과 연계함으로써, Wacker 공정을 포함한 여러 생산 루트로 확장할 수 있는 잠재력이 크다. 이는 Syngas 기반 경로와 병행하여 운전 조건, 촉매, 시장 상황에 따라 최적 생산 경로를 선택할 수 있는 고도화된 공정 유연성을 제공할 것으로 기대된다.
경제적 측면에서도 긍정적인 전망이 예상된다. COG는 철강 공정에서 대량으로 발생하지만 부가가치가 낮은 부산가스로 분류되어 왔다. 본 과제에서 제안한 공정은 COG를 고부가가치 화학제품의 원료로 전환하는 새로운 산업적 가치를 제시한다. 또한, C₂·C₃ 분리를 통해 얻은 Ethylene·Propylene을 각각 Wacker 공정 및 후속 전환 공정에 활용함으로써, 기존에 수입에 의존하던 Ethylene계 산화물 및 Alehyde류 중간체를 조달할 수 있으며, 세계적으로 천연가스와 Ethylene 가격 변동이 커지는 상황에서 장기적인 원가 경쟁력 확보에 매우 큰 이점이 될 것이다. 또한, 다양한 정밀화학, 수지, 코팅, 섬유, 전자소재 산업의 공급망 안정화에 기여할 것으로 기대한다. 또한, 본 연구에서 제시한 공정 통합 및 열교환 네트워크 최적화는 스팀, 냉각수, 전력 사용량을 절감하여 OPEX 절감 및 에너지 효율 향상에 기여할 수 있어 파일럿 및 상업 플랜트로 확장 시 경제적 실현성이 높다.
사회적 측면에서는 기존에 연소되거나 잘 활용되지 않던 COG를 화학 원료로 전환해 자원 순환성을 높이는 동시에 탄소 배출과 대기오염을 완화하는 환경적 효과가 있다. 이를 통해 2050 탄소중립 실현과, 순환 경제를 지향하는 산업 정책 방향성에 이바지하며, 정밀화학/소재 산업의 자립도 향상, 철강 공정 부산가스 활용도 증대 등 사회와 경제 전반에 긍정적 영향력을 줄 것으로 기대된다. 본 연구는 철강 부산가스의 고부가가치 전환을 위한 기술적 토대를 마련하며, 산업 경쟁력 강화와 지속가능한 사회 구현을 위한 중요한 기반 기술로 발전할 것으로 기대된다.