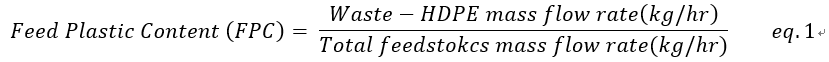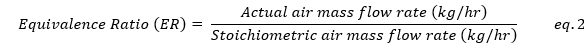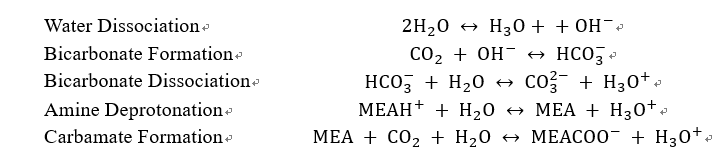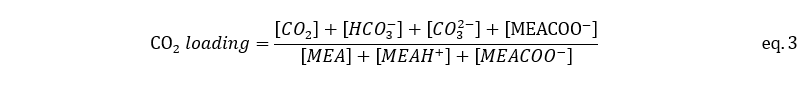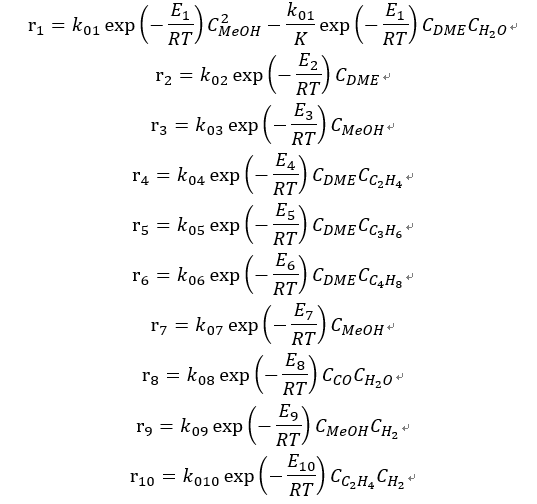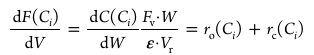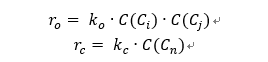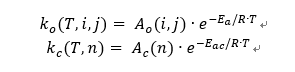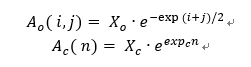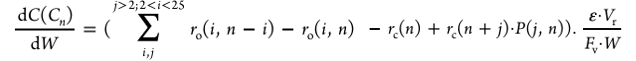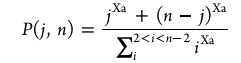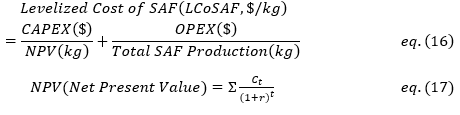유준재 교수님 2팀
프로젝트 개요
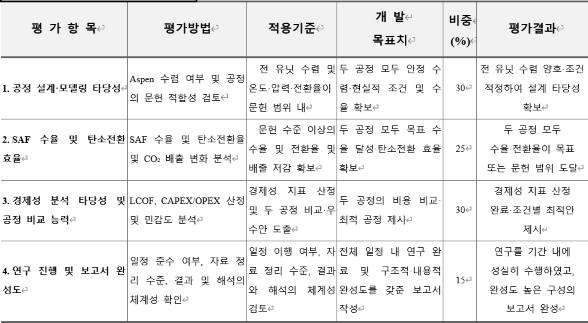
기술개발 과제
국문 : 바이오매스-폐플라스틱 기반 e-SAF 생산: Gasification 및 Alcohol-to-Jet 경로 비교 설계
영문 : Design Comparison of Gasification and Alcohol-to-Jet Pathways for Biomass and Waste-Plastic Based e-SAF Production
과제 팀명
유준재교수님2팀
지도교수
유준재 교수님
개발기간
2025년 9월 ~ 2025년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20203400** 채*기(팀장)
서울시립대학교 화학공학과 20193400** 서*호
서울시립대학교 화학공학과 20203400** 김*하
서울시립대학교 화학공학과 20203400** 김*찬
서울시립대학교 화학공학과 20203400** 황*한
서론
개발 과제의 개요
개발 과제 요약
◇ 본 과제는 바이오매스와 폐플라스틱을 혼합 원료로 활용하여, Gasification 및 Alcohol-to-Jet(AtJ) 경로를 통한 e-SAF(electro–Sustainable Aviation Fuel) 생산 시스템을 설계한다.
◇ 이후 두 경로의 에너지 효율, 환경성, 경제성을 비교·평가하여 최적의 e-SAF 생산 기술을 도출한다.
◇ Aspen Plus 기반의 공정 모델링 및 물질수지 분석을 수행하고, 원료 조성 변화(바이오매스:폐플라스틱 비율)에 따른 성능 차이를 정량적으로 검증한다.
◇ 이를 통해 혼합 폐자원의 고부가 전환과 항공연료 탈탄소화를 동시에 달성하는 지속가능형 e-SAF 공정 모델 제시한다.
개발 과제의 배경
◇ 국제민간항공기구(ICAO)는 2050년 탄소중립(CO₂ Net Zero)을 목표로 SAF(Sustainable Aviation Fuel) 상용화를 적극 추진하고 있다. 그러나 현재 상용화된 SAF의 대부분은 식물성 오일 기반 HEFA(Hydroprocessed Esters and Fatty Acids) 공정에 의존하고 있어, 식량 자원과의 경쟁 및 원료 공급의 한계가 존재한다.
◇ 이에 따라 비식물성 원료 기반의 차세대 SAF 기술 개발이 필수적이며, 바이오매스와 폐플라스틱의 혼합 전환 공정은 탄소 저감과 폐기물 문제 해결을 동시에 달성할 수 있는 유망 대안으로 주목받고 있다.
◇ Gasification과 Alcohol-to-Jet 경로는 다양한 저급 원료를 고품질 항공유로 전환할 수 있는 기술적 잠재력을 보유하고 있으나, 국내에서는 양 경로의 통합 설계 및 성능 비교 연구가 미흡한 실정이다. 따라서 본 과제는 혼합 원료 기반 e-SAF 생산 공정의 최적화와 상용화 가능성 검증을 통해 지속가능한 항공 연료 공급망 구축에 기여하고자 한다.
개발 과제의 목표 및 내용
◇ 바이오매스·폐플라스틱 혼합 원료 기반 e-SAF 생산 시스템 설계
◇ Gasification 및 Alcohol-to-Jet 경로의 효율, 환경성, 경제성 비교 분석
◇ Alcohol-to-Jet 및 Gasification 경로 비교 분석
◇ 통합 e-SAF 생산 시스템 최적 설계안 도출
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
가. State of art
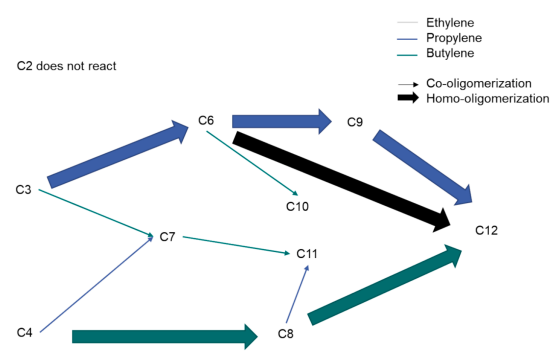
◇ Synthesis of sustainable aviation fuels via (co–)oligomerization of light olefins [1]
메탄올-투-올레핀(MtO) 공정에서 생산되는 올레핀(C₂–C₄)을 이용해 지속가능 항공유(SAF)를 합성할 수 있다. 연구진은 상용 실리카-알루미나(SIRALOX) 촉매를 사용하여, 니켈이 없는 촉매(40/0Ni)와 니켈이 2 wt% 담지된 촉매(40/2Ni)의 반응 특성을 비교했다. 반응은 120 °C, 32 bar에서 수행되었다. 프로필렌은 높은 전환율과 함께 케로신 범위(C₉–C₁₆) 탄화수소에 대한 선택도가 90 % 이상이었고, 1-부틸렌은 주로 옥텐(C₈)으로 이량화되어 케로신 선택도가 약 70 %로 낮았다. 니켈을 담지하면 에틸렌의 반응성이 높아지지만, 분지도가 줄어들어 연료의 냉유동성과 옥탄가가 저하되었다. Co-oligomerization 반응에서는 C₃ + C₄ 혼합 시 약 80 %의 케로신 선택도를 달성했으며, C₂ + C₃ + C₄ 혼합물(MtO 유사 조성)에서는 니켈이 없을 때 에틸렌이 반응하지 않았고, 니켈이 있을 때는 에틸렌 전환은 이루어졌으나 생성물이 짧아지고 품질이 낮아졌다. 이를 개선하기 위해 니켈 촉매층과 무니켈 산촉매층을 직렬로 배치한 결과, 에틸렌 전환과 높은 분지도(isoindex ≈ 1.97), 케로신 선택도(81 %)를 동시에 얻었다. 200 시간의 장기 실험에서도 촉매는 안정적으로 작동했으며, 평균 케로신 선택도는 63 %였다. 생성 연료는 ASTM D7566 기준 대부분을 충족했다(발열량 43.3 MJ/kg, 밀도 773 kg/m³). 결론적으로, C₂–C₄ 올레핀의 Co-oligomerization는 지속가능 항공유 생산의 유망한 경로이며, 니켈-무니켈 촉매 조합을 통해 에틸렌 전환과 연료 품질을 동시에 개선할 수 있음을 입증했다.
◇ (Co-)Oligomerization of Olefins to Hydrocarbon Fuels: Influence of Feed Composition and Pressure [2]
이 연구는 메탄올로부터 유래한 C₂–C₄ 올레핀 혼합물을 니켈이 담지된 실리카-알루미나 촉매 위에서 co-oligomerization하여 휘발유 및 항공유 범위의 탄화수소 연료를 생산하는 과정을 다루었다. 반응은 120 °C의 온도에서 수행되었으며, 올레핀 조성(에틸렌, 프로필렌, 1-부틸렌의 혼합비)과 압력(16–32 bar)의 변화가 생성물 분포와 구조에 미치는 영향을 체계적으로 분석하였다. 올레핀(예: 1-부틸렌)을 단독으로 사용할 경우, C₈과 C₁₂ 등 특정 사슬길이의 올레핀이 우세하게 생성되며, C₈ 생성물이 약 55 wt%, C₁₂가 약 20 wt%를 차지했다. 그러나 두 종류 이상의 올레핀을 혼합하면 반응 경로가 다양해져 C₇~C₁₂ 범위의 탄화수소가 균등하게 분포하는 혼합연료가 형성되었다. 에틸렌, 프로필렌, 1-부틸렌을 40 : 40 : 20 mol%로 혼합한 경우에도 전체 선택성의 90 % 이상이 휘발유 및 항공유 범위(C₅–C₁₆) 탄화수소로 나타났다. 제품 구조를 보면, 생성된 C₈ 올리고머의 약 80 wt%가 double-branched 구조를 가지며, 이는 옥탄가(RON)가 70~80 수준으로 휘발유 블렌딩용으로 적합하다. 삼중 가지형은 2 wt% 이하로 소량 존재했다. 이는 프로필렌의 이성질화로 인해 2-부틸렌이 형성되고, 그 결과 이중 가지 구조의 옥텐이 주로 생성되기 때문으로 해석된다. 압력 변화에 따른 영향도 분석했다. 올레핀 분압을 16 bar에서 32 bar로 높이면 프로필렌 전환율이 65 %에서 91 %로 증가하며, 액상 생성물 비율이 높아졌다. 그러나 반응 생성물은 짧은 사슬(C₉ 중심) 방향으로 약간 이동했으며, 고압에서는 고분자체(C₁₃ 이상) 생성이 억제되어 코크 형성 및 촉매 비활성화가 감소했다. 이러한 조건에서 촉매의 장기 안정성이 향상되고 재생 주기가 길어졌다. 가지침(branching)과 이성질화의 정도는 압력 변화에 크게 영향을 받지 않았으며, 모든 경우에서 이중 가지형 C₈ 성분이 우세했다. 결론적으로, 니켈/실리카-알루미나 촉매를 이용한 올레핀 co-oligomerization 공정은 메탄올로부터 유래한 재생가능한 올레핀을 고품질 휘발유·항공유로 전환할 수 있는 효율적 경로임이 확인되었다. 생산된 연료는 방향족을 포함하지 않아 입자상 배출을 줄일 수 있으며, 기존 연료 인프라에서도 그대로 사용할 수 있는 지속가능한 대체연료로서 높은 잠재력을 지닌다.
나. 논문조사
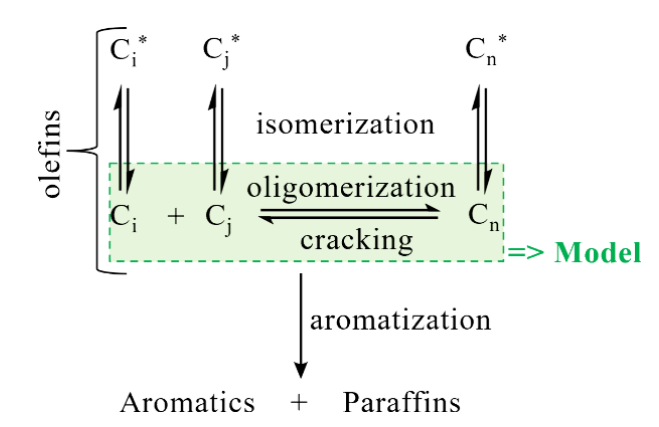
◇ Optimization of Sustainable Aviation Fuel Production through Experiment-Driven Modeling of Acid-Catalyzed Oligomerization [3].
메탄올로부터 지속가능항공연료(SAF)를 생산하는 공정을 실험 기반 모델링을 통해 최적화할 수 있다. 메탄올을 올레핀으로 전환(MTO)하고, 이를 산 촉매 하에서 올리고머화하여 C8–C16 탄화수소(항공유 범위)를 만드는 과정을 다룬다. 연구진은 복잡한 반응 네트워크를 단순화해 총 7개의 반응속도 상수로 구성된 반응속도론적 모델을 Python으로 구축했다. 실험은 ASA-50(무정형 실리카-알루미나) 촉매를 이용한 유동식 고정층 반응기에서 수행되었으며, 50 bar, 423–603 K 범위에서 여러 C3–C7 올레핀 혼합물을 반응시켜 데이터를 확보했다.
모델은 플러그 플로우 반응기(PFR) 방정식을 기반으로 하며, 올리고머화는 2차 반응, 크래킹은 1차 반응으로 가정한다. 각 반응속도상수는 탄소수에 따라 지수함수적으로 변화한다고 설정해 반응물 탄소수의존성을 단순화했다. 차등진화 알고리즘을 이용해 모델을 실험 데이터에 회귀시켰고, 얻어진 매개변수는 데이터 세트에 무관하게 일관된 값을 보여 과적합이 없음을 확인했다.
모델로부터 올리고머화 활성화에너지는 39 kJ mol⁻¹, 크래킹은 121 kJ mol⁻¹로 계산되며, 모델이 실험결과를 ±0.2 g dm⁻³ 오차 내로 잘 재현한다. 이후 저자들은 SAF 생산성을 최대화하기 위한 평가함수(FUN)를 정의하여, C8–C16 생성량(JF_prod), C17+ 생성억제(Y_H), SAF 범위 내 균질성(S)을 동시에 고려해 최적조건을 탐색했다. 최적 조건은 C4·C5 올레핀이 주성분이고, 소량의 C3·C6·C7이 선택도 조절용으로 포함된 혼합원료였다. 이 조성에서 모델이 예측한 SAF 수율은 68%, 생산속도는 2.1 g_SAF g_cat⁻¹ h⁻¹로, 실험치(66%, 2.2)와 매우 유사했다.
결론적으로 C4–C5 올레핀이 SAF 생산에 가장 유리하며, 이는 MTO 공정의 목표 생성물 조성 설계에 직접 반영될 수 있다. 개발된 모델은 단순하지만 ASA 촉매의 반응성을 정량적으로 잘 예측하며, 향후 MTO–올리고머화 통합공정 시뮬레이션 및 공정 엔지니어링 최적화의 기초가 될 수 있다.
◇ Interstage coolin in absorber: Pilot test and process modification of CO2 chemical absorption for top gas recycling-oxygen blast furnace; Technological modifications in pilot research on CO [4, 5].
Absorber에서 일어나는 반응은 발열반응이기 때문에 Absorber 하단의 온도를 상승시키고 이는 mass transfer를 방해하는 요인이 된다. 즉 rich loading 값이 제한될 수 있다. 따라서 intercooling을 통해서 중간 tray에 냉각을 시켜 더 많은 CO2를 흡수할 수 있게 할 수 있다 [4].
Xie et al에 의한 연구의 Figure 4는 absorber의 temperature profile을 보여준다 [4]. Column 가운데에 AIC (Absorber Interstage Cooler)를 설치하여 발열반응으로 인해 나온 열을 제거해, CO2 포집에 더 용이한 환경을 조성했다.
Figure 5는 AIC가 적용되기 전과 후의 regeneration energy를 비교한 것을 나타낸다. MEA를 사용한 공정에서 필요한 regeneration energy가 8.47% 감소하여 3.78 GJ/tonneCO2의 값을 나타낸다. 이는 냉각으로 인한 효율적인 포집을 통해, 더 적은 regeneration energy로 같은 양의 CO2를 포집할 수 있다는 의미이다.
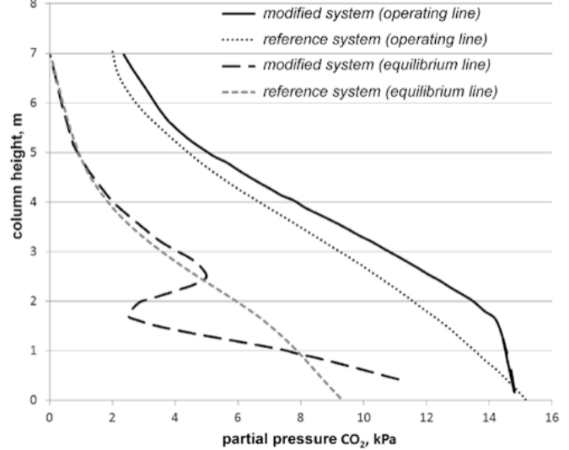
Spietz et al의 Figure 6는 intercooling으로 인해 발생하는 operating line과 equilibrium line의 차이를 보여주고 있다 [5]. CO2의 partial pressure가 intercooling으로 인하여 변화하고, 이는 absorber에서 driving force (CCO2, eq - CCO2, liquid)를 향상시켜준다.
본 공정에서 Aspen Plus에 적용하기 위해선 pump around 기능을 이용해 cooling을 해서 다시 넣어주는 방법을 사용할 수 있다.
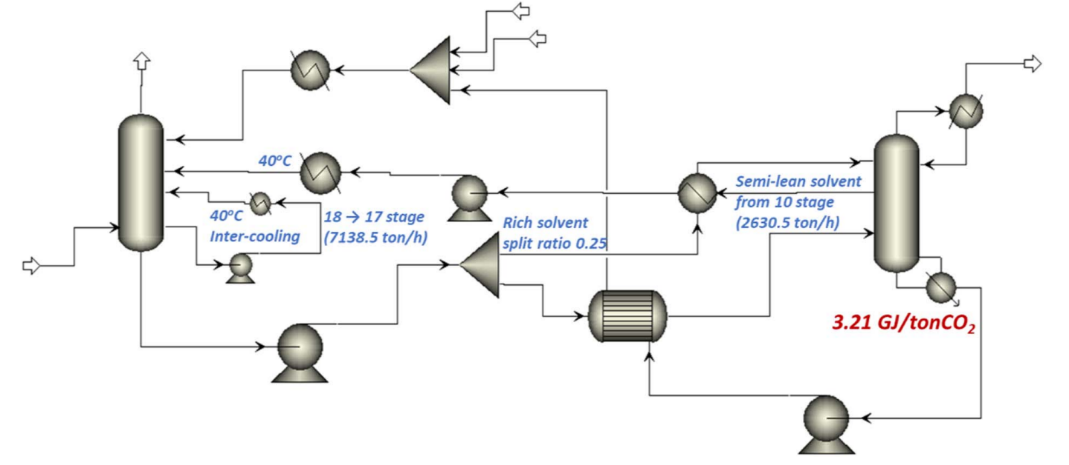
◇ Semi lean solvent: Process integration and design for maximizing energy efficiency of a coal-fired power plant integrated with amine-based CO2 capture process [6].
Oh at el는 6.1의 inter-cooling, semi-lean solvent, rich solvent split 세 가지 방식을 적용시켜 3.21 GJ/tonneCO2를 달성하였다 [6]. 여기서 semi-lean solvent의 방식에 주목하였다.
Semi-lean solvent는 stripper 중간부에서 부분적으로 재생된 solvent를 말한다. 이를 냉각시켜 absorber로 다시 주입하는 방식으로 에너지를 절감한다. 모든 solvent를 lean 상태로 만들기 위해선 상당한 regeneration energy가 필요하다. 따라서 일부 용액을 stripper 중간에서 뽑아 absorber에 주입하여 다시 흡수 용액으로 재사용한다.
이를 Aspen Plus에 적용할 때, semi-lean withdraw stage 산정이 가장 중요할 것이다. 너무 상단에서 뽑게 된다면 absorber에서의 흡수 능력이 떨어질 것이고, 너무 하단에서 뽑게 된다면 이미 많은 reboiler energy가 사용되었을 것이다. 따라서 sensitivity analysis를 통해서 적절한 withdraw stage를 선정하는 것이 가장 중요한 인자이다.
◇ Mechanical Vapor Recompression (MVR): Comparative desorption energy consumption of post-combustion CO2 capture integrated with mechanical vapor recompression technology.[7]
Mechanical Vapor Recompression이란 stripper로부터 들어오는 혹은 나오는 고온의 solvent를 flash 후 compress해서 새로운 열원으로 쓰는 개념이다. 이는 기존 reboiler에서 사용되는 steam의 양을 줄일 수 있고, reboiler energy 또한 줄어들게 된다. Figure 8은 lean solvent를 flash 한 후, flashed vapor를 compress해서 stripper에 주입해 새로운 열원으로 쓰이는 공정을 나타낸다. 하지만 이 공정은 flash 후에 액체상의 온도가 낮아진다는 단점이 있다. 이는 heat exchanger로 인한 열전달에 불리하고, 궁극적으론 stripper으로 주입되는 rich solvent의 온도 하락을 야기한다.
이로 인해 등장한 대안은 Direct rich solvent split flow to reboiler integrated with LVR이다. 이는 rich solvent를 split하여 대부분은 stripper로 바로 주입하고, 나머지 일부는 reboiler로 바로 주입된다. 이를 통해 heat exchanger의 열부하를 줄일 수 있다. 위의 LVR 공정과 다르게, heat exchanger는 일부의 rich solvent에 의해서만 열교환을 하기 때문에, stripper로 들어가기 전의 rich solvent의 온도가 조금 더 효율적으로 오를 수 있다. Li et al은 DRS-LVR로 인해 기존 공정에 비하여 20%의 reboiler duty 감소를 달성했다.
이 공정을 Aspen plus에 적용하려면 split ratio의 최적화가 필요하다. Figure 9에서 보이는 SF-1과 SF-2와의 split ratio를 sensitivity analysis를 통하여 분석할 필요가 있다. 뿐만 아니라 flashed vapor를 compress하는 electric cost, 관련 설비에 대한 CAPEX 등 열에너지 관점 뿐 아니라 종합적인 Techno economic analysis를 통하여 경제성을 판단할 필요가 있다.
개발과제의 기대효과
기술적 기대효과
◇ 공정 다양화에 따른 SAF 생산 유연성 확보 동일한 가스화 공정에서 생성된 합성가스를 대상으로, FT 경로와 MeOH–AtJ 경로를 병렬 비교함으로써 합성가스 조성(H₂/CO 비율), 원료 공급 상황, 운전조건 변화 등 외부 변수에 대응 가능한 다양한 SAF 생산 루트를 확보할 수 있다. 이는 원료공급망이 불안정한 폐자원 기반 시스템에서 공급 안정성과 기술적 회복탄력성을 강화하는 효과가 있다. 향후 시장·정책·인프라 조건에 따라 최적 경로를 선택적·가변적으로 운전할 수 있는 공정 유연성을 확보한다.
◇ 통합 시뮬레이션 기반의 성능·효율 비교 및 최적화 가능 Aspen Plus를 활용해 두 경로의 물질·에너지 수지, 열통합, CO₂ 배출량을 정량적으로 비교함으로써, 경제성, 이산화탄소 저감 효과 등을 체계적으로 평가할 수 있다. 이를 통해 각 경로의 장단점을 기술적으로 명확히 규명하고, 최적 운전 조건 및 통합 운영전략을 도출하는 데 기여한다. 연구 결과는 향후 폐자원 기반 SAF 공정의 설계 표준화 및 scale-up 전략에 활용 가능하다.
경제적, 사회적 기대 및 파급효과
◇ 국내 폐자원 기반 SAF 공급망 구축
두 SAF 생산 경로를 모두 고려함으로써, 국내에서 발생하는 바이오매스 및 폐플라스틱 자원을 항공연료로 전환할 수 있는 기술 포트폴리오를 확보한다. 이는 해외 원유·연료 수입 의존도를 줄이고, 국가 차원의 SAF 자급률 향상 및 공급 안정성 확보에 기여한다. 또한 원료 수거·전처리–가스화–SAF 생산으로 이어지는 지역 분산형 가치사슬 구축이 가능해진다.
◇ SAF 생산비용 저감 및 경제성 분석 근거 확보
각 공정의 CAPEX, OPEX, 연료 생산단가를 산정하여 경제성 비교지표를 도출한다. 이를 통해 투자비·운전비·공정효율 간 상관관계를 분석하고, 향후 상용화를 위한 비용 최적화 전략 및 투자 의사결정 근거를 제시한다. 결과적으로, 정책적 인센티브나 배출권 거래제 적용 시 경제적 타당성을 평가하는 데이터 기반을 마련한다.
◇ 탄소중립 및 순환경제 전환에의 기여
가스화–SAF 통합 시스템을 통해 폐기물의 고부가가치 자원화, CO₂ 배출 저감, 친환경 항공연료 공급이 동시에 가능하다. 이는 정부의 2050 탄소중립 로드맵과 항공연료 SAF 혼합의무제(2030년 10%)에 대응하며, 지속가능 항공산업 전환의 핵심 기술 근거로 작용한다.
기술개발 일정 및 추진체계
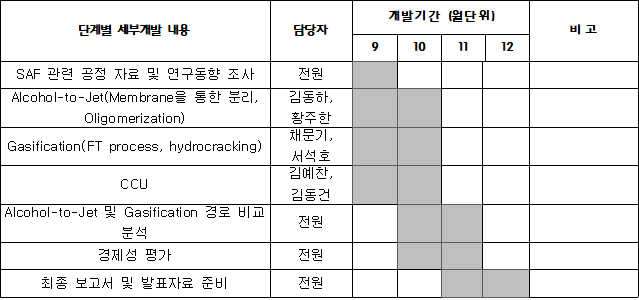
개발 일정
구성원 및 추진체계
◇ SAF 관련 공정 자료 및 연구동향 조사
SAF 생산 관련 각 공정의 특성을 조사하고 Alcohol-to-Jet 및 Gasification에 필요한 공정에 대한 최신 연구 동향을 파악한다.
◇ Alcohol-to-Jet(Membrane을 통한 분리, Oligomerization)
에탄올에서 에틸렌, 올리고머, 수소첨가 과정을 거치는 반응 메커니즘을 설계하고, membrane 투과 유량 계산 식을 활용하여 공정 최적화를 수행한다. 그 중 Oligomerization은 프로필렌과 뷰텐은 따로 분리하지 않고 동시에 Oligomerization하는 공정을 설계하고자 한다. 또한 각 반응 단계의 탄소수지와 에너지 효율을 정량적으로 평가하여 AtJ 경로의 최적 운전 조건을 도출한다.
◇ Gasification(FT process, hydrocracking)
선행연구 논문의 FT process 생성물 분포 계산식을 활용하여 생성물 양을 계산하고, 이를 문헌 및 실험 데이터와 비교하여 모델의 타당성을 검증한다. 또한 HYSYS 모델을 통해 Hydrocracking을 수행하여 SAF 생산 효율을 극대화한다.
◇ CCU
MEA(Monoethanolamine) 흡수제를 이용한 CO₂ 포집 공정(CCU)을 중심으로 모델링을 수행한다. 흡수탑과 재생탑을 포함한 공정을 Aspen Plus 기반으로 시뮬레이션하여 흡수제 농도, 흡수온도, 재보일러 열부하 등 주요 인자를 최적화한다. 이를 통해 포집 효율을 90% 이상으로 향상시키고, SAF 생산 공정과의 열 통합을 통해 전체 시스템의 에너지 소비를 최소화한다.
◇ Alcohol-to-Jet 및 Gasification 경로 비교 분석 및 경제성 평가
Alcohol-to-Jet 및 Gasification 경로별 경제성을 비교·평가한다. Aspen Plus 결과를 기반으로 CAPEX·OPEX를 산정하고, LCA(Life Cycle Assessment)를 통해 에너지 효율, 생산단가, 탄소저감 효과를 종합적으로 분석한다. 이를 통해 각 경로의 상용화 가능성을 검토하고, 효율성과 환경성을 동시에 만족하는 최적의 e-SAF 생산 경로를 제시한다.
◇ 최종 보고서 및 발표자료 준비
각 공정의 시뮬레이션 결과를 시각화하고, 에너지 효율·경제성·탄소저감률 등 주요 지표를 종합 분석한다. 마지막으로 연구성과를 기반으로 향후 e-SAF 공정의 확장 가능성과 산업적 적용성을 제시한다.
목표 달성을 위한 설계 방법
◇ SAF 생산경로 설계
바이오매스-폐플라스틱으로부터 SAF를 생산하는 경로로 두 가지를 제시한다. 두 경로는 모두 가스화 공정으로 합성가스를 만드는 전처리를 거친다. 첫 번째 경로(FT)는 합성가스에서 FT 반응을 통해 파라핀계 탄화수소를 제조한 뒤 분별 및 업그레이딩을 거쳐 SAF를 생산하는 경로이다. 두 번째 경로(ATJ)는 합성가스로부터 알코올을 합성한 후, 탈수–올리고머화–수첨 공정을 거쳐 항공유 범위의 아이소파라핀을 제조하는 경로이다. 첫번째 경우의 경우 이전 창의 연구 보고서에서 자세하게 설명한 바 있으므로 이번 프로젝트 종합설계에서는 두 번째 경로를 위주로 보고서를 작성하겠다.
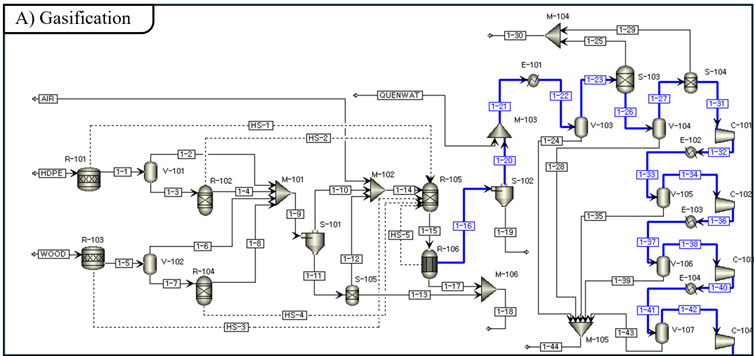
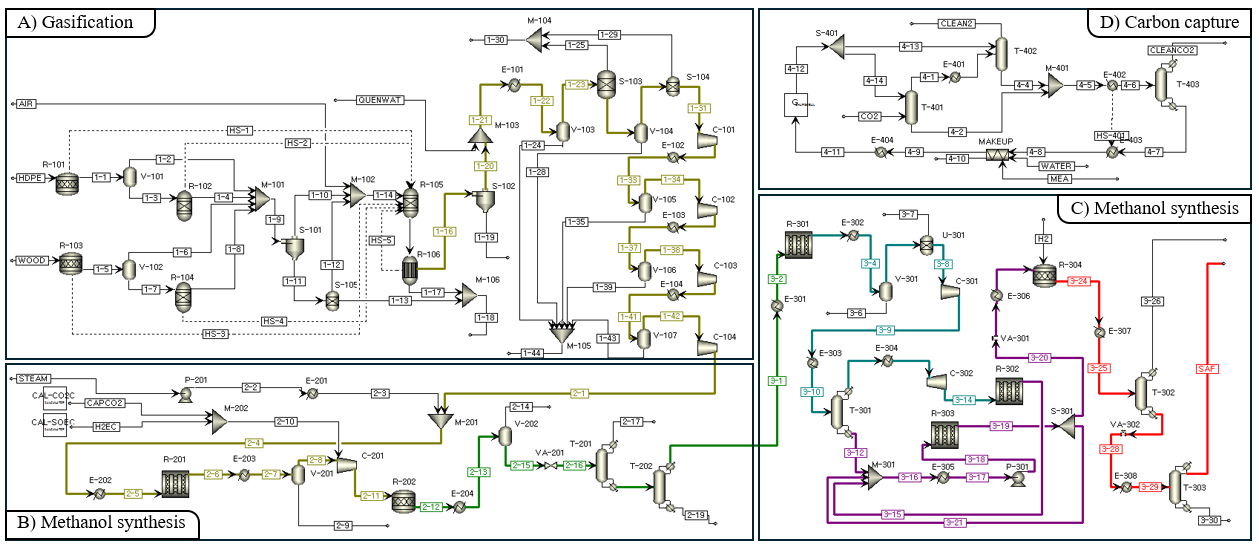
(1) Gasification Modeling
Gasification의 원료는 wood chip과 waste-HDPE를 사용한다. Wood chip은 40 × 40 × 50 mm 크기로 공급되며, waste-HDPE는 병 형태로 제공되어 가스화기에 투입하기 전 전처리가 필요하다 [8], [9]. Aspen Plus에서는 이들 원료를 proximate analysis과 ultimate analysis을 사용하여 다음과 같이 non-conventional 타입으로 모델링 한다.
Gasification은 다음과 같은 가정을 기반으로 설계되었다: 공정의 모든 반응은 평형 상태에 도달한다; char는 탄소만으로 구성된다; ash은 불활성 물질로, 반응에 참여하지 않는다; tar 및 고 탄화수소 생성을 무시한다. Downdraft gasification에서 미반응 char의 yield는 일반적으로 6~10%이므로 [10], 본 설계에서는 대표 값으로 8%를 가정. 고온 가스화 공정에서는 Boston-Mathias 알파 함수가 적용된 Peng-Robinson 상태방정식(PR-BM)을 물성 모델로 사용한다 [11], [12]. 시스템의 엔탈피 계산에는 HCOALGEN 모델을, 밀도 계산에는 DCOALIGT 모델을 적용하였다.
원료는 waste-HDPE와 wood chip의 혼합물로, 2000 tonne/day 공급의 대규모 운전 조건을 가정한다. Waste-HDPE와 wood chip의 비율은 Feed Plastic Content(FPC) 파라미터(eq. 1)에 의해 결정된다.
Fixed-bed gasifier에서는 균일한 충전층을 유지하기 위해 feedstock이 덩어리 형태 또는 chip 형태여야 하며, 대형 입자는 기체 흐름의 불균일이나 막힘을 방지하기 위해 피해야 한다 [13]. wood는 chip 형태로 공급되어 추가 전처리가 필요 없으나 [8], waste-HDPE는 병 형태로 공급되기 때문에 fixed-bed gasifier의 feedstock 요건을 충족하기 위해 전처리 과정을 거쳐야 한다 [9]. 따라서 waste-HDPE는 해머 밀을 사용해 작은 조각으로 파쇄한 후 pelletizer (입자화 장치)를 통해 균일한 크기의 입자로 가공하여 fixed-bed gasifier 내에서 안정적인 기체 흐름을 확보한다 [14].
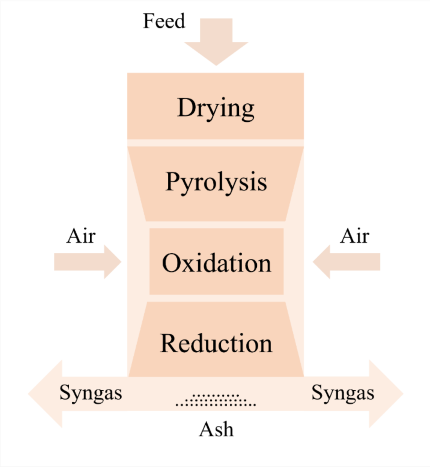
Fig 12는 downdraft gasification 과정을 drying, pyrolysis, oxidation, reduction 네 구역으로 구분하고 있다[15]. drying과 pyrolysis는 별도로 모델링하며, oxidation과 reduction은 gasifier unit에서 동시에 발생한다고 가정한다. 먼저 drying 구역은 RStoic 반응기(GSDRYPW, GSDRYBM)를 사용해 feedstock을 dried feed (DRIED-PW, DRIED-BM)와 moisture (MOIS-PW, MOIS-BM)로 전환하며, 운전 조건은 110 °C, 1 atm으로 설정하였다. 그 다음 pyrolysis 구역은 RYield 반응기(GSPYRPW, GSPYRBM)로 모델링하여 nonconventional feedstock을 C, H₂, O₂, N₂, CO₂, S, ash 등의 conventional 성분으로 분해하며, 운전 조건은 350 °C, 1 atm이다. 이후 RYield 생성물과 drying 구역 수분을 gasifying agent인 공기와 혼합하는데, 공기량은 Equivalence Ratio(ER)에 의해 결정된다 [15]. ER은 eq.2와 같다.
산화 및 환원 구역, 즉 gasification zone은 RGibbs reactor(GSGIBBS) [16]를 사용해 모델링한다. 해당 반응기는 완전 화학 평형 하에서 계 전체의 깁스 자유 에너지를 최소화하는 출구 조성을 산출한다. R1-R8 반응을 고려하며, 운전 압력은 1 atm이다 [17]. 특히 본 공정은 autothermal이므로, gasification zone에서 발생한 열을 drying 및 pyrolysis zone에 공급한다. 이를 위해 GSGIBBS에서 RStoic 및 RYield 반응기로의 열 흐름을 설정하였다. 실제 gasification zone에서 화학 평형이 완전히 도달하지 않는다. 이를 시뮬레이션에서 반영하기 위해 REquil reactor(GSEQUIL)를 사용해 approach temperature를 구현하였다 [17], [18].
Gasification 공정에서 생성된 syngas에는 입자상 물질(particulates), 알칼리 화합물(alkali compounds), 질소 화합물(nitrogen compounds), 황 화합물(sulfur compounds) 등 다양한 오염 물질이 포함되어 있다 [19]. Syngas 정제는 입자상 물질 제거를 위해 cyclone separation을, 알칼리 종 및 입자상 물질 제거를 위해 direct-contact water quenching을, 황 화합물 및 이산화탄소 제거를 위해 acid gas removal을, 추가적인 황 제거를 위해 zinc oxide bed를 이용해 수행하였다 [19], [20], [21].
Cyclone(CLCYCLOEN)은 feedstock 내 무기회분과 가스화 과정에서 생성된 char로 구성된 입자상 물질을 제거한다 [19], [22]. Raw syngas stream(SYNGAS1)는 cyclone을 통과하면서 ash + char stream으로 분리되고, 이어서 direct-contact water quenching을 통해 acid gas removal unit의 운전 온도인 40 °C로 냉각된다 [19]. 이 과정에서 alkali species가 응축 및 제거되어 downstream 장비 손상을 방지한다 [21]. Direct-contact water quenching (CLQUENCH)은 Mixer, Cooler, Flash2 블록을 사용해 모델링 되었으며, quenching water는 syngas 질량 유량의 3배로 공급된다.
Wood chip 내 황 함량으로 인해 gasification 과정에서 생성된 syngas에는 H₂S와 COS 같은 황 화합물이 포함된다 [23]. 이러한 화합물은 steam methane reforming에 사용되는 nickel-alumina와 같은 후단 공정의 catalysts를 비활성화 시킬 수 있으므로 50 ppb 수준으로 제거해야 한다 [24], [25]. acid gas removal 공정을 통해 H₂S 농도를 약 4 ppm까지 저감할 수 있다 [19]. 추가로 zinc oxide bed를 설치해 H₂S를 50 ppb 이하로 더욱 저감한다 [26]. acid gas removal (CLAGR)과 zinc oxide bed (CLZNO) 유닛은 Separator block으로 모델링하였다. LO-CAT process는 acid gas removal unit과 zinc oxide bed 모두에서 나온 H₂S를 처리하는 데 사용된다. 염기성 용액 속의 ferric-EDTA chelate을 이용해 H₂S를 고체 황으로 선택적으로 전환한다 [27]. LO-CAT (CLLOCAT) unit은 Separator block으로 모델링하였다.
가압을 위해 UPCOMP1, UPCOMP2, UPCOMP3, UPCOMP4 네 대의 compressor를 4단계로 사용하여 정제된 syngas의 압력을 1 atm에서 20 atm으로 높인다. Compressor를 네 대를 사용해서 단계별로 가압하는 이유는 interstage cooling 없이 높아진 온도에서 가압을 계속 진행하게 된다면 energy efficiency를 저해하기 때문이다. 각 단계의 압력비는 2.26이며, 각 compressor 전에는 interstage cooler를 통해 가스를 30°C로 냉각한다 [28].
Steam methane reforming (SMR)을 사용하여 CH4를 H2로 전환한다. SMR reactor는 Ni/MgAl2 촉매 하에서 850°C, 30atm으로 운전한다. SMR 반응은 다음과 같다.
Steam methane reforming reaction
Water gas shift reaction
SMR reactor에 LHHW kinetics reaction model [29]을 알고 있으므로 R-Plug reactor(R-401)를 사용해 Packed Bed Reactor(PBR)을 구현했다. 내부는 isothermal로 가정했고, PBR은 pressure drop의 영향이 크기에 Ergun Equation을 이용해 pressure drop을 고려했다. 이때 필요한 촉매의 밀도, 지름, 공극률은 참고문헌에 따라 설정했다 [29].
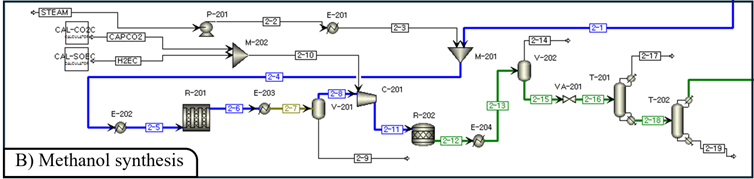
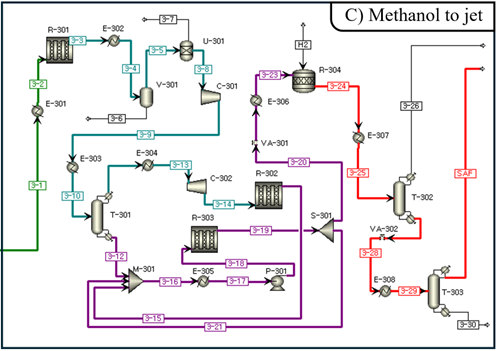
(2) Methanol Synthesis Modeling
ATJ 경로로 SAF를 생산하기 위해 SMR reactor로부터 공급된 합성가스를 반응시켜 메탄올을 얻고자 한다. SMR reaction에서 생성된 mixture의 H2O를 Flash (V-401)로 분리해주고, 남은 합성가스는 MeOH 합성을 위해 50bar로 가압해준다 [35]. Reaction은 250℃에서 이루어지고 생성된 mixture는 100℃로 냉각된다. Methanol reactor에서 일어나는 반응은 다음과 같다.
위 반응의 kinetic reaction[36]을 R-Plug reactor(R-402)에 적용하여 PBR reactor(Cu/ZnO/Al2O3)로 모사했다. 내부는 isothermal 조건으로 운전하고, Ergun Equation을 이용하여 pressure drop을 고려했다. Ergun Equation에 고려되는 촉매의 특성은 다음과 같다.[31]
합성가스에서 메탄올을 합성하는 반응은 열역학적 한계에 의해 single pass 수율이 약 30%로 제한된다. 이를 보완하기 위해 반응하지 않은 off gas를 recycle loop를 통해 다시 활용하여 conversion을 높이고자 한다. Flash를 거친 off gas는 Furnace에 필요한 열량만큼 SPLIT block을 통해 15-2 stream으로 분리된다. 남은 off gas는 recycle loop를 통하여 C-403에 공급된다.
(3) Carbon Capture Unit Modeling
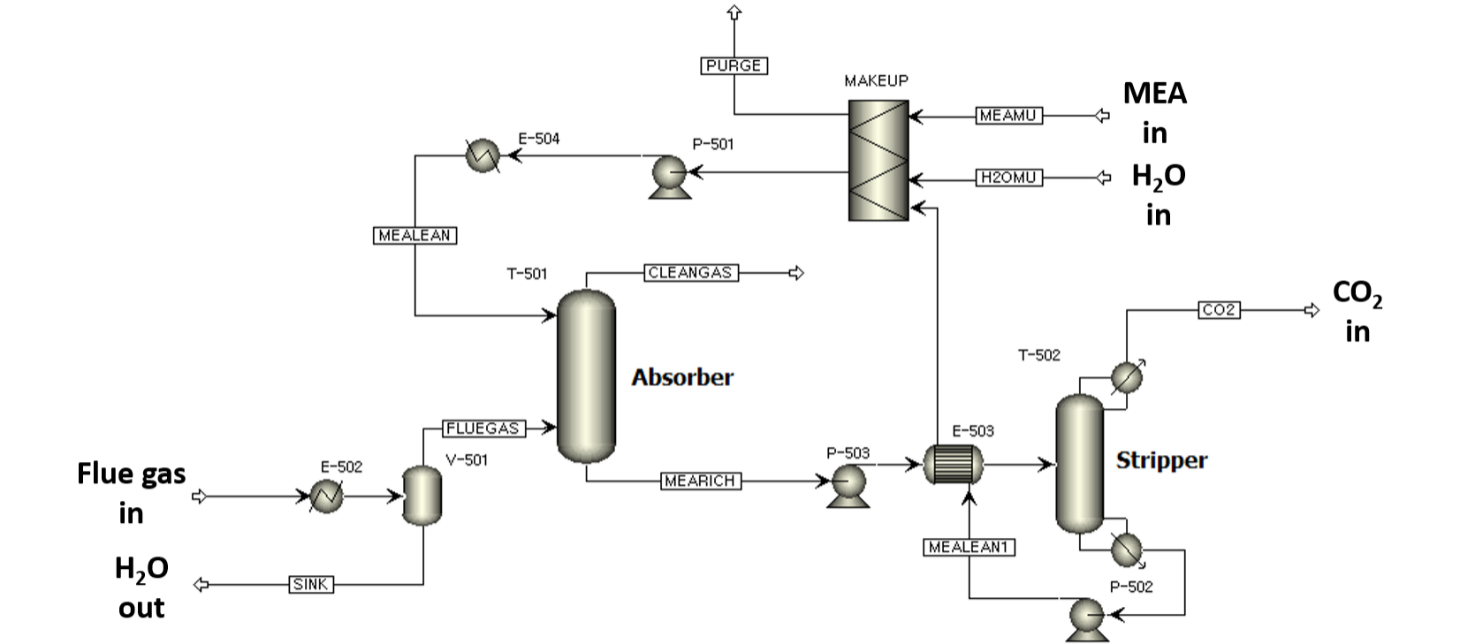
탄소 포집 기술은 화학적 흡수 방식을 사용했으며 용매는 화학흡수 공정에서 일반적으로 사용하는 아민계 수용액 용매인 MEA를 사용했다. MEA는 빠른 반응속도와 우수한 CO₂ 흡수능의 장점이 있고, 이미 산업 전반에 축적되어 대규모 운전이 가능하다. 따라서 본 연구의 Carbon Capture Unit은 MEA 30wt% 용액을 기반으로 하는 흡수 및 재생 탑으로 구성했다. MEA를 이용한 CO₂ 흡수 반응은 다음과 같다.
해당 공정은 전해질이 포함된 공정이기 때문에, 분자 및 이온의 property를 설정하는 과정이 중요하다. 아민 용액에서는 CO2가 단순한 물리 용해로 존재하지 않고, 카바메이트(COO⁻), 바이카보네이트(HCO₃⁻), 프로톤화 아민(RNH₃⁺) 등 다양한 이온종으로 화학반응을 거쳐 존재하기 때문에, 이러한 반응 평형을 정확히 반영하는 전해질 특화 모델(Electrolyte model) 설정이 필수적이다.
이를 위해 Aspen Plus에서는 eNRTL (Electrolyte Non-Random Two Liquid) 모델을 적용하였다. eNRTL은 전해질 시스템에서 나타나는 이온-이온, 이온-분자, 분자-분자 간 상호작용을 고려할 수 있으며, MEA–H₂O–CO₂ 용액에서 발생하는 다중 평형반응(카바메이트 형성, 프로톤화 반응, 수해리 등)을 안정적으로 계산할 수 있다는 장점이 있다. 또한 흡수탑과 재생반응에 존재하는 기–액 2상 평형까지 면밀히 계산할 수 있어, 아민 기반 CO₂ 포집 공정의 대표적 열역학 모델로 널리 사용된다.
본 연구에서는 MEA 용액의 복잡한 반응경로를 정확히 반영하고 흡수·재생 공정의 열수지와 평형 특성을 안정적으로 계산하기 위하여 True Component Approach + e-NRTL + Henry component 설정 조합을 적용하였다.
Absorber는 기체 상태의 CO2 rich gas가 탑의 하단으로 주입되고, MEA 용액이 탑의 최상단으로 주입되어 하단으로 MEACOO- 형태로 CO2가 포집된다. 이때 일어나는 반응은 발열반응이기 때문에 온도가 낮을수록 유리하다. 따라서, Flue gas는 따라서 Flue gas는 40℃로 온도를 낮추어 1.01bar로 absorber에 주입된다. CO2/MEA 비율을 CO2 loading이라고 하고 식은 다음과 같다. [32] Rich Amine solution에서 CO2 loading을 rich amine loading이라고 명명하겠다.
Rich Amine loading의 경우 0.48-0.5mol/mol에서 CO2를 효율적으로 제거하고, 부식을 억제할 수 있다 [33]. Column은 부식성이 있는 물질을 처리할 수 있는 packed type으로 설정했고, absorber와 stripper에 자주 사용되는 Mellapak 250Y 충전재를 사용했다. 1.01bar에서 HETP(Height Equivalent to a Theoretical Plate)는 0.4m이고 stage 당 pressure drop은 0.3-1mbar이기에 중간 값인 0.00065bar로 설정했다 [34].
Stripper에 Rich Amine solution이 주입되면, 열을 가해주어 CO2와 MEA로 다시 분리시킨다. 재생반응은 흡열반응이기 때문에 온도가 높을수록 유리하지만, 130℃ 이상에서 MEA가 분해되기 때문에 적절한 온도조절이 필수적이다. Stripper로 주입하기 전 P-503 pump를 통해 2bar로 가압하는 것은 온도를 높이기 위함이다. Lean Amine loading은 0.15-0.2mol/mol의 범위에서 높은 회수율을 나타낸다 [33]. Tray type과 충전재는 absorber와 같은 packed type과 Mellapak 250Y를 사용했다. 탑 상부로 회수되는 CO2의 양은 주입되는 CO2의 양과 동일하게 설정하고, Reboiler duty를 조절하여 탄소 포집 효율을 조사한다.
탄소 포집 loop에서 CLEANGA와 CO2 stream으로 MEA 용액 일부가 손실된다. 이를 초기 조건과 동일하게 유지하기 위해 MAKEUP block으로 손실된 MEA와 H2O를 보충한다.
(4) Methanol to Olefin
MTO (Methanol-to-Olefins) 반응은 ATJ 경로에서 메탄올을 경질 올레핀(C₂~C₅)으로 전환하는 단계에 해당한다. SAPO-34 촉매 기반의 MTO 반응은 탈수, 탄소풀(carbon-pool) 형성, 중간체 균열 및 연속적인 올레핀 생성이 동시에 일어나는 복잡한 반응 네트워크를 포함하지만, 산업 공정 수준의 모델링에서는 lumped-kinetic 접근이 일반적으로 사용된다. 본 과제에서는 SAPO-34 촉매에 대해 기존 문헌에 제시한 lumped kinetic 모델을 채택하여 반응을 단순화하였다. 이 모델은 MeOH·DME·경질 올레핀·부생가스(CH₄, C₂H₆, CO, CO₂, H₂)를 각각 하나의 lump로 취급하며, MeOH 탈수, DME 균열, 올레핀 생성, 부생가스 생성, 수소첨가 및 WGS 반응을 중심으로 구성되어 있다. 개별 이성질체 반응 및 방향족 생성은 촉매의 구조적 특성 및 운전 온도(673–723 K)에서 일어날 확률이 낮기 때문에 모델링에서 제거하였다. 최종적으로 사용한 반응 속도 식은 다음과 같다.
본 과제에서는 이러한 lumped-kinetic 네트워크를 Aspen Plus의 R-Plug 반응기(PFR)로 구현하였다. 반응 속도는 Arrhenius 식 기반의 power-law 형태로 정의되며, 문헌에 나와 있는 pre-exponential factor와 활성화에너지를 그대로 적용하였다. 각 반응은 MeOH, DME, 올레핀 농도의 함수로 표현되며, Aspen에서 catalyst-weight 기준의 kinetic expression으로 입력하였다. MTO 반응은 복잡한 실제 표면 메커니즘을 단순화한 공정-기반 kinetic model로 표현하였으며, Aspen Plus에서 R-Plug 반응기를 통해 구현함으로써 촉매층 내 농도 변화, 전환율, 생성물 분율을 정량적으로 모델링하였다.
(5) Oligomerization & Hydrogenation
MTO를 통해서 생성된 경질 올레핀을 항공유 범위의 탄화 수소로 전환하기 위해 올리고머화와 수소첨가 공정을 설계하였다. 본 공정의 올리고머화 반응은 탄소수(Cₙ)에 따라 서로 다른 방법으로 모델링하였다. 경질 올레핀을 C₂와 C₃ 이상 영역으로 증류하여 분리한 뒤 각각 올리고머화를 진행하였다. C₂ 영역과 C₃ 이상 영역 모두 실험 기반 kinetic model을 이용하여 R-Plug 반응기로 표현하였고, Hydrogenation 단계는 문헌에서 보고된 고정 전환율을 기반으로 R-Stoic 반응기로 구현했다 [37].
(5-1) C₂ 구간: Kinetic 기반 올리고머화 반응 모델링 에틸렌(C₂) 영역에서의 올리고머화 반응은 에틸렌이 Ni–H–Beta 촉매 위에서 C4, C6, C8의 보다 긴 탄소수의 올레핀으로 전환이 되는 단계이다. 본 연구에서는 문헌에서 제시된 미세반응속도론(micro-kinetic) 모델을 기반으로 Aspen Plus R-Plug 반응기를 구성하였다. 해당 문헌은 Ni–H–Beta에서 에틸렌이 비교적 온화한 조건(323–373 K, 5–28 atm)에서 C₄–C₈ 범위의 올레핀으로 전환된다. 실제 반응에서는 분지화, 다양한 이성질체, 극히 미세한 정도의 방향족화가 모두 발생할 수 있지만, 문헌에서는 이러한 현상이 탄소수 분포 자체에는 큰 영향을 주지 않는다는 점을 근거로 lumped Cₙ 종 안에 포함하여 처리한다. 본 연구에서도 이 접근을 그대로 적용하였다. 또한, 문헌에서 제시한 온도 범위 내에서는 방향족화가 거의 관찰되지 않아 모델에서 제외하였다. 본 과제에서 사용한 반응속도식은 Langmuir–Hinshelwood 형태의 모델이며 다음과 같이 정의된다.
문헌에서는 각 반응의 activation energy(Ea)는 별도로 나와 있으며, 본 과제에서는 이를 Arrhenius 식으로 변환하여 공정 시뮬레이션 프로그램에 입력하였다. k=k_0 exp(-E_a/RT) 전체적으로 본 모델은 문헌에서 제시된 반응상수와 평형상수를 기반으로 구성된 3개의 반응속도 식을 사용하며 해당 상수 값들은 문헌에 제시된 값들을 사용하여 아스펜의 R-Plug 반응기를 통해 해당 공정을 구현하였다.
(5-2) C₃ 이상 구간: Kinetic 기반 올리고머화 및 크래킹 반응 모델링 ATJ 경로에서는 MeOH 공정에서 유래한 C₃ 이상 올레핀 혼합물을 산 촉매 하에서 올리고머화하여 C₈–C₁₆ 범위의 탄화수소를 생성한 뒤, 후단 수소첨가 반응을 통해 SAF로 사용 가능한 파라핀으로 전환한다. Kinetic modeling 단계에서는 실제 반응에서 발생하는 모든 이성질체와 방향족화를 직접 추적하는 것은 비현실적이라고 판단하였다. 따라서 다음과 같은 단순화 가정을 두었다. Isomerization: 분지화 및 이성질체 생성은 매우 다양하지만, 탄소수 분포(Cₙ)의 변화에는 제한적인 영향을 미친다고 보고 명시적으로 모델링하지 않고 lumped Cₙ 종 안에 포함시켰다. Aromatization: 사용 온도 범위(423–573 K)에서는 방향족화가 미미하다는 보고에 따라 무시하였다. 따라서 모델에는 올리고머화(oligomerization)와 크래킹(cracking) 두 반응만 포함되며, 두 반응이 동시에 일어나는 반응 네트워크로 취급하였다. Aspen Plus의 R-Plug 반응기에서 PFR 방식으로 구현하였다. 반응물의 몰 유량 변화는 다음과 같은 관계식을 따른다.
올리고머화 속도식과 크래킹 속도식은은 다음과 같다.
각 반응의 속도상수는 Arrhenius 식을 기반으로 계산하며, 탄소수에 따라 다음과 같이 정의하였다.
Pre-exponential factor는 탄소수 종속성을 고려하여 아래와 같이 설정하였다.
각 탄소수 lump(Cₙ)의 농도 변화는 다음 식을 사용하여 계산하였다.
크래킹 시 생성물 분포는 아래 식으로 정의하였다.
해당 모델은 Eₐo, Eac, Xₒ, Xc, expo, expc, Xₐ의 총 7개 파라미터를 사용하며, Python으로 계산한 ka와 kc 값을 R-Plug 반응기에 입력하여 C₃~C₂₄ 범위에 대해 반응을 구현하였다. R-Plug는 축 방향으로 반응 및 조성이 연속적으로 변화하는 플러그 플로우(Plug Flow) 형태의 반응기를 모사하는 모델로, 각 미소 촉매 질량에 대해 물질수지식을 직접 적분하여 농도 변화를 계산한다. 본 연구에서 사용한 kinetic model은 dC/dW 형태의 PFR 기반 미분식으로 구성되어 있어, 반응속도 상수와 농도 변화를 연속적으로 계산할 수 있는 R-Plug 모델이 적합하다. 이를 통해 올리고머화와 크래킹이 동시에 진행되는 C₃ 이상 영역에서의 반응 거동을 정확하게 재현하였다. [38]
(5-3) Hydrogenation: 고정 전환율 기반 수소첨가 반응 모델링
Hydrogenation 구간은 제시된 olefin hydrogenation 및 heavy paraffin 분해반응의 전환율을 그대로 사용하여 R-Stoic 반응기로 구성하였다. 본 단계에서는 올리고머화 반응기 출구에서 생성된 올레핀을 포화시키고, 일부 중질 탄화수소는 경질화하여 SAF 범위 품질을 확보하도록 모델링하였다.
Olefin hydrogenation 반응은 다음과 같으며, 모든 탄소수에 대해 0.9의 전환율을 적용하였다.
Heavy paraffin에 대해서는 산화분해 및 수소첨가 반응을 1.0 전환율로 적용하였다.
해당 단계는 kinetics를 사용하지 않고 문헌에 제시된 화학량론과 전환율을 그대로 반영하여 구현하였다. 이를 통해 올리고머화 단계에서 생성된 탄소수 분포를 유지하면서 최종적으로 SAF 규격에 적합한 파라핀으로 전환되도록 설계하였다. [37]
각 탄소수에 대한 계산을 파이썬으로 수행한 후 Aspen에 넣을 수 있도록 power 형태로 변환해 설계를 진행한다.
(6) Distillation
메탄올 기반 공정에서 생성되는 최종 액상 탄화수소는 광범위한 탄소수 분포를 포함하지만 SAF 범위(C₈~C₁₆)는 이 넓은 분포 중 일부에 해당하므로, 최종 제품으로 사용하기 위해서는 후단 분리 공정을 통해 원하는 범위의 파라핀을 선택적으로 회수해야 한다. 증류는 탑 상부와 하부의 온도 차이를 이용해 성분을 비점 기준으로 분리한다. 상부에는 경질 유분(naphtha, LPG 등), 하부에는 중질·중유 성분이 집적되며, 목표 유분 범위는 타워 내 적절한 트레이 번호에서 side draw 또는 bottom product로 회수한다. 또한 높은 순도와 수율을 확보하기 위해 reflux ratio(환류비), boil-up rate(재보일 증기량), 압력 조건을 조절하여 운전한다. 이러한 공정은 FT 기반 제품의 경우에도 동일하게 적용되며, 최종적으로 SAF(등유)에 해당하는 C₈~C₁₆ 구간을 높은 선택도로 회수하는 것을 목표로 한다.
◇ Techno Economic Analysis
① Levelized Cost of Sustainable Aviation Fuel (LCoF)
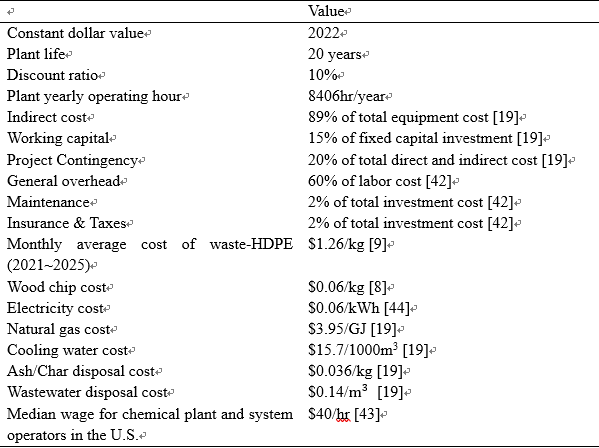
Techno-Economic Analysis (TEA)를 수행하여 LCoF ($/kg)를 추정하였다. LCoF는 eq. 4을 통해 계산되었다[41]. Net Present Value(NPV)는 미래 연료 생산량을 현재 가치로 환산한 총합이며, 매해 연료 생산량을 할인율 r을 적용하여 eq. 5를 통해 계산하였다. TEA에 사용된 주요 가정은 다음과 같다: 2022년 달러 가치 고정, 20년의 플랜트 수명, 6%의 할인율, 연간 8,406시간의 운전 시간. TEA에 사용된 다른 주요 매개변수 및 가정은 Table 3에 요약되어 있다.
② TEA results
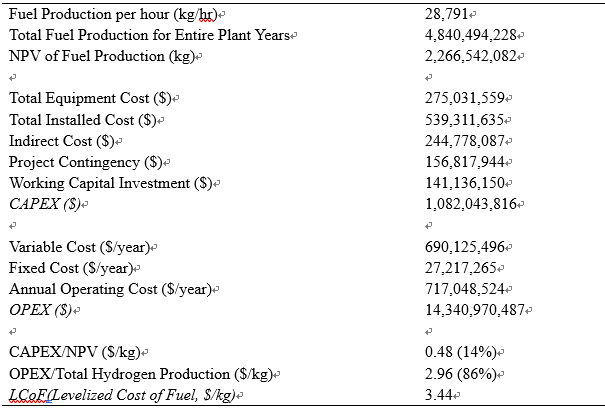
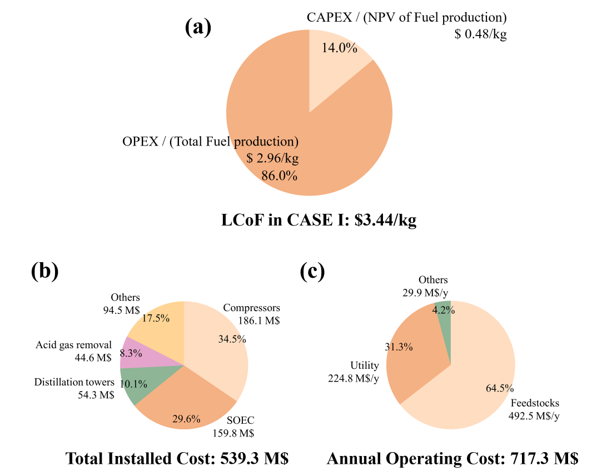
Fig 17.은 (a) LCoF의 자본 비용과 운전 비용에 대한 기여도; (b) 총 설치 비용 (Total Installed Cost); (c)는 연간 평균 운전 비용(Annual Operating Cost)을 나타낸다. Case I (ER=0.36, FPC=50%)에서 LCoF는 $3.44/kg이었다. 이는 SAF 1kg을 생산하는데 3.66$가 소요된다는 결과이다. 여기서 자본비용은 $0.48/kg (14%), 운전 비용은 $2.96/kg (86%)를 차지한다. 운전비용이 자본비용보다 약 6배정도 많다. (Fig 17a) 이는 SOEC와 CO2 RR에서 사용하는 막대한 전기 양에 따른 결과이다. 자본비용에서 Compressors(186.1 M$, 34.5%)가 가장 큰 비중을 차지하며, 그 다음으로는 SOEC (159.8 M$, 29.6%), Other (94.5 M$, 17.5%), Distillation towers (54.3 M$, 13.3%), Acid gas removal (44.6 M$, 8.8%) 순이다 (Fig 17b). 운영비용에서는 Feedstocks (492.5 M$/y, 64.5%)이 가장 높은 비중을 차지했고, 그 다음으로는 Utility (224.8 M$/y, 31.3%) 순이다. (Fig 17c).
개발 과제 핵심 결과
◇ Methanol synthesis
Methanol synthesis에서 feed의 비율인 Stoichiometric Number (SN, (y_(H_2 )-y_(〖CO〗_2 ))/(y_(CO_2 )+y_CO )) = 2는 최적의 메탄올 생산을 위한 조건이다 [Kiss, Anton A., et al. "Novel efficient process for methanol synthesis by CO2 hydrogenation." Chemical engineering journal 284 (2016): 260-269.]. 따라서 본 공정에서는 이를 만족시키기 위해서 부족한 H2는 SOEC를 통해서 공급하고, 부족한 CO¬2는 CCUS 공정에서 Captured CO2를 이용할 것이다.
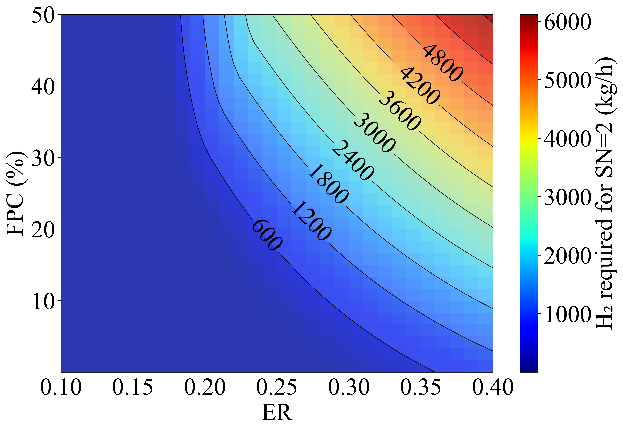
ER과 FPC에 따라서 새롭게 공급해야 할 주체와 (H2, CO2) 그 양이 바뀌게 된다.
Figure 18과 19는 SN=2를 만족시키기 위해서 필요한 H2와 CO2의 양을 나타낸 것이다. ER과 FPC가 낮은 구간에서는 SN>2인 상황으로 CO2가 더 공급되어야 하고, ER과 FPC가 높은 구간에서는 SN<2인 상황으로 H2가 더 공급되어야 한다.
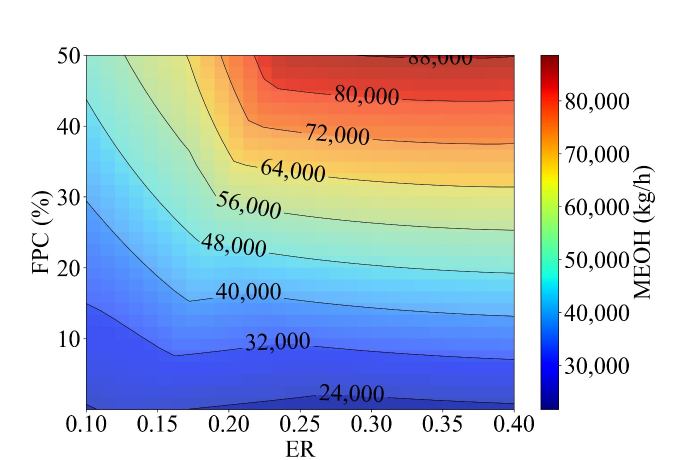
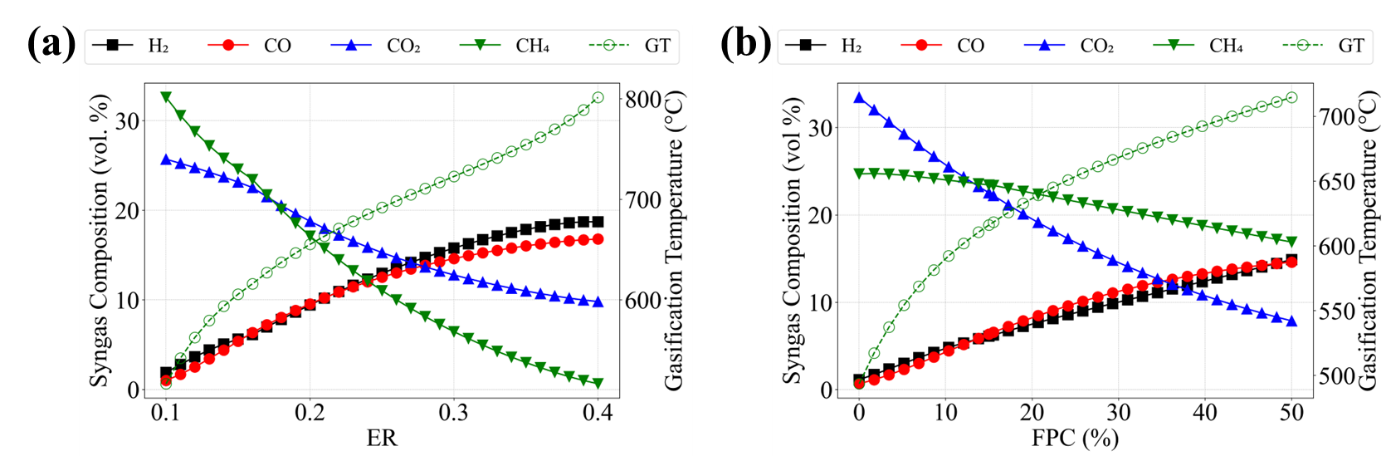
Figure 20은 ER과 FPC에 따른 MeOH 생산량이다. ER과 FPC가 높아질수록 MEOH 생산량은 높아지고, ER과 FPC가 낮아질수록 MeOH 생산량은 낮아진다. Figure 21 (a)에서 확인할 수 있듯이, ER이 높아질수록 gasification에서 투입되는 산소량이 많아지고, 이는 gasification temperature의 상승을 야기한다. 이로 인해 gasification reaction은 H2와 CO의 vol. %가 증가하는 방향으로 평형이 이동한다. 따라서 H2와 CO를 원료로 하는 MeOH 생산량도 늘어나게 된다. Figure 21 (b)에서도 마찬가지로 FPC가 높아질수록 플라스틱 함량이 높아져 gasification temperature가 상승하고, 이는 syngas에서 H2와 CO vol. % 증가를 야기한다. 따라서 MeOH 생산량은 FPC 증가에 따라 함께 증가하게 된다.
◇ CASE study
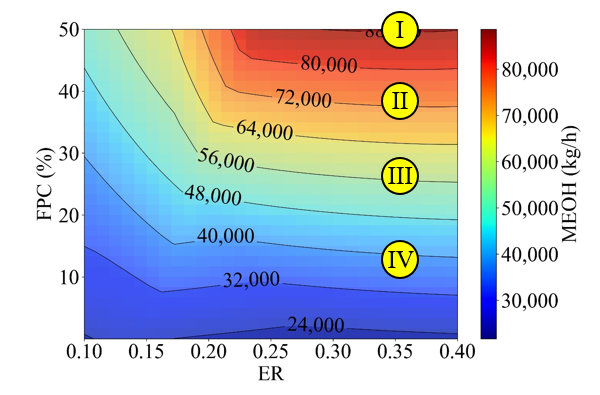
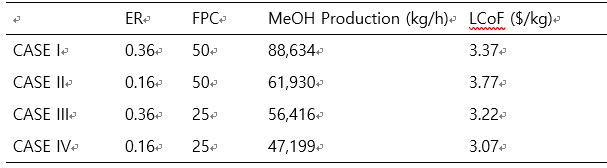
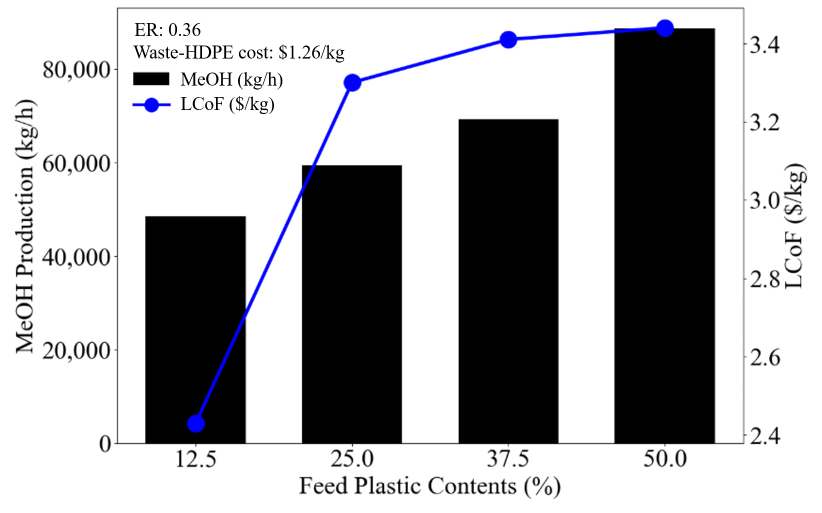
MeOH 생산량과 SAF 생산량은 비례하므로, MeOH 생산 조건에 따른 CASE study를 진행해보려고 한다. FPC 범위에 따라서 4개의 CASE로 분류하였다. CASE I은 MeOH 생산량이 최대 (88,643 kg/h)가 되는 지점으로, ER은 0.36, FPC는 50%의 값을 가지고 있다. CASE II는 CASEI과 같은 ER인 지점에서 FPC가 37.5%인 경우이다. 이 때 MeOH 생산량은 69,183 kg/h이다. CASE III와 IV는 FPC가 각각 25, 12.5로 MeOH 생산량은 59,337 kg/h, 48,493 kg/h이다.
CASE I, CASE II, CASE III, CASE IV순으로 MeOH 생산량이 커진다. 하지만 경제성은 MeOH 생산량이 가장 큰 CASE I이 아닌, CASE IV가 가장 저렴한 것으로 나타났다. 이는 waste-HDPE의 비싼 가격으로 인한 결과이다. Feed인 waste-HDPE의 가격에 따른 분석은 다음 파트에서 다루도록 하겠다.
◇ Effect of Waste-HDPE price
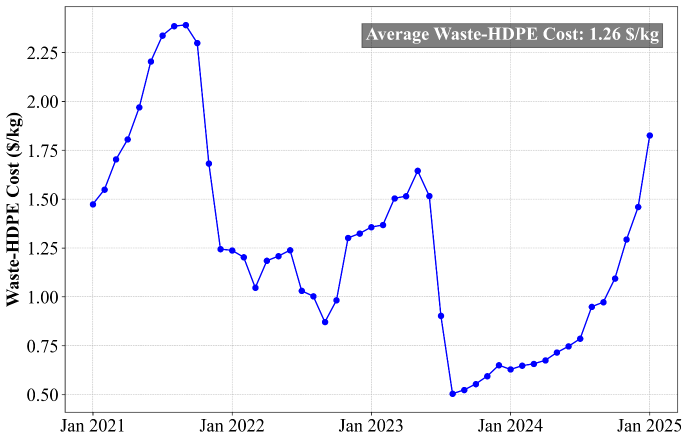
Waste-HDPE의 공급가는 시간에 따라서 매우 민감하게 변한다. 기존 공정에서는 21년 1월부터 25년 1월까지의 평균 값인 $1.26/kg을 사용하였다. Waste-HDPE cost는 $1.26/kg으로 wood chip ($/0.06/kg) 보다 약 21배 비싸다. 이는 FPC가 올라갈수록, 즉 플라스틱 비율이 올라갈수록 operating cost가 올라갈 수 있다는 뜻이다. 따라서 본 공정은 FPC에 따라서 경제성이 굉장히 크게 변동되고, Waste-HDPE의 가격에 따른 민감도 분석이 필수적이다.
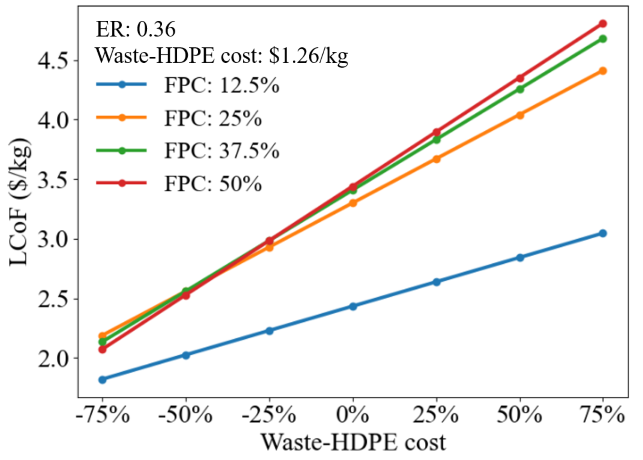
Figure 25는 Waste-HDPE cost의 민감도 분석 그래프이다. Waste-HDPE cost이 변동함에 따라서 FPC에 따른 LCoF는 어떻게 변화하는지 확인해보았다. FPC가 50, 37.5, 25일 때는 waste-HDPE cost가 -37%인 지점 ($0.8/kg)일 때 역전되기 시작한다. 즉 기존에는 플라스틱을 많이 섞을수록 경제성이 좋아지지 않았지만, waste-HDPE cost가 저렴해지면 플라스틱을 원료에 섞을수록 경제성이 좋아지는 모습을 보인다. 하지만 FPC가 12.5%일 때가 waste-HDPE cost에 상관없이 계속 경제성이 가장 좋다는 것을 확인할 수 있다. 기존 FPC를 많이 섞으면 좋았던 이유는 플라스틱의 높은 C와 H함량이었다. 하지만 본 공정에서 바이오매스이 부족한 C와 H 함량은 외부의 SOEC나 Captured CO2로 인하여 충분히 보충될 수 있다. 이 차이가 FPC와 경제성의 반비례를 야기한다.
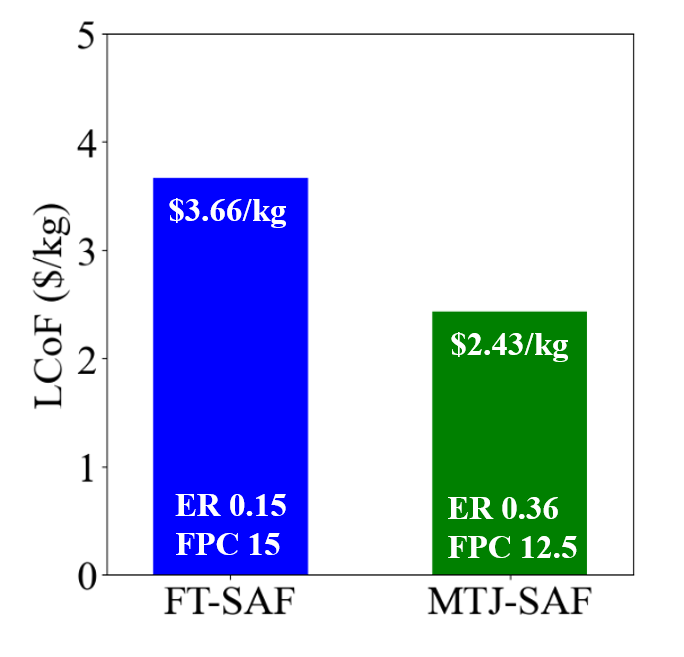
Figure 26은 FT-SAF 경로와 MTJ-SAF 경로의 경제성을 비교한 그래프이다. 두 지점 모두 경제성이 가장 좋아지는 지점 (ER, FPC)에서 LCoF를 도출하였다. FT-SAF는 MTJ-SAF보다 50.6% 비싸다는 것을 확인할 수 있었다. FT에서는 포집한 CO2를 CO2 RR 공정을 통해 추가적인 전기를 사용해서 FT 공정의 H2/CO = 2.1의 양론비를 맞춘다. 하지만 MTJ공정에서는 메탄올 합성의 SN=2를 맞추기 위해 포집한 CO2를 그대로 넣기 때문에 추가적인 전기 및 설비 비용이 들지 않아서 더 저렴하다.
즉 FT-SAF와 MTJ-SAF의 가장 큰 차이점은 추가적인 자원의 유무이다. MTJ-SAF 경로의 장점은 메탄올 합성 과정에서 포집한 CO2를 그대로 쓸 수 있다는 것이다. FT-SAF도 이를 사용하지만, CO¬2를 CO로 만드는 과정에서 막대한 양의 전기가 사용되기 때문에 경제성에 부정적인 영향을 미치게 된다.
개발 과제 평가
개발 과제 관련 향후 전망
본 과제를 통해 ER과 FPC가 syngas 조성, MeOH 생산성, 그리고 경제성에 결정적 영향을 미친다는 점이 확인되었으며, 이는 향후 상업 공정 설계에서 중요한 방향성을 제시한다. 향후 전망은 다음과 같이 정리할 수 있다. 첫째, ER–FPC 기반 조성 제어 전략의 고도화가 필요하다. 본 공정은 SN 조건 충족을 위해 외부 H₂와 CO₂ 보정이 필수적이므로, 향후에는 ER–FPC 변화에 따른 syngas 품질 예측 모델과 SN 제어 알고리즘을 통합한 운영 전략이 요구된다. 이를 통해 MeOH 생산량의 안정성뿐 아니라 유틸리티 사용량 최적화도 가능할 것이다. 둘째, 폐플라스틱(FPC) 가격 변동성 대응 전략이 공정 경쟁력의 핵심이 될 전망이다. 원료비가 경제성을 크게 좌우하는 구조이므로, 향후 상업화에서는 저가 폐플라스틱 확보, 장기 공급계약, 공공 재활용 인프라와의 연계 등 비용 안정화 방안이 필수적이다. 또한 원료 단가가 크게 변할 수 있는 시장 특성을 고려해, ER–FPC 조합에 대한 실시간 경제성 평가 시스템의 필요성이 커질 것으로 보인다. 셋째, MTJ-SAF 경로의 비용 경쟁력이 장기적으로 더욱 부각될 가능성이 크다. FT 경로 대비 전력·설비 부담이 적고 CO₂ 활용성이 높아, 재생에너지 기반 H₂·CO₂ 공급 체계가 확장되는 국가·지역에서는 MTJ 공정의 상업적 우위가 더욱 강화될 것이다. 넷째, CCUS 및 SOEC 인프라와의 연계가 본 공정의 확장성을 결정짓는 요소가 될 것이다. SN=2 유지를 위한 H₂·CO₂ 보정은 외부 공급 인프라와 직접적으로 연결되므로, 향후에는 CO₂ 포집 시설, SOEC 기반 수소 생산, 재생에너지 전력 공급과의 통합 모델링이 필수적이다. 이러한 기술 및 인프라가 성숙할수록 본 공정의 전체 비용 구조는 크게 개선될 것으로 예상된다. 마지막으로, 본 공정은 원료 조합이 유연하고 탄소중립 정책과 정합성이 높아 장기적 에너지 전환 전략에 적합하다. 다양한 FPC·ER 조건을 수용할 수 있는 구조는 지역별 폐기물 구성, 바이오매스 공급량, 재생에너지 전력단가 등에 맞춰 공정을 최적화할 수 있는 장점을 제공한다. 이는 향후 SAF 공급망 구축과 국가 단위 탄소중립 전략에 직접적인 기여 가능성을 시사한다. 종합하면, 본 연구에서 구축된 ER–FPC 기반 설계 접근법, SN 제어의 중요성, 원료 가격 민감성, 그리고 FT 대비 MTJ 경로의 우수성은 향후 실제 상업 공정 설계와 정책적 의사결정에 중요한 참고자료로 활용될 것으로 판단된다.
참고문헌
1. Fuchs, Constantin, Ulrich Arnold, and Jörg Sauer. "Synthesis of sustainable aviation fuels via (co–) oligomerization of light olefins." Fuel 382 (2025): 133680.
2. Fuchs, Constantin, Ulrich Arnold, and Jörg Sauer. "(Co‐) Oligomerization of Olefins to Hydrocarbon Fuels: Influence of Feed Composition and Pressure." Chemie Ingenieur Technik 95.5 (2023): 651-657.
3. Dubray, Florent J., Vladimir Paunovic, and Jeroen A. van Bokhoven. "Optimization of Sustainable Aviation Fuel Production through Experiment-Driven Modeling of Acid-Catalyzed Oligomerization." ACS Sustainable Chemistry & Engineering 12.48 (2024): 17590-17599.
4. Xie, Ying, et al. "Pilot test and process modification of CO2 chemical absorption for top gas recycling-oxygen blast furnace." Separation and Purification Technology (2025): 133148.
5. SPIETZ, Tomasz, et al. "Technological modifications in pilot research on CO.“
6. Oh, Se-Young, Seokwon Yun, and Jin-Kuk Kim. "Process integration and design for maximizing energy efficiency of a coal-fired power plant integrated with amine-based CO2 capture process." Applied Energy 216 (2018): 311-322.
7. Li, Tianci, et al. "Comparative desorption energy consumption of post-combustion CO2 capture integrated with mechanical vapor recompression technology." Separation and Purification Technology 294 (2022): 121202.
8. Nyserda, “Process Development for Low-Moisture Content Wood Chips Final Report,” 2016.
9. I. Energy Agency, “Towards hydrogen definitions based on their emissions intensity.” [Online]. Available: www.iea.org
10. K. Sandeep and S. Dasappa, “Oxy-steam gasification of biomass for hydrogen rich syngas production using downdraft reactor configuration,” Int J Energy Res, vol. 38, no. 2, pp. 174–188, Feb. 2014, doi: 10.1002/er.3019.
11. W. Doherty, A. Reynolds, D. Kennedy, W. Doherty, A. Reynolds, and D. Kennedy, “Aspen Plus Simulation of Biomass Gasification in a Steam Blown Aspen Plus Simulation of Biomass Gasification in a Steam Blown Dual Fluidised Bed Dual Fluidised Bed Recommended Citation Recommended Citation Aspen plus simulation of biomass gasification in a steam blown dual fluidised bed.” [Online]. Available: https://arrow.tudublin.ie/engmecbk
12. M. Formica, S. Frigo, and R. Gabbrielli, “Development of a new steady state zero-dimensional simulation model for woody biomass gasification in a full scale plant,” Energy Convers Manag, vol. 120, pp. 358–369, Jul. 2016, doi: 10.1016/j.enconman.2016.05.009.
13. World Bioenergy Association, “Gasification of Biomass,” Jun. 2015.
14. “Analysis, Synthesis, and Design of Chemical Processes, Fifth Edition.”
15. Prabir. Basu, Biomass gasification and pyrolysis : practical design and theory. Academic Press, 2010.
16. S. Begum, M. G. Rasul, D. Akbar, and N. Ramzan, “Performance analysis of an integrated fixed bed gasifier model for different biomass feedstocks,” Energies (Basel), vol. 6, no. 12, pp. 6508–6524, Dec. 2013, doi: 10.3390/en6126508.
17. N. Ranjan, N. Yadav, H. Singh, S. Kumar, and S. M. Mahajani, “Modelling and simulation of autothermal downdraft co-gasification of biomass and plastic wastes using Aspen Plus,” Energy Convers Manag, vol. 297, Dec. 2023, doi: 10.1016/j.enconman.2023.117714. 18. M. Fernandez-Lopez, J. Pedroche, J. L. Valverde, and L. Sanchez-Silva, “Simulation of the gasification of animal wastes in a dual gasifier using Aspen Plus®,” Energy Convers Manag, vol. 140, pp. 211–217, 2017, doi: 10.1016/j.enconman.2017.03.008.
19. R. M. Swanson, J. A. Satrio, R. C. Brown, A. Platon, and D. D. Hsu, “Techno-Economic Analysis of Biofuels Production Based on Gasification,” 2010. [Online]. Available: http://www.osti.gov/bridge
20. P. Spath, A. Aden, T. Eggeman, M. Ringer, B. Wallace, and J. Jechura, “Biomass to Hydrogen Production Detailed Design and Economics Utilizing the Battelle Columbus Laboratory Indirectly-Heated Gasifier,” 2005. [Online]. Available: http://www.osti.gov/bridge
21. K. R. Craig and M. K. Mann, “Cost and Performance Analysis of Biomass-Based Integrated Gasification Combined-Cycle (BIGCC) Power Systems.” [Online]. Available: http://www.doe.gov/bridge/home.html
22. D. J. Stevens, “Hot Gas Conditioning: Recent Progress With Larger-Scale Biomass Gasification Systems; Update and Summary of Recent Progress,” 2001. [Online]. Available: http://www.doe.gov/bridge
23. P. Mondal, G. S. Dang, and M. O. Garg, “Syngas production through gasification and cleanup for downstream applications - Recent developments,” 2011, Elsevier B.V. doi: 10.1016/j.fuproc.2011.03.021.
24. P. Spath, A. Aden, T. Eggeman, M. Ringer, B. Wallace, and J. Jechura, “Biomass to Hydrogen Production Detailed Design and Economics Utilizing the Battelle Columbus Laboratory Indirectly-Heated Gasifier,” 2005. [Online]. Available: http://www.osti.gov/bridge
25. U. Izquierdo et al., “Catalyst deactivation and regeneration processes in biogas tri-reforming process. The effect of hydrogen sulfide addition,” Catalysts, vol. 8, no. 1, Jan. 2018, doi: 10.3390/catal8010012.
26. N. Inc and S. Francisco, “Equipment Design and Cost Estimation for Small Modular Biomass Systems, Synthesis Gas Cleanup, and Oxygen Separation Equipment; Task 2: Gas Cleanup Design and Cost Estimates -- Wood Feedstock,” 2006. [Online]. Available: http://www.osti.gov/bridge
27. A. E. Martell, R. J. Motekaitis, D. Chen, R. D. Hancock, and D. Mcmanus, “Selection of new Fe(lll)/Fe(ll) chelating agents as catalysts for the oxidation of hydrogen sulfide to sulfur by air.”
28. W. L. Luyben, “Capital cost of compressors for conceptual design,” Chemical Engineering and Processing - Process Intensification, vol. 126, pp. 206–209, Apr. 2018, doi: 10.1016/j.cep.2018.01.020.
29. Xu, Jianguo, and Gilbert F. Froment. "Methane steam reforming, methanation and water‐gas shift: I. Intrinsic kinetics." AIChE journal 35.1 (1989): 88-96.
30. D. F. Rodríguez Vallejo and A. De Klerk, “Improving the interface between Fischer-Tropsch synthesis and refining,” Energy and Fuels, vol. 27, no. 6, pp. 3137–3147, Jun. 2013, doi: 10.1021/ef400560z.
31. Matzen, Michael, Mahdi Alhajji, and Yaşar Demirel. "Chemical storage of wind energy by renewable methanol production: Feasibility analysis using a multi-criteria decision matrix." Energy 93 (2015): 343-353.
32. 이웅, et al. "모노에탄올아민 (MEA)을 이용한 이산화탄소 포집공정: 배가스 분할 유입을 통한 흡수제 재생 에너지 절감 연구." 화학공학 49.6 (2011): 764-768.
33. Hjelmaas, Silje, et al. "Results from MEA amine plant corrosion processes at the CO2 Technology Centre Mongstad." Energy Procedia 114 (2017): 1166-1178.
34. Chemtech, Sulzer. "Structured packings for distillation, absorption and reactive distillation." Sulzer Chemtech Ltd, Winterthur (2010).
35. Matzen, Michael, Mahdi Alhajji, and Yaşar Demirel. "Chemical storage of wind energy by renewable methanol production: Feasibility analysis using a multi-criteria decision matrix." Energy 93 (2015): 343-353.
36. 宋维端, et al. "KINETICS OF METHANOL SYNTHESIS IN THE PRESENCE OF C301 Cu-BASED CATALYST (Ⅰ) INTRINSIC AND GLOBAL KINETICS." 中国化学工程学报: 英文版 2 (1989): 248-257.
37. Atsonios et al., Process analysis and comparative assessment of advanced thermochemical pathways for e-kerosene production, Energy, 2023.
38. Dubray et al., Kinetic modeling of olefin oligomerization over solid acid catalysts, ACS Sustainable Chemistry & Engineering, 2024.
39. P. P. Shah, G. C. Sturtevant, J. H. Gregor, M. Humbach, F. Padrta, and K. Steigleder, "Fischer-Tropsch Wax Characterization and Upgrading: Final Report," Jun. 1988.
40. P. García-Bacaicoa, J. F. Mastral, J. Ceamanos, C. Berrueco, and S. Serrano, “Gasification of biomass/high density polyethylene mixtures in a downdraft gasifier,” Bioresour Technol, vol. 99, no. 13, pp. 5485–5491, Sep. 2008, doi: 10.1016/j.biortech.2007.11.003.
41. “Levelised Cost of Hydrogen (LCOH) Calculator Manual,” 2024. [Online]. Available: https://observatory.clean-
42. A. Aden et al., “• • • • • • Lignocellulosic Biomass to Ethanol Process Design and Economics Utilizing Co-Current Dilute Acid Prehydrolysis and Enzymatic Hydrolysis for Corn Stover,” 2002. [Online]. Available: http://www.osti.gov/bridge
43. U.S. Bureau of Labor Statistics, “Occupational Employment and Wages, May 2022: 51-8091 Chemical Plant and System Operators,” U.S. Department of Labor.
44. J. Lee et al., “Catholyte-free electroreduction of CO2for sustainable production of CO: concept, process development, techno-economic analysis, and CO2reduction assessment,” Green Chemistry, vol. 23, no. 6, pp. 2397–2410, Mar. 2021, doi: 10.1039/d0gc02969f.