윤진환 교수님 1팀
프로젝트 개요
기술개발 과제
국문 : 제올라이트 기반 전이금속 촉매를 이용한 폐플라스틱 열분해 및 방향족 자원 회수 연구
영문 : Catalytic Pyrolysis of Waste Plastics Using Zeolite-Based Transition Metal Catalysts for Aromatic Resource Recovery
과제 팀명
윤진환 교수님 1팀
지도교수
윤진환 교수님
개발기간
2025년 9월 ~ 2025년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 2019340033 유인혁(팀장)
서울시립대학교 화학공학과 2019340006 김도완
서울시립대학교 화학공학과 2019340015 김태정
서론
개발 과제의 개요
개발 과제 요약
◇ 제올라이트 금속 도핑 및 열분해 매커니즘을 이해하고 폐플라스틱 재활용 공정을 재현한다.
◇ 제올라이트에 금속을 도핑시켜 열분해에 최적화된 촉매를 제작 및 분석한다.
◇ 전이금속 제올라이트를 이용한 폐플라스틱 열분해 과정을 재현하고 방향족 화합물의 수득률을 계산한다.
◇ 이전 학기에서 진행했던 선행연구에서의 수득률을 비교 및 타당성을 검증한다.
개발 과제의 배경
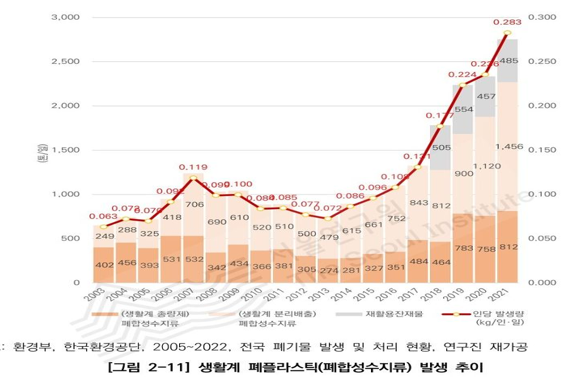
현대 사회에서는 편리함과 위생을 이유로 일회용 플라스틱 제품의 사용이 폭발적으로 증가하고 있으며 그로 인해 폐플라스틱의 배출량 또한 지속적으로 급증하고 있다.
이러한 추세는 도시 및 산업 폐기물 관리 체계에 과도한 부담을 주고 있으며 기존의 소각 또는 매립 방식으로 처리되는 폐플라스틱은 환경에 심각한 악영향을 끼치고 있다.
폐플라스틱의 소각 과정에서 일산화탄소(CO), 이산화황(SO₂), 이산화탄소(CO₂ ) 및 온실가스 등과 같은 유독 가스가 대량으로 방출되어 대기오염은 물론 기후변화에까지 부정적인 영향을 미치며 매립된 플라스틱은 수십 년 이상 분해되지 않고 토양 및 지하수 오염을 유발시키고 있다.
금속 도핑 제올라이트 기반 촉매 시스템은 폐플라스틱의 효율적 자원화와 환경 부하 저감이라는 두 가지 과제를 동시에 해결할 수 있는 유망한 기술적 해법으로 지속가능한 폐기물 처리 및 순환 경제 구축에 기여할 수 있을 것으로 기대된다.
촉매 설계를 통해 유해가스 발생 최소화 및 자원 회수율 증대가 가능하므로, 탄소중립 및 폐기물 관리와 관련된 정책적 의사결정의 과학적 근거로 활용될 수 있다.
개발 과제의 목표 및 내용
◇ 폐플라스틱 재활용 공정시 필요한 제올라이트의 금속 도핑 방법과 열분해 매커니즘을 이해하고 실험을 설계 및 진행한다.
◇ 제올라이트에 금속을 도핑시키고 XRD, XPS 분석기기를 이용해 도핑을 확인한다.
◇ 도핑시킨 제올라이트를 이용해 열분해 실험을 진행하고 GC-FID와 FT-IR을 이용해 방향족 화학물질의 수득률을 파악한다.
◇ 이전학기에 진행했던 선행연구에 대한 실험적 비교를 통해 방향족 화학물질 수득률의 경향성을 파악한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
- 전 세계적인 기술현황
◇ 최근 연구를 폐플라스틱 열분해 시에 사용되는 촉매의 성능을 평가하는 연구가 진행되고 있다. 최근 연구를 보면 함침법을 통하여 전이 금속을 도핑시킨 후 실제 플라스틱 폐기물을 열분해하는 실험을 통해 촉매의 성능을 판단하는 지표를 설정하였다. 위 선행연구에서는 Acidity/SBET 비율이 제올라이트계 촉매의 성능을 평가하는 핵심 기술 지표로 주목하고 있다. (촉매의 산점 밀도(Acidity)와 비표면적(Specific Surface Area, SBET))
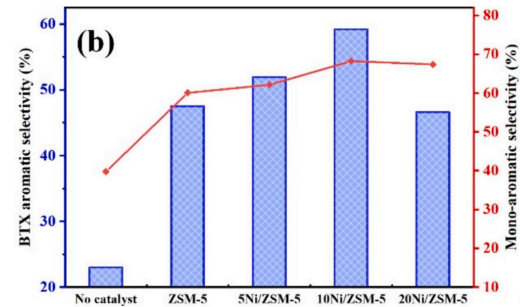
◇ Zhang et al. Fuel, 2024는 고체 열 운반체를 갖춘 회전식 반응기 내 Ni/ZSM-5 촉매 기반 폴리에틸렌(PE) 현장 촉매 열분해를 제시하며 금속 니켈 담지량 및 촉매-대-PE 질량비가 열분해 오일의 BTX 방향족 선택도와 수소 분율에 미치는 영향을 분석했다. 이 연구는 금속 니켈 담지량이 10 wt%일 때 열분해 오일 내 BTX 방향족 농도가 향상되었고, 20Ni/ZSM-5 촉매 사용 시 수소 가스 분율이 증가했다. 또한 그 원인이 니켈 금속이 C–C 및 C–H 결합을 분해하는 데 탁월한 능력을 가지기 때문임을 입증했다. 또한 촉매-대-PE 질량비를 0.5에서 2로 변화시켰을 때 열분해 오일 내 단일고리 방향족 화합물의 농도가 증가했음을 확인했다. 그러나 촉매 비활성화의 주요 원인인 코크 침적(coke deposition)의 양이 니켈 담지량 증가에 따라 증가했음을 보고하면서도, 코크 침적의 발생을 정량적으로 제어하고 촉매 재생 후 장기적인 내구성을 확보하기 위한 구체적인 운용 전략에 대해서는 구체적으로 다루지 않았다.
◇ Koti et al. ACS Omega, 2025는 매립지 폐플라스틱의 촉매 열분해를 제시하며 응답 표면 방법론(RSM-CCD)을 통해 온도와 촉매 담지량의 최적 조건을 조사했다. 이 연구는 세척 과정을 거친 폐플라스틱이 오일 수율을 높이는 데 효과적임을 확인하고, 최적 조건에서 세척된 폐기물이 가장 높은 오일 수율과 높은 HHV를 달성했음을 분석했다. 특히, 5 wt% Co/HZSM-5 촉매가 높은 가솔린 수율을 보이는 등 고품질 탄화수소 화합물 분포를 보였음을 확인했다. 그러나 최적 조건에서 생산된 산성의 열분해 오일을 상업적 연료로 직접 활용하기 위해 필요한 후처리 또는 산성도 저감 방안에 대해서는 구체적으로 다루지 않았다.
◇ Dyer et al. Journal of Material Cycles and Waste Management, 2022는 폐 바이오매스와 폴리스티렌의 동시 열분해을 제시하며 Ga, Co, Cu, Fe, Ni 변형 ZSM-5 촉매를 사용하여 액체 연료 및 방향족 화학물질 생산에 미치는 영향을 분석했다. 이 연구는 Ni–ZSM-5와 Co–ZSM-5가 탈카르복실화 및 탈카르보닐화를 통해 산소를 주로 제거하는 반면 ZSM-5, Ga–ZSM-5, Cu–ZSM-5, Fe–ZSM-5 촉매는 수소화 탈산소화를 통해 산소를 제거한다는 메커니즘의 차이를 규명했다. 또한 Co–ZSM-5, Cu–ZSM-5, Fe–ZSM-5, Ni–ZSM-5 촉매는 미변성 ZSM-5에 비해 단일고리 방향족 화합물의 수율을 증가시켰다. 그러나 금속 담지 후 촉매의 표면적 및 기공 부피가 감소했음을 보고하면서도, 이것이 촉매 활성점 접근성 및 촉매 수명에 미치는 구체적인 영향이나 사용된 촉매의 코크 침적량 정량 분석에 대해서는 구체적으로 다루지 않았다.
◇ Waziri et al. Applied Petrochemical Research, 2019는 저밀도 폴리에틸렌(LDPE) 열분해 기체 생성물의 촉매 개질(reforming)을 제시하며 Fe-ZSM-5 촉매의 온도 및 담지량이 액체 연료 품질에 미치는 영향을 분석했다. 이 연구는 촉매 개질이 액체 분획의 방향족 함량을 크게 증가시키고 지방족 함량을 감소시킴을 FTIR 결과로 확인했으며, 최적 조건에서 응축액의 방향족 탄화수소 조성이 상대적으로 약 70%까지 증가하고 주 생성물이 p-자일렌임을 GC/MS 분석을 통해 입증했다. 그러나 촉매의 고온 적용은 비응축성 가스 수율을 높이는 결과를 가져왔으며, 촉매 비활성화의 주요 원인이 되는 사용된 촉매의 코크 침적 및 비활성화 정도에 대한 특성화 결과나 촉매 재생 후 재사용 가능성에 대해서는 구체적으로 다루지 않았다.
- 특허조사
◇ 고급 경질유 생산을 위한 제올라이트 촉매: 한국 에너지 기술 연구원에서 폐플라스틱 열분해로 생성된 왁스 오일을 제올라이트계 촉매 존재 하에서 열분해하여 나프타나 경질 올레핀과 같은 고급 탄화수소로 전환하는 방법에 대한 특허를 출원하였다.
◇ 특정 Si/Al 비율의 제올라이트: 한국화학연구원에서 폐플라스틱 열분해유로부터 경질 올레핀 수율을 높이기 위해 Si/Al 몰 비율이 50~1000을 만족하는 제올라이트 촉매를 이용하는 방법이 특허로 제시되었다.
◇ 금속이 함침된 제올라이트 촉매: Johnson Matthey Plc 사에서 금속이 함침된 제올라이트 촉매를 이용한 폐플라스틱 분해 특성에 대한 연구 및 관련 특허로 제시하였다.
◇ 순환 유동층 반응기 및 제올라이트 촉매 시스템: 한국화학연구원에서는 제올라이트 성형체 촉매와 순환 유동층 반응기를 결합하여, 기존 나프타 분해 공정보다 낮은 온도에서 폐플라스틱을 효율적으로 분해하고 촉매를 연속적으로 재생할 수 있는 파일럿 규모의 기술을 개발하였다.
◇ 개질 제올라이트 촉매를 이용한 혼합 폐플라스틱 처리 기술: 한국 폐기물 자원 순환 학회에서 할로겐화 폴리비닐(PVC 등)이나 또는 산성 플라스틱이 포함되어 있는 혼합 폐플라스틱을 처리하기 위하여, 개질된 제올라이트 촉매를 사용하여 고부가의 탄화수소 유체 연료로 전환하는 기술을 개발하였다.
- 특허전략
◇ 기존에 연구한 머신러닝 기반의 예측 모델을 실험을 통해 실증한다.
◇ 기존에 연구한 머신러닝 모델의 예측값과 실제 수율을 정량적으로 비교한다. 이를 통해 촉매 수명, 실험 규모 등을 학습시켜 지속가능성, 경제성에 대한 이점을 가져갈 수 있다.
개발과제의 기대효과
기술적 기대효과
◇ 금속 도핑 제올라이트 기반 촉매 시스템은 폐플라스틱의 효율적 자원화와 환경 부하 저감이라는 두 가지 과제를 동시에 해결할 수 있는 유망한 기술적 해법으 로 지속가능한 폐기물 처리 및 순환 경제 구축에 기여할 수 있을 것으로 기대된다.
◇ 다양한 촉매 조합 및 반응 조건에서의 방향족 생산성을 사전에 예측할 수 있어 반응 최적화 실험을 최소화하고 개발 시간을 단축시킬 수 있다. 이 과정에서 화학적 재활용 공정의 고도화 기반을 마련할 수 있다.
경제적, 사회적 기대 및 파급효과
◇ 촉매 설계를 통해 유해가스 발생 최소화 및 자원 회수율 증대가 가능하므로, 탄소중립 및 폐기물 관리와 관련된 정책적 의사결정의 과학적 근거로 활용될 수 있다.
◇ 여러 금속 종류, 흡착위치, 활성도 등 여러 조건에 대한 변수들을 분석하고 정량화하였기 때문에 다양한 플라스틱 종류 및 열분해 조건에 맞는 최적화된 촉매를 설계하는 것이 가능하다. 이를 통하여 각 상황에 맞는 촉매를 설계하는 플랫폼을 구축할 수 있다.
기술개발 일정 및 추진체계
구성원 및 추진체계
◇ 김도완, 김태정, 유인혁 : 도핑 및 열분해 실험 설계
◇ 김도완, 김태정, 유인혁 : 도핑 실험 및 분석
◇ 김도완, 김태정, 유인혁 : 열분해 실험 및 분석
◇ 김도완, 김태정, 유인혁 : 선행연구와 비교
이론 및 실험 설계
이론
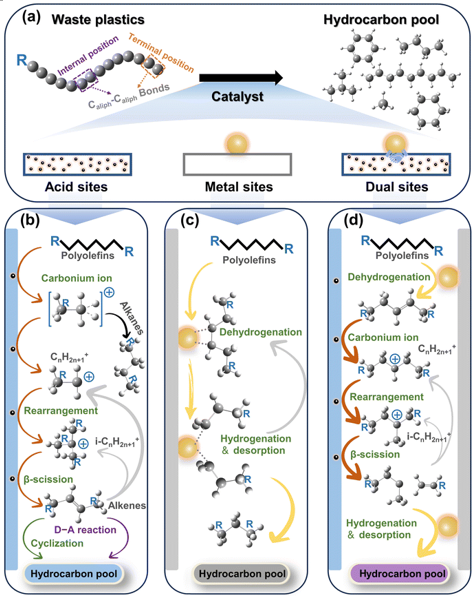
열분해 메커니즘
- Radical mechanism
1. 고분자 사슬 끊기 (열분해 시작) : 플라스틱은 긴 탄소 사슬(고분자)로 이루어져 있다. 산소 없이 300~500도 정도로 가열하면, 이 긴 탄소 사슬 중간중간에 있는 결합이 뜨거운 열 때문에 끊어지기 시작하는데 이것을 열분해라고 한다.
2. 자유 라디칼 생성 : 결합이 끊어질 때, 전자를 하나씩 나눠 가지면서 '자유 라디칼'이라는 불안정한 조각들이 생긴다. 이 라디칼들은 다른 분자와 반응하려는 경향이 있어 활발하게 움직인다.
3. 사슬 반응 (성장 및 끊김) : 생성된 라디칼들이 다른 플라스틱 사슬을 공격해서 또 다른 라디칼을 만들고, 자신은 안정화되거나 더 작은 조각으로 변함. 이러한 과정이 계속 반복되면서 원래의 긴 고분자 사슬이 점점 더 짧은 조각들로 변화한다. 이것을 라디칼 연쇄 반응이라고 한다.
4. 왁스 생성 : 열분해 과정에서 온도가 너무 높지 않거나, 특정 촉매를 사용하지 않으면 사슬이 완전히 짧게 끊어지지 않고 적당히 긴 상태로 남는다. 적당히 긴 탄화수소 사슬들 (보통 탄소 원자가 20개 이상 연결된 것들) 이 상온에서 고체나 반고체 형태로 뭉쳐지는 것을 왁스라고 한다.
- Carbenium ion mechanism
촉매를 쓰면 길이가 짧은 탄화수소 사슬이 나오게 되는데 그 이유는 촉매가 열분해과정을 다르게 이끌기 때문이다.
1.촉매의 산성자리: X(촉매의 산성 자리)가 플라스틱 고분자 사슬에 있는 단일 결합(C-C)을 공격해서 끊는 역할을 한다.
2. 카르베늄 이온 생성: 촉매 표면에서 C-C 결합이 끊어질 때, '카르베늄 이온'이라는 불안정한 중간체가 생기기 쉽다. (자유 라디칼 메커니즘도 있지만, 산성 촉매에서는 이온 메커니즘이 중요하다.)
(카르베늄 이온 : 탄소 원자가 양전하(+)를 띠고 있는 불안정한 이온)
3. 베타-깨짐 (Beta-scission): 카르베늄 이온은 안정화되기 위해 자기로부터 2개 탄소 떨어진 곳의 C-C 결합을 또 끊어버리는 반응을 잘 발생시키는데 이것을 '베타-깨짐'이라고 한다. 이 과정에서 이중 결합(C=C)을 가진 올레핀이 만들어져 나오게 되고 동시에 새로운 카르베늄 이온이 또 생겨서 반응이 계속 이어진다.
4. 짧은 사슬 선호: 촉매의 구조적인 특성(특히 제올라이트의 미세한 구멍 구조)과 산성 자리의 성질 때문에, 촉매는 긴 사슬보다는 짧은 탄소 사슬, 특히 에틸렌이나 프로필렌 같은 '가벼운' 올레핀을 만드는 데 더 유리하게 반응을 유도하는 경향을 가진다.
촉매는 플라스틱 고분자 사슬을 효과적으로 쪼개는데 이 쪼개는 과정이 그냥 열만 가했을 때랑 달라서 이중 결합을 포함하는 짧은 탄소 사슬들이 많이 생기게 만든다.
- Carbenium ion 생성 과정
1. 산성 촉매의 도움: 산성 촉매의 산성 자리가 플라스틱 사슬의 C-C 결합을 공격해서, 한쪽 탄소가 전자를 덜 가져가면서 양전하를 띠고 떨어져 나오는 경우에 카르베늄 이온이 생길 수 있음
2. 다른 분자로부터 수소 이온(H+)을 떼어내면서: 탄화수소 분자에서 수소 이온(H+)이 떨어져 나가면서 옆에 있던 탄소가 양전하를 띠게 되어도 카르베늄 이온이 만들어질 수 있음
- Carbenium ion 특징
1. 매우 불안정함: 전자가 부족해서 주변의 전자나 음전하를 띤 물질과 바로 반응하는 경향.
2. 재배열 (Rearrangement): 더 안정적인 형태의 카르베늄 이온으로 스스로 구조를 바꾸는 '재배열' 반응을 잘 일으킴. 이 재배열 때문에 최종 생성물이 다양하게 나올 수 있음.
3. 반응성이 높음: 다른 분자들과 빠르게 반응해서 새로운 결합을 만들거나 기존 결합을 끊는 역할
제올라이트 ZSM5
- 촉매 사용 이유
만약 온도를 더 높이거나 특정 촉매를 쓰면, 이 적당히 긴 사슬들이 더 짧게 끊어져서 가벼운 기름(연료유)이나 가스 형태로 변화한다. 어떤 조건을 쓰냐에 따라 최종적으로 나오는 물질(가스, 기름, 왁스, 숯)의 비율이 바뀐다.
결국 폐플라스틱 왁스 열분해 메커니즘은 플라스틱 고분자 사슬이 열에 의해 끊어지고, 이 과정에서 생성된 다양한 길이의 탄화수소 조각들 중에서 적당히 긴 조각들이 뭉쳐 왁스 형태가 되는 과정이다. 여기서 만들어진 왁스는 접착제, 코팅제, 광택제, 잉크, 양초, 윤활제 등으로 사용된다.
열분해 시 촉매를 이용하면 더 짧은 탄화수소 사슬을 얻을 수 있으며 기름 형태의 물질(디젤, 가솔린), 가스형태의 물질(메탄, 에탄) 및 방향족 물질의 수율이 높아진다. 특히 불포화 탄화수소인 올레핀 이 많이 생성되는데 이때 촉매가 열분해로 생긴 올레핀이나 파라핀 계열의 고리화 혹은 탈수소화를 진행하여 방향족으로 전환시킨다. (탄소 원자들 사이에 적어도 하나 이상의 이중 결합(C=C)을 가지고 있는 것들로 왁스나 일반적인 기름처럼 탄소-탄소 사이에 단일 결합(C-C)만 있는 것들(포화 탄화수소)과는 구조가 좀 다르다.)
- 제올라이트(Zeolite)
제올라이트는 결정성 알루미노실리케이트로, 내부에 균일한 크기의 기공을 가진 산성촉매이다. 제올라이트 촉매는 산 촉매로 작용하여 시작단계의 C-C 결합 분해에 효과적이고, 결합에너지가 높다는 점 때문에 높은 열적 안정성을 가지고, 또 ZSM-5, Y형 등 다양한 형태를 가진다. 미세한 기공이 존재하는 특유의 구조와 그 구조가 단단하기 때문에 원하는 분자만 반응시킬 수 있는 형태 선택성이 우수하고, 목적에 맞춰 조성을 변화시켜 물성과 활성을 정밀하게 조절할 수 있는 조절 가능성 또한 우수하다. 이러한 장점들은 제올라이트를 촉매로 사용하게 하는 중요한 요소이다.
하지만 단점 또한 가지고 있다. 고온의 수증기 환경에서 제올라이트의 골격이 손상되거나 알루미늄이 dealumination 되는 문제를 가져 수열 안정성이 낮다. 또한 촉매작용 중 생성된 코크가 기공이나 표면에 흡착되는 코킹 문제가 있다. 그리고 기공 크기가 작고 정형화되어 큰 분자의 접근이 힘들다. 고온, 수분, 반응물 등의 이유로 활성성분이 유실되는 경우가 있다는 점 또한 단점으로 지적된다.
- 전이금속 종류의 선정 이유
열분해 진행 시 최종목표를 생각하면 탄화수소의 회수율을 높이는 것이라고 할 수 있다. 그 중에서도 BTX 방향족을 메인 타겟으로 가져가는데 그 이유는 경제적이고 산업적으로 재활용 가능한 고부가가치 화학 원료이기 때문이다. 이러한 배경속에서 방향족의 수율을 높이기 위해 다음과 같은 사항들을 고려할 수 있다.
- 제올라이트의 종류
여러 제올라이트 중 ZSM-5 구조에서의 기공크기가 방향족 생성에 최적의 크기이기 때문에 ZSM-5 구조를 사용한다.
- 흡착 site
다음, 산점의 농도를 높여 C-C 분해를 촉진 시키는 방법이다. 이는 흡착 site를 설계하는 방법으로 이루어진다. 흡착 site는 반응물(예: PE, PP 사슬)이 촉매 표면에 효율적으로 고정되어 활성화되도록 하는 역할을 한다. 일반적으로 Brønsted 산점 (H⁺)이 작용해 고분자 사슬을 프로톤화 → 카르베늄 이온 생성을 유도한다.
금속 도핑 시, 금속 산화물 표면은 Lewis acid site 역할을 하여 π-전자 또는 lone pair를 흡인해 반응 활성화를 이끌어 낸다.
Brønsted 산점 → C-C 결합 분해 유도 Lewis 산점(도핑된 금속) → 탈수소화/고리화 반응 촉진
ZSM-5에서 BTX는 주로 내부 기공에서 생성되기 때문에 전이금속 도입 시에는 금속이 외부 표면에서 산화물 형태로 응집해 기공을 막지 않도록 제어하고 금속 이온(Mⁿ⁺)이 ZSM-5 골격의 음전하(Al–O–Si)에 의해 내부 기공에 고립, 분산된 구조가 되도록 설계하는 것이 중요하다
금속 이온이 균일하게 분산되면 활성 Lewis 산점이 안정적으로 형성되고, Brønsted 산점과의 시너지 반응을 통해 올레핀의 탈수소화·고리화·방향족화가 효과적으로 진행된다. 반대로 금속이 산화물(MOₓ) 덩어리로 응집되면 기공막힘과 과도한 크래킹이 발생해 BTX 선택성이 크게 저하된다.
- 탈수소화& 고리화
방향족 생성은 탈수소화와 고리화로 진행된다. 대부분의 방향족 생성은 올레핀 → 방향족 전환을 포함하며, 이때 H₂가 빠져나가는 것을 탈수소화 반응이라고 하며 이 과정은 필수라고 볼 수 있다. 전이금속(Fe, Ga, Zn 등)은 이 탈수소화 반응의 활성화 에너지를 낮춰주고 d-전자 구조가 적당하여 π-결합을 안정화 시키고 수소를 제거하는데에 유리하다.
다음은 고리화 반응이다. ZSM-5의 Brønsted 산점에서 형성되는 카르베늄 이온은 불안정하다. 도핑된 금속이 전자 밀도 조절 + 안정화 역할을 하여, 올바른 경로로의 분해를 유도한다. 그 결과, 불안정한 중간체가 고리화 → 방향족 경로로 쉽게 전환되며 왁스, 올레핀 등 다른 부산물로 전환되는 비율이 낮아진다.
- 정리
탈수소화 반응을 촉진 시키는 Redox능력, 카르베늄 이온을 안정시키고 활성화 에너지를 결정하는 d-전자 구조, 전자 밀도를 조절하며 안정화 역할을 하는 전기 음성도 및 구조를 가지기 때문에 전이금속을 제올라이트 촉매의 도핑원소로 사용한다.
실험 설계
실험 기구 및 시약
- 실험 기구 및 장비
① 용액 제조 및 보관: 1 L 비커, 250 mL 비커, 마그네틱 바 (교반용)
② 반응 및 제어: 항온 교반기, pH 미터, 전도도계
③ 여과 및 분리: 감압 여과기
④ 건조 및 소성: 오븐, 머플 퍼니스
⑤ 기타: 도가니
- 시약
① 지지체: Na-ZSM-5
② 금속 전구체: Fe(NO₃)₃·9H₂O, Ni(NO₃)₂·6H₂O, Co(NO₃)₂·6H₂O
③ 기타 시약: NH₄NO₃, HNO₃ (69–70% ACS reagent ≥98%, pH 조절용), 초순수 (Deionized Water, 18.2 MΩ·cm)
실험 방법
- H-ZSM5 제조 실험
1. 1M NH₄NO₃ 용액 제조
2. Na-ZSM-5 → NH₄-ZSM-5 (암모늄 이온교환)
①. 500 mL 비커에 1 M NH₄NO₃ 150–200 mL를 담고 80 °C로 예열.
②. Na-ZSM-5 10 g 투입, 교반 600 rpm, 80 °C, 2 h 유지. (증발 시 물 보충)
③. 부흐너 여과 → 초순수로 세척 (여액 전도도 ≤ 50 µS/cm).
④. 다음 회차 동일 조건으로 새로운 1 M NH₄NO₃ 용액 사용.
⑤. 마지막 세척은 여액 전도도 ≤ 20 µS/cm.
3. NH₄-ZSM-5 → H-ZSM-5 (탈암모니아 소성)
①. 승온: 2 °C·min⁻¹로 500–550 °C (온도 올린 뒤 4-6시간 안정화).
②. 자연 냉각, 공기 소성.
- 이온교환법 (공통 조건)
- 지지체: ZSM-5 H형 10 g
- 용액: 금속 질산염 HNO₃ (69–70% ACS reagent ≥98%), 초순수 18.2 MΩ·cm
- 장비: 항온교반기(70°C), 부흐너여과기, 전도도계, 110°C 오븐, 머플퍼니스(공기), H₂/N₂ 환원로
- L/S ratio: 15–20 mL·g⁻¹ (10 g당 150–200 mL/회)
- pH: 3.8–4.5 유지 (0.1 M HNO₃로 미세 조절)
- 세척 기준: 여액 전도도 ≤ 20 µS·cm⁻¹
- Stock 용액 제조 계산 (0.1 M, 250 mL 기준)
- Fe–ZSM-5: 0.10 M Fe(NO₃)₃·9H₂O 250 mL → 필요 염: 0.10 × 0.25 × 404.00 = 10.10 g
- Ni–ZSM-5: 0.10 M Ni(NO₃)₂·6H₂O 250 mL → 필요 염: 0.10 × 0.25 × 290.79 = 7.27 g
- Co–ZSM-5: 0.10 M Co(NO₃)₂·6H₂O 250 mL → 필요 염: 0.10 × 0.25 × 291.03 = 7.28 g
- 이온 교환법 실험
1. 교환용 Stock 용액 제조
①. 메스플라스크(250 mL)에 초순수 ~150 mL 투입.
②. 해당 염 완전 용해 후 초순수로 250 mL 정용.
③. pH 확인 후 필요 시 0.1 M HNO₃로 3.8–4.5 맞춤 (탁해지면 pH 낮출 것). ※ 이론적 필요량은 소량(~0.5g 수준)이나, 교환 평형을 위해 과량 제조함.
2. 1차 이온교환
①. 500 mL 비커에 Stock 용액 150–200 mL + ZSM-5 10 g 투입.
②. 70 °C, 600 rpm, 5 h 교반. (증발 시 초순수로 부피 유지, pH 3.8–4.5 유지).
③. 부흐너 여과 → 초순수 200–300 mL로 세척 반복 (여액 전도도 ≤ 20 µS·cm⁻¹).
3. 2차 이온교환
①. 동일 조건으로 새로운 Stock 용액 150–200 mL 사용 → 70 °C, 5 h 교반 → 여과·세척.
②. 목표 로딩이 낮게 나오면 3차까지 반복 가능.
4. 건조
①. 110 °C 오븐에서 12 h 건조.
5. 소성 (질산염 분해, 산점 안정화)
①. 2 °C·min⁻¹ 승온 → 500–550 °C, 4–6 h 유지, 공기 분위기 (NOₓ 배출 주의, 후드 필수).
6. 활성화
①. N₂ 퍼지 30 min.
②. 5–10% H₂/N₂ 분위기, 1–2 °C·min⁻¹ 승온 → 400 °C, 2 h 유지 → N₂ 냉각.
- 열분해 실험
1. 시료 준비 (플라스틱 + 촉매 혼합)
① 폐플라스틱 시료(PE 또는 PP)를 가위로 2–3 mm 크기로 절단한다.
② 전자저울로 폐플라스틱 3.0 g을 칭량한다.
③ 별도의 비커에서 금속 도핑 제올라이트(Fe-, Ni-, Co-ZSM-5)를 각각 1.0 g씩 칭량한다.
④ 유발(몰탈)에 폐플라스틱과 촉매(총 4.0 g)를 넣고 유리막자로 2–3분간 고르게 혼합한다.
⑤ 혼합된 시료를 50 mL 내열 비커에 옮기고 바닥에 평탄하게 펼친다.
2. 반응기(비커) 밀봉
① 내열 비커 상단을 고온용 카본테이프로 여러 겹 감아 밀봉한다.
② 카본테이프 외측에 약 1 mm 직경 구멍 1개를 핀 또는 바늘로 뚫어 압력 완화구를 확보한다.
3. 오븐 세팅 및 질소 퍼지
① 비커를 오븐 중앙부의 세라믹 거치대 위에 올린다.
② N₂ 가스 라인을 전기로 내부 또는 입구에 설치한다.
③ N₂를 100 mL/min으로 흘리며 20–30분간 퍼지하여 내부 공기를 제거한다.
④ 퍼지 후, 반응 동안 유지할 20–30 mL/min 수준으로 유량을 조절한다.
4. 열분해 반응
① 승온
승온 속도: 10 ℃/min
목표 온도: 500 ℃
② 목표 온도 도달 후 30분간 유지하여 플라스틱 열분해 반응을 진행한다. (반응 중 오븐 문은 닫고, N₂ 유량은 일정하게 유지한다.)
③ 30분 후 전기를 차단하고 N₂ 흐름을 유지하며 자연 냉각시킨다(약 1–2 h)
5. 생성물 회수
① 전기로와 비커가 충분히 냉각된 것을 확인한 뒤 비커를 꺼내 카본테이프를 제거하여 개방한다.
② 비커 내부의 액상 생성물을 주사기 또는 피펫으로 회수한다.
(잔류물이 적을 경우 n-헥산 또는 DCM 2–3 mL를 비커에 넣고 벽면을 세척하여 밀착된 생성물까지 모은다.)
6. 시료 분석 (GC-FID / GC-MS)
① 회수한 액상을 필요 시 5–10배 희석한다(용매: n-헥산 또는 DCM).
② GC-FID에 1–2 µL 주입한다.
③ 방향족 화합물(BTX, C9–C12)의 피크 면적을 확인한다.
④ 촉매별(Fe/Ni/Co) 차이를 비교하여 방향족 생성 경향을 도출한다.
⑤ GC-MS를 이용하여 주요 피크의 질량 스펙트럼을 통해 물질을 동정한다.
결과 및 평가
실험결과 및 분석
H-ZSM5 제조
우선 ZSM5에 각각의 금속을 도핑하기 위해서는 Na-ZSM5를 H-ZSM5로 바꾸는 작업을 진행하여야 한다. 이 과정을 진행하지 않고 바로 도핑을 진행하게 되면, 우선 Co, Fe, Ni가 들어갈 자리에 이미 Na가 자리를 잡고 있기 때문에 위의 금속들이 들어갈 공간이 없어서 도핑이 제대로 되지 않는다.
또한 Na⁺ 자체는 산점이 거의 존재하지 않기 때문에 촉매로서의 성능이 좋지 않다. 따라서 이번 실험에서는 NH₄NO₃와 Na-ZSM5와의 이온 교환을 통해서 우선 Na⁺ 를 NH₄⁺로 치환해서 금속이온이 들어갈 자리를 우선적으로 만들었고, 그 후 소성과정을 거쳐 NH₄⁺가 사라지는 탈 암모늄과정을 진행한다.( NH₄⁺ →H⁺ + NH₃(g) ) 이 과정이 진행되면, 강한 Brønsted 산점을 가지는 H-ZSM5가 제조된다.
이렇게 제조된 H-ZSM5는 H⁺가 proton 형태로 존재해서 금속 이온과 쉽게 교환이 가능하고, 산점도 역시 이전의 Na-ZSM5 대비 굉장히 크다. 또한 폐플라스틱과 열분해시 탈수소, 고리화 반응을 유도해서 방향족의 수득률을 올리는데 큰 역할을 하게 된다.
위의 실험이 잘 진행 되었는지를 FT-IR을 통해서 확인할 수 있다. 먼저 아래의 그림은 Na-ZSM5의 FT-IR 그래프이다.
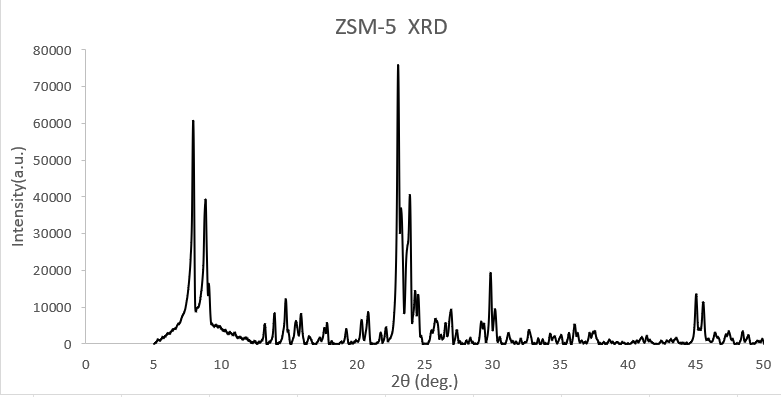
위의 그림은 Na-ZSM5의 FT-IR이다. 위 그림에 표시한 1250-1000cm⁻¹부근에 존재하는 peak가 ZSM5 결정 구조의 핵심 peak이며, ZSM5 외부 골격에 존재하는 Si-O-Si 결합의 존재를 알 수 있다. ZSM5 구조에 대해 조금 더 자세히 알아보기 위해서 XRD 분석 결과를 살펴보자. 아래는 XRD 분석 결과 그래프이다.
이제 각 peak에 대해서 알아보자. 먼저 7-10º영역에 존재하는 peak는 ZSM5에 존재하는 10원자 고리기공으로 인해 발생한 peak이고, 22-25º영역에 존재하는 peak는 ZSM5 구조 해석에 가장 핵심이 되는 peak로, ZSM5 구조 특유의 3차원 10원자 고리 기공이 규칙적으로 잘 짜여 있다는 것을 위의 그래프로 확인 할 수 있다. 또한 7-10º영역, 22-25º영역에 있는 두개의 peak가 굉장히 강하게 찍혀 있는 것을 통해 이번 실험에 사용하는 ZSM5의 품질이 매우 우수함을 알 수 있다.
그 다음, 위의 실험을 통해 제조한 H-ZSM5의 FT-IR의 그래프를 살펴보자.
위의 FT-IR의 그래프를 보면 Na-ZSM5와 마찬가지로, 1250-1000 cm⁻¹부근에 ZSM5의 핵심 peak가 존재함을 확인할 수 있다. 하지만, 이전과는 다르게 3610 cm⁻¹부근에 좁고 뾰족한 peak가 보이는데 이는 Brønsted 산점으로 인해 존재하는 peak로, Na-ZSM5와 H-ZSM5의 가장 큰 차이점이다. 따라서 위의 그래프를 통해 제조된 물질이 H-ZSM5임을 확인할 수 있다.
전이금속 도핑
이번에는 위에서 제조한 H-ZSM-5에 Co, Fe, Ni를 도핑하여 열분해 촉매 성능을 향상시키는 작업을 진행하였다. 각각의 전이금속을 선택한 이유는 다음과 같다.
Fe : 우수한 탈수소화 능력과 Redox능력으로 방향족화 촉진에 기여한다.
Co : 중간수준의 d-전자구조와 적절한 전기음성도를 가지고 있어서 탈수소화 고리화. 반응을 촉진시키는데에 적합하다.
Ni : 고리화 반응 촉진 및 카르베늄 이온 안정화
이를 바탕으로 이번 실험에서는 Fe, Co, Ni 도핑을 통해 H-ZSM-5의 촉매 성능을 효과적으로 향상시키고, 폐플라스틱 열분해 과정에서 BTX 방향족 생성 효율을 크게 높일 수 있을 것으로 예상할 수 있다. 실험이 성공적으로 진행되었는지 확인하기 위해 X-ray Photoelectron Spectroscopy (XPS) 를 이용하여 분석하였다. XPS란, 표면에 X-선을 쏘고, 튀어나오는 광전자의 에너지를 측정하여 표면에 존재하는 원소를 분석하는 장비로, ZSM5 표면에 금속이 잘 도핑 되었는지 확인하기에 적합한 장비이다. 분석 결과는 다음과 같다.
가장 먼저 Co-ZSM5의 분석 결과를 살펴보자.
위의 그림은 Co-ZSM5 시료에 대한 XPS 결과이다. 이번 실험의 목적은 전이금속의 도핑 여부를 확인하는 것이므로, Co의 특징적인 Binding Energy 영역을 중심으로 해석하였다. 그래프에서는 800–795 eV 부근과 783–780 eV 부근에서 뚜렷한 peak가 관찰되며, 이는 각각Co 2p₁/₂ 및 Co 2p₃/₂에 해당한다. 따라서 위의 분석을 통해서 Co가 ZSM-5 표면에 확실히 존재함을 알 수 있다.
하지만, 금속Co의 특징적인 peak(약 778 eV)는 거의 확인할 수가 없다. 이를 통해서 시료 표면에 존재하는 Co는 금속상태가 아닌 산화된 상태(Co²⁺ or CoOₓ)로 존재한다는 것 역시 확인할 수 있다.
위의 내용들을 바탕으로, XPS 분석을 통해 H-ZSM5 표면에 Co가 성공적으로 도핑 되었음을 확인하였다.
다음은 Ni-ZSM5의 분석 결과를 살펴보자.
위의 그림은 Ni-ZSM5 시료에 대한 XPS 결과이다. 위의 그래프에서 역시 855eV 부근, 873eV 부근에서 peak를 확인할 수 있다. 이는 각각 Ni 2p₃/₂, Ni 2p₁/₂이 시료 표면에 존재함을 의미하므로, 이번 시료 역시 표면에 Ni이 확실히 존재함을 알 수 있다.
또한 Co와 마찬가지로, 851-853eV 부근에서 관찰할 수 있는 금속 Ni의 peak는 거의 관찰되지 않는다. 이를 통해서 표면에 존재하는 Ni이 산화된 상태(Ni²⁺ or NiOₓ)로 존재함을 확인할 수 있다.
위의 내용들을 바탕으로, XPS 분석을 통해 Ni 역시 H-ZSM5 표면 위에 성공적으로 도핑 되었음을 확인하였다.
마지막으로 Fe-ZSM5의 분석 결과를 살펴보자.
위의 그림은 Fe-ZSM5 시료에 대한 XPS 결과이다. 이번 그래프도 마찬가지로 725eV 부근에 Fe 2p₁/₂, 711eV 부근에 Fe 2p₃/₂을 나타내는 peak를 확인할 수 있으며, 이번 시료 역시 표면에 Fe가 확실히 존재함을 알 수 있다. 또한 707eV 부근에서 확인할 수 있는 금속 Fe의 peak는 눈에 띄지 않으므로, 이번 시료 역시 Fe가 산화된 상태(Fe²⁺/Fe³⁺ or FeOx)로 존재함을 알 수 있다.
위의 내용들을 바탕으로, XPS 분석을 통해 Fe가 H-ZSM5 표면 위에 성공적으로 도핑 되었음을 확인하였다.
종합적으로 보았을 때, 이번 실험의 목적인 'H-ZSM5위에 각각의 전이금속을 도핑한다' 는 성공적으로 진행되었으며, 이를 XPS 분석을 통해서 확인하였다.
폐플라스틱 열분해
다음 사진은 사용한 빨대(PP)를 열분해한 후 남은 액상에 대한 FT-IR의 결과물이다.
이번 프로젝트의 목적인 방향족이 제대로 만들어졌는지 알기 위해서는 총 3가지 부분의 피크를 확인해야 한다.
① 3030 cm⁻¹부근의 stretching peak : 방향족 고리 (sp² C–H)에서 나타나는 피크
② 1600cm⁻¹, 1500 cm⁻¹근처의 doublet peak : C=C 결합을 나타내는 피크이며 올레핀 , 알켄의 경우에는 1600중 후반의 wavenumber에서 나타나기 때문에 이 부근에서 나타나면 방향족 물질이 있다는 것을 알 수 있다.
③ 900~700 cm⁻¹부근의 불규칙적인 패턴 : 방향족 고리의 시그니쳐이며 치환 위치에 따라 형태가 다르게 나타난다. 방향족 고리 (sp² C–H)의 존재를 생각해 볼 수 있다.
FT-IR 결과물을 보면 첫번째 조건인 3030c m⁻¹근처에 부합하는 3025 cm⁻ 에 피크가 찍혀있음을 알 수 있다. 이를 통해
또한 두번째 조건에 부합하는 1500 cm⁻¹부근에 존재하는 두개의 doublet peak이다. 결과를 보면 1495cm⁻¹, 1604cm⁻¹영역에 피크가 찍혀있는 것을 통해 방향족 C=C 결합의 존재를 확인할 수 있다.
마지막으로 900~700 cm⁻¹영역에는 불규칙적인 패턴 중 두개의 peak가 보인다. 저 영역을 통해 확인 할 수 있는 것은 방향족의 치환기이기 때문에 정확히 알 수는 없다. 하지만 선행연구와 논문들을 분석해 본 결과 mono subst.와 유사한 모습을 보였다.
추가로 2917 cm⁻¹영역에도 피크가 존재한다. 2950–2850 cm⁻¹영역의 peak는 sp³ C–H stretch peak 이다. 이 피크를 통해서 PP에 대한 열 분해물로 나올 수 있는 CH₂·CH₃(알킬)이 존재한다는 것을 알 수 있다.
추가적으로 1654, 1695 cm⁻¹영역에도 두개의 dip peak 가 존재하는데 1680–1620 cm⁻¹영역의 약한 dip은 방향족의 C=C 결합보다 약한 C=C 결합이다.
앞선 2917 cm⁻¹파수에서의 결과와 함께 생각해보면 올레핀이 존재한다는 결과를 얻을 수 있다. 열분해의 결과물로 액상에서 올레핀 및 방향족 화합물, 왁스 등이 나와야 하므로 열분해 자체는 제대로 이루어졌다고 볼 수 있다.
폐플라스틱의 열분해 자체는 성공적으로 마쳤으나 안전문제로 인해 방향족 화합물의 수율비교는 제대로 할 수 없었다.
이에 따라 도핑된 금속종류에 따른 방향족 화합물의 수율은 논문분석으로 대체했다.
이번 프로젝트에서 진행한 금속은 철, 니켈, 코발트이다.
Fe
1. 프레임워크(Framework) 구조
① Al 과 Fe 치환
ZSM-5는 원래 Si–O–Al–O–Si 구조이다. 그러나 Fe 도핑 시 일부*Al 자리(T-site)에 Fe³⁺(또는 Fe²⁺)가 들어가 Si–O–Fe–O–Si 구조를 형성 하게 된다.
② Fe–O–Si 구조 변화
Fe–O 결합은 Al–O보다 길고 전하 분포가 다르다. 이에 따라 결합 길이와 각도가 전부 달라진다. 그래서 프레임워크 전체의 전자 분포, 기공 환경이 조금 달라진다.
이중에 과량 도핑 시 프레임워크 밖에 Fe종들이 생성된다. 모든 Fe가 T-site에 들어가지는 못하기 때문에 남은 Fe는 Fe(OH)²⁺, FeO⁺, Fe₂O₃ 와 같은 작은 클러스터 형태로 기공 내부 또는 외부에 자리 잡게 된다.
결국 Fe 도핑은 제올라이트 골격 자체에 “Fe–O–Si” 형태의 진짜 구조 변화를 만든다.
2. 산성도(Acidity) 변화
철 도핑은 제올라이트의 산성도 분포를 재편성한다.
① Brønsted acid site(BAS) 감소
원래 기존의 BAS = Si–O(H)–Al 구조이다. Al이 Fe로 대체되거나, Fe가 주변 구조를 왜곡시켜 O–H 브릿지의 양이 줄어들고 이는 곧 BAS 감소로 이어진다.
② Lewis acid site(LAS) 증가
Fe³⁺ / Fe²⁺ 같은 양이온 금속이 전자쌍을 받을 수 있기 때문에 새로운 Lewis 산성점이 생긴다.
③ 산성도의 강도 분포
오리지널 H-ZSM-5는 강한 BAS 위주였으나 Fe 도핑을 통해 중간 강도 산성 + LAS로 분포가 바뀌게 된다.
결론적으로 BAS ↓, LAS ↑, 산성 강도 분포 변화가 있고 이는 제올라이트의 산성 기능 자체를 재조정시키는 결과를 가져온다.
3. 전자구조(전하 분포)
① 전자의 재배치
Fe는 Al보다 전하(전기양성도)와 배위 방식이 다르다. 그래서 Fe가 도핑된다면 산소 주변의 전하 밀도(electron density)를 변화시킨다. 이는 이온성 강도나 흡착 특성을 달라지게 한다.
② Redox(Fe³⁺/Fe²⁺) 성질
기존의 ZSM-5는 Redox 금속이 없다. 그러나 Fe 도핑 시 Fe³⁺ ↔ Fe²⁺ 사이 전자 이동이 가능하게 되고 그 결과 Redox (oxidation/reduction) 성질을 갖게 된다.
③ 기공 내부 전기장(electric field)
금속이 있는 부근은 전하가 불균일해지면서 전기장 세기·분포가 달라진다. 따라서 물질이 기공에 들어왔을 때 영향을 받게 되는 전기적 환경이 달라진다.
결론적으로 Fe도핑을 통해 ZSM-5에 없던 Redox 성질과 금속 중심 전자구조 변화가 생긴다.
4. 결론
① BAS
BAS는 O-H 가 얼마나 산성이 강한지에 따라 강도가 바뀌게 된다. BAS가 너무 강하면 올레핀을 과도하게 Carbenium ion 으로 만들게 되고 이 Carbenium ion은 아주 불안정하기 때문에 바로 반응하여 β-scission, cracking, coke 로 이어진다.
따라서 이렇게 BAS가 너무 강하고 수가 많을 경우 분해가 너무 빨라서 방향족 전구체가 버티지 못한다. 이 점을 보완하기 위해 BAS를 약하게 해야한다. 그러나 너무 약하게 할 경우는 아예 Carbenium ion이 생성되지 않는다.
또 BAS가 너무 많을 시, 그리고 너무 강할시엔 과하게 분해되어 코크가 쌓이고 원하는 생성물이 분해되어버리는 경우가 있다. 산성도의 변화를 통해 BAS가 적당히 줄으면 방향족이 기공내부에서 오래 버티며 고리화가 가능해지는 환경이 되며 과도한 분해에 대한 문제가 줄어든다.
Fe 도핑은 이런 점에서 좋은 면모를 보인다. 기존 제올라이트는 Si–O–Al–O–Si 모습의 구조였다면 도핑 후에는 Si–O–Fe–O–Si 모습으로 바뀌어 O-H 결합에 대해 전기적 세기가 다르게 되고 BAS 강도가 적당히 줄어들게 된다. 이렇게 성격이 바뀌어 카르베늄 생성 및 이후 반응이 적당하게 잘 이루어지는 환경이 된다.
② LAS
LAS는 전자를 받을 수 있는 금속 중심 자리이다. 따라서 올레핀 및 중간체들이 머무를 수 있게 흡착시켜두고 재배열 및 고리화를 시키는 역할을 하는 공간이다. ZSM-5는 원래 금속이 없는 산성체이다. 그러나 Fe 도핑을 통해 Fe³⁺/Fe²⁺ 금속이온이 들어오게 되고 이 곳이 바로 전자쌍을 받을 수 있는 LAS가 된다.
올레핀 , 카르베늄 등을 그냥 두면 서로 붙어서 올바르게 고리화가 진행될 수 없다. LAS에서는 올레핀 및 디엔, 카르베늄 등이 서로 반응 할 수 있고 고리화가 될 수 있도록 장소를 제공한다.
또 LAS를 통해 기공 내부의 극성이 바뀌게 된다. 이 LAS 중 특히 Fe³⁺ 는 분자의 π 전자를 끌어당기고 이를 통해 고리화 전이상태의 에너지 장벽을 낮추어 안정화 시키는데에도 유리하다.
③ Redox 능력
Fe를 도핑시키면 Fe³⁺/Fe²⁺ 이온의 추가로 인해 Redox 능력까지 가질 수 있다. 따라서 Fe³⁺ ↔ Fe²⁺사이에서 전자가 오가며 수소나 탄화수소 중간체를 반응시킬 수 있게 된다.
특히 PP 열분해로 나오게 되는 여러 화합물(Cyclohexane, Cyclohexadiene...) 들이 방향족 구조로 변화하려면 H₂를 떼어내야하는 경우가 많다. 이 과정에서 Fe³⁺ 는 H•(수소 라디칼), H⁻ 를 받아 Fe²⁺로 변하게 되고 또 다시 산화 되어 Fe³⁺ 로 돌아오는 과정을 거쳐 탈 수소화를 진행시킨다.
④ 반응 선택성
Fe의 위치(T-site)에 따라 어디서 반응이 일으킬지를 변화시킬 수 있다.Fe가 중심 채널 / 교차 채널 주변에 있으면 그 공간에서 자주 반응이 일어나고,반대로 막힌 곳에 있으면 큰 분자가 빠져나가기 어려움. 따라서 Fe의 위치를 방향족 BTX 크기와 잘 맞는 공간에 위치시키는 것으로 반응이 더 잘 활성화 된다. 또 Fe 주변은 전기장이 강하고 전하 분포가 달라져서 반응속도가 빨라지며 특정 반응 경로로 유도하게 된다.
⑤결론
방향족 생성에는 카르베늄 생성과 고리화, 탈수소화 능력이 함께 필요하다. Fe 도핑은 이 관점에서 BAS를 과하지 않게 줄여주는 역할을 하며 LAS를 높여줘 충분히 반응하게 하는데에 도움을 준다. 또 금속을 도핑시켜 얻은 Redox 능력은 탈 수소화를 돕는다.
아래는 CCS에서 진행한 Fe-HZSM5에 대한 BAS, LAS 관련 테이블이다.
Co
1. 도핑
① BAS
도핑 전 H-ZSM5의 골격 구조는 Si–O–Al–O–Si이고, 여기서 Al³⁺로 인해서 골격에 음전하가 생기게 된다.
여기서 H⁺가 이 골격에 붙어서 발생한 음전하를 중화하는 역할을 하는데, 이때 이것으로 인해서 Brønsted 산점이 생성된다. 하지만 여기서 Co를 도핑하게 되면, 골격에 생긴 음전하를 중화하는 역할을 Co²⁺가 H⁺ 대신 하게 되고, 이것으로 인해 Brønsted 산점 수가 줄어든다.
② LAS
Lewis산이란, 전자쌍을 받아들일 수 있는 자리를 의미하므로, H⁺ 자리에 도핑한 Co²⁺같은 경우 양전하이면서 동시에 빈 d오비탈 역시 가지도 있다. 따라서 Co²⁺자체로도 전자쌍을 받아들이기 쉬우므로 Co²⁺자체가 강한 Lewis 산점이라고 할 수 있다.
또한, H⁺ 대신해서 Co²⁺가 들어간 Co²⁺–O–Al 배위결합이 생성되고, 여기에서 산소와 배위결합, 그리고 주변 O에 결합된 물 같은 분자와도 배위결합이 가능하다. 이때 이렇게 발생한 배위결합이 활성 Lewis site로 작동하게 된다.
③ H-ZSM5 강산의 세기
H-ZSM5에 존재하는 H⁺ 산점은 흡착물에 강력한 전하를 유도하고, C-H or C-C결합을 쉽게 양성자화 시켜서 분해한다. 따라서 H⁺ 산점은 매우 강한 산점이라고 볼 수 있다.
하지면 Co²⁺로 치환되면, Co²⁺경우 O와 배위 결합을 형성해서 전하가 분산되고, 또한 배위된 산소의 전자 밀도가 증가하며, 유기물과 결합하더라도 완전한 양성자화를 일으키지 않는다.
이렇게 보았을 때, Co²⁺의 경우 이전 H⁺가 도핑 되었을때에 비해 산 세기가 감소하게 된다.
④ Coke
Brønsted H⁺ 산점의 경우 강한 카르보늄 이온을 생성하고 이것으로 인해 반응이 과도하게 발생하여서 코크의 생성이 증가한다.
하지만, Co Lewis의 경우 위에서 언급하였듯이 산도가 H⁺에 비해 약하므로 강한 카르보늄 이온이 형성되지 않아서 반응이 이전과 다르게 과도하게 발생하지 않아 코크의 밀도가 감소한다.
⑤ Redox
Co의 경우 다음과 같은 전환이 쉽게 가능하다.
Co²⁺ ⇌ Co³⁺ + e⁻
이 과정에서 e⁻, H⁺를 흡수, 방출이 가능한 REDOX성질을 가지게 된다.
2. 결론
이제 각각의 특징이 방향족 생성에 어떠한 영향을 미치는지 확인해 보자.
① 치환 위치
전이금속중 하나인 Fe와 Co의 차이점 중 하나가 바로 치환 위치이다. Fe의 경우 Al의 자리를 일부 치환이 가능하지만, Co의 경우 대부분 H⁺자리만 치환하게 된다.
이로 인해 Fe는 골격 내부에 깊이 들어가 강한 산점을 만들 수 있으며, 이것이 강한 카르보늄 이온을 생성해서 반응을 촉진시키고 BTX방향족의 수율을 증가시킨다. 하지만, Co의 경우 H⁺자리만 치환하므로, 외부 Lewis 산점만 생성한다 이 산점의 경우 위에서 언급 하였듯이, H⁺산점에 비해 산 세기가 약하므로. 반응이 Fe처럼 촉진되지 않는다. 따라서 Fe 대비 방향족의 수득률은 낮게 형성될 것임을 알 수 있지만, 코크 역시 Fe보다는 적게 발생하기 때문에 상대적으로 안정적이다.
② Redox능력
Co같은 전이금속들은 Redox 특징을 가지고 있으며, 이는 탈수소화, 고리화반응을 촉진시키고 이는 결과적으로 방향족의 수득률을 증가시킨다. 따라서 Redox가 강하면 강할수록 방향족의 수득률이 증가할 수 있음을 알 수 있다.
그러면 위의 언급된 방향족인 Fe 와 Co를 아래의 두가지 주제를 통해서 비교해보자.
③ d-오비탈의 전자배치
Fe³⁺와 Co³⁺의 d오비탈 전자배치는 다음과 같다.
Fe³⁺ : [Ar] 3d⁵
Co³⁺ : [Ar] 3d⁶
여기서 Fe³⁺의 경우 d오비탈 5개에 각각 하나씩 전자가 들어간 상태로 매우 안정적인 형태이다.
하지만, Co³⁺의 경우 6번째 전자가 하나의 오비탈에 반대스핀으로 형성되어 들어가므로, 이 상태에서 전자반발이 커지며, Fe³⁺에 비해 불안정하다.따라서 Fe³⁺가 Co³⁺보다 더 안정하므로, Fe²⁺ → Fe³⁺반응이 더 쉽게 반응하므로, 결과적으로 redox이동이 Co³⁺에 비해 잘 일어난다고 볼 수 있다.
④ π-배위(π-complex) 안정화 능력
Fe³⁺와, Co²⁺같은 전이금속의 경우 비어있는 d-오비탈과 전자 부족 상태로 인해 . π-전자를 받아들이려는 성향이 강해서 불포화 탄화수소의 π-전자를 가지고 오려고 하며, 이 과정에서 탄화수소를 촉매 표면에 흡착시키고 구조를 고리화가 유리한 방향으로 재배열시키는 역할을 한다. 이때, Fe³⁺가 Co²⁺보다 전자가 부족해서 전자를 받기만 하면서, 더 많은 불포화 탄화수소의 π-결합을 쉽게 활성화, 분해시키는 경향이 있다.따라서 Fe³⁺의경우 안정성이 떨어지지만, Redox 활성화가 매우 잘 된다. 반대로 Co의 경우 Fe보다는 안정화능력이 뛰어나다.
따라서 Co를 도핑하게 되면 전이금속이기때문에 redox이동으로 인해 방향족의 수득률은 H-ZSM5보다 증가하지만, Fe와 비교하면 치환 위치 redox 세기 등으로 인해서 방향족이 적게 생성이 된다. 하지만, Fe처럼 과도한 반응은 일어나지 않으므로, 코크의 생성이 적게 되기 때문에 촉매 자체의 안정성은 Fe대비 높다.
Ni
① BAS
Ni 또한 Fe와 마찬가지로 BAS가 감소한다. 그러나 Ni은 Fe 와는 다르게 H⁺ 대신 Ni²⁺ 가 도핑 되는 형식이다. 즉 Fe는 기존 골격인 Si 자리에 대체되었지만 Ni은 H⁺ 자리에 들어간다.
그래서 Fe-HZSM5 대비 O-H 결합의 세기가 더 약하다.
Ni-HZSM5 : Si–O(–Al)–Ni–(OH)
Fe-HZSM5 : Si–O–Fe–O–Si
위의 Fe 부분에서 정리한 골격구조와 Ni 도핑시의 구조이다. Fe-HZSM5는 O-H 결합이 보이지 않는데 그 이유는 Fe-HZSM5는 골격치환(Al자리에 Fe), 이온교환(H⁺자리에 Fe)이 동시에 일어나기 때문이다.
결론적으로 Fe-HZSM5 의 경우에는 골격치환을 메인으로 두가지 방식의 도핑으로 진행되기 때문에 BAS(H⁺)가 적당량 감소된다. 하지만 Ni-HZSM5의 경우에는 Ni²⁺ 가 H⁺자리에 들어가는 이온교환법으로만 진행된다. 그렇기 때문에 Ni²⁺ 가 도핑될 때마다 BAS가 2배로 감소하게 되고 Fe에 비해 BAS 감소량이 더 크다.
Ni²⁺는 또한 전하밀도가 높다. 그래서 전자쌍을 끌어당기는 힘이 더 강하고 Al-O 결합 분극이 달라지기 때문에 도핑되지 않고 남아있는 H⁺가 있더라도 산의 세기가 약해진다.
② LAS
Ni 도핑을 하고 나면 가장 큰 변화를 보이는 것 중 하나가 LAS 증가이다.
Ni²⁺는 d⁸ 전자구조이고 빈 d-오비탈 존재 따라서 전자쌍 받는 Lewis acid site 로 적합하다.또 제올라이트의 산소와 결합하면서 Ni–O–Al 또는 Ni–O–Si 형태의 배위자리를 만들게 되고 이 자리가 전자쌍을 받을 수 있다.
철의 경우에는 대표적으로 Fe³⁺ 같은 LAS 가 생겼는데 Ni을 도핑한 경우에는 Ni²⁺–O–Al, NiOH⁺ , NiO⁺ fragment 와 같은 LAS가 나타난다.
결론적으로는 Ni를 도핑하면 LAS 수 증가와 더불어 더 강한 강도의 LAS가 생긴다.
③ Redox
BAS 감소, LAS 증가 와 더불어 Fe 처럼 Ni는 Redox 능력 또한 가지게 된다.
아래와 같은 방식으로 Redox site가 생기는데
Ni²⁺ ⇄ Ni⁰
이 Redox 능력은 Fe 처럼 강하지는 않다.
④ 결론
결론적으로 Ni는 Fe와 마찬가지로 BAS 감소, LAS 증가, Redox 능력 을 통해 방향족 화합물을 생성하는데 도움을 준다. 하지만 Fe 와 다른 방식의 도핑으로 인해 Fe에 비해 BAS 감소량이 더 크다.
LAS에 대해서는 Fe-HZSM5의 경우 Fe³⁺ (Z=26, d⁵), Ni-HZSM5의 경우 Ni²⁺ (Z=28, d⁸)이다.
Fe³⁺ , Ni²⁺ 둘을 비교해보면
먼저 Fe³⁺ 의 경우 전자가 더 적고 전자인력이 Ni에 비해 약하다. 또한 위의 Fe 부분에서 정리했듯 Fe²⁺ ⇄ Fe³⁺ 로 변할 수 있는데 이때 LAS도 변화한다.
다음 Ni²⁺ 의 경우에는 전자를 당기는 힘이 더 강력하다. 또한 Ni 도핑 시에 Ni 금속 대부분이 Lewis acid 역할을 하게 된다. 그렇기에 LAS 자체의 증가 폭이 Fe에 비해 더 크다.
따라서 LAS 관점에서 방향족을 생성하는데 있어서는 Ni가 Fe에 비해 유리하다고 볼 수 있다.
마지막으로 Redox 능력까지 비교를 해보자면
Fe³⁺ ⇄ Fe²⁺ 의 과정은 매우 쉽게 일어난다. 중온에서도 일어나며 속도 또한 빠르다. O-H, C-H 결합 활성화력 또한 매우 강한편이다.
그렇기에 Fe-HZSM5의 경우에는 탈수소화 능력이 매우 뛰어나고 산화반응 및 cracking에 뛰어나다.
이와 비교해서 Ni²⁺ ⇄ Ni⁰ 의 과정은 매우 어려운 조건에서 일어나는 반응이며 Redox 속도 또한 느리다. O-H, C-H 결합에서의 활성화 또한 그만큼 불리하다.
종합하면 Ni-HZSM5의 경우에는 Fe-HZSM5에 비해 BAS, Redox 조건에서 불리하지만 LAS의 조건에 있어서 유리하다고 확인하였다.
최종 결론
위의 표는 위에서 언급한 금속에 대해 도핑시킨 뒤 변화를 보기쉽게 쓴 테이블이다. 각 색칠한 부분은 방향족 생성물을 합성하기에 유리한 조건에 대해 표시를 해두었다.
먼저 BAS, Brønsted acid site 이다. BAS(H⁺) 는 사슬을 분해하고 공격하여 끊는 역할을 하며 촉매의 핵심 매커니즘 중 하나인 Carbenium ion 을 만드는 역할을 한다.
기존의 H-ZSM-5 의 BAS에서는 산의 세기가 적정보다 강해서 분해가 빠르고 강해서 방향족 전구체가 버티지 못하고 부서진다. 그래서 BAS를 줄여줘야 방향족 생성에 보다 유리하다.
그런데 BAS 감소율이 가장 낮은 Fe가 가장 유리하다고 표시한 이유는 위에서 언급하였듯이 너무 약한 BAS에서는 Carbenium ion 이 나오지 않기 때문에 적당히 줄은 Fe가 가장 유리하다고 볼 수 있다.
다음은 LAS, Lewis acid site 이다. LAS는 각 금속별로 Fe³⁺, Co²⁺, Ni²⁺ 이 주로 사용되었다. 이 LAS는 전자쌍을 받을 수 있는 공간으로 반응이 일어나도록 도와주는 공간과 같은 역할을 한다. 따라서 이 LAS는 많을 수록 방향족 생성에 유리하고 그에 걸맞게 Ni이 LAS에서는 가장 유리한 모습을 보였다.
다음은 Redox 능력이다. Redox 능력은 금속들을 도핑시키며 제올라이트가 새로 가지게 되는 능력이다. 여기서 Redox 능력이 높아지면 반응들이 더 활발하게 일어나고 심지어는 불포화된 분자들 또한 방향족으로 유도되기도 한다.
이중 방향족 합성에 가장 핵심이 되는 반응은 탈 수소화 반응이다. PP가 열분해 되면 Cyclohexane, Cyclohexadiene과 같은 화합물들이 나타나는데 이 화합물들의 H₂를 떼어주는 역할을 한다.
이 Redox 능력은 Fe가 가장 강한것으로 보여졌다.
마지막은 π-complex, π- 배위 안정화 능력이다. Fe³⁺, Co²⁺, Ni²⁺ 같은 전이금속은 전자 상태와 d-오비탈로 인해 π-전자를 받으려는 성질이 강하다. π-전자를 가지고 오려고 반응하며 고리화를 안정화시키고 재배열하는 역할을 한다.
따라서 이 π-complex 는 안정성에 큰 영향을 끼친다고 볼 수 있다.
위의 표와 분석을 통해 수율에 직접적인 영향을 주는 BAS, LAS, Redox 에 대해서는 Fe가 Co 에 비해 월등히 뛰어난 모습을 보였다.
그리고 Ni 또한 Co에 비해서는 불리한 조건이 없다.
그래서 세 전이 금속 중 방향족 합성에 가장 불리한 금속은 Co 로 생각되고 이는 선행연구와의 비교와도 일치한다.
Fe와 Ni 에서는 BAS, Redox 능력이 Fe가 뛰어나고 LAS에서는 Ni가 뛰어나다. 둘을 정확하게는 비교할수가 없어 둘의 수율은 다른 여러 논문을 찾아본 결과 Fe의 Redox능력이 Ni의 LAS조건보다 더 큰 영향을 끼치는 것으로 확인되었다.
위의 그래프는 Nanjing University에서 연구한 여러 전이금속 제올라이트를 통해 방향족 및 여러 화합물의 수율을 획득하고 비교한 그래프이다.
선행연구와 이번 프로젝트에서 제시한 Fe-, Ni-, Co-ZSM-5 의 순서대로 방향족 생성물 합성에 유리하다는 결론과 일치한다.
완료작품의 평가
기존 열분해 실험은 플라스틱과 촉매를 석영 앰플에 넣고 N₂로 충전 및 봉인 시킨 후 전기로에서 가열 , 이후 냉각을 시키고 앰플을 깨서 액상만 회수 하고 분석하는 방향으로 진행하려 했다. 그러나 위의 방법은 고온의 환경에서 생성된 가스에 의해 압력을 버티지 못하고 석영 앰플이 폭발할 수 있는 가능성이 있어 안전문제와 실험 성공 가능성을 높이기 위해 새로운 방법을 모색하였다.
먼저는 튜브퍼니스를 활용하여 고압의 비활성 가스를 채우고 그 안에서 고온으로 열분해를 진행시켜 남은 방향족을 포집 및 회수하는 방안으로 구상했다. 하지만 이 과정 또한 너무 시료양이 적어서 데이터가 제대로 나오지 않을 것이며 제대로 된 실험이 되지 않을 것이라는 자문을 받았다.
그래서 결론적으로 이번 프로젝트에서는 안전문제로 인해 내열비커를 카본테이프로 봉한 다음 작은 크기의 구멍을 뚫어 폭발을 방지했다. 그리고 오븐 내부의 가스를 채워 최대한 방향족 생성물이 날아가지 않도록 했고 남은 생성물을 회수해 프로젝트의 결과물로 사용하였다. 결과적으로는 방향족 수율을 완벽하게 측정할 수 없었지만 방향족 생성물 자체를 확인했고 회수한 생성물을 통해서라도 경향비교를 하였다. 이에따라 본 프로젝트의 목적인 선행연구의 타당성 검증을 위해서 금속도핑된 제올라이트로 열분해 하는 실험은 관련 논문을 분석하는 방향으로 진행하였다.
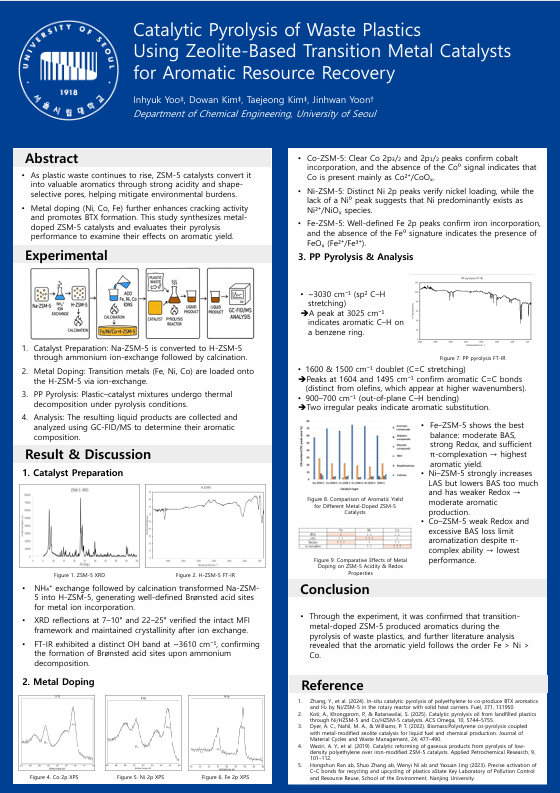
포스터
참고 문헌
1. Zhang, Y., et al. (2024). In-situ catalytic pyrolysis of polyethylene to co-produce BTX aromatics and H₂ by Ni/ZSM-5 in the rotary reactor with solid heat carriers. Fuel, 371, 131950. https://doi.org/10.1016/j.fuel.2024.131950
2. Koti, A., Khongprom, P., & Ratanawilai, S. (2025). Catalytic pyrolysis oil from landfilled plastics through Ni/HZSM-5 and Co/HZSM-5 catalysts. ACS Omega, 10, 5744–5755.
3. Dyer, A. C., Nahil, M. A., & Williams, P. T. (2022). Biomass:Polystyrene co-pyrolysis coupled with metal-modified zeolite catalysis for liquid fuel and chemical production. Journal of Material Cycles and Waste Management, 24, 477–490. https://doi.org/10.1007/s10163-021-01334-0
4. Waziri, A. Y., et al. (2019). Catalytic reforming of gaseous products from pyrolysis of low-density polyethylene over iron-modified ZSM-5 catalysts. Applied Petrochemical Research, 9, 101–112. https://doi.org/10.1007/s13203-019-0230-4
5. Hongshun Ran ab, Shuo Zhang ab, Wenyi Ni ab and Yaxuan Jing (2023). Precise activation of C–C bonds for recycling and upcycling of plastics a State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University,
Evolution of Fe Sites in Conversion of CO2 to Methanol to Aromatics in Tandem H-[Fe]-ZSM-5/ZnO-ZrO2 Catalysts(2024) Dhrumil R. Shah, Atticus Tucker, Zhenhua Xie, Jingguang G. Chen and Christopher W. Jones
6, Kantarelis, E., Javed, R., Stefanidis, S., Psarras, A., Iliopoulou, E., & Lappas, A. (2019). Engineering the catalytic properties of HZSM5 by cobalt modification and post-synthetic hierarchical porosity development. Topics in Catalysis, 62, 773–785.
7,“Redox switches” of Fe species on zeolite catalysts: Modulating the acidity and the para-xylene yield from methanol Qiongfang Hu1,#, Hongmei Wang1,#, Chaojie Cui1 (), Weizhong Qian1,2 (), 2023
8, Zholobenko, V., Freitas, C., Jendrlin, M., Bazin, P., Travert, A., & Thibault-Starzyk, F. (2019). Probing the acid sites of zeolites with pyridine: quantitative AGIR measurements of the molar absorption coefficients. Journal of Catalysis, 370, 258–269.
9, Kiricsi, I., Flego, C., Pazzuconi, G., Parker, W. O., Jr., Millini, R., Perego, C., & Bellussi, G. (1994). Progress toward understanding zeolite β acidity: An IR and 27Al NMR spectroscopic study. Journal of Physical Chemistry, 98, 4627–4637.
10. Impact of Metal Impregnation of Commercial Zeolites in the Catalytic Pyrolysis of Real Mixture of Post-Consumer Plastic Wasteby (24 February 2024) Marco F. Paucar-Sánchez,Mónica Calero,Gabriel BlázquezORCID,Rafael R. SolísORCID,Mario J. Muñoz-Batista *ORCID andMaría Ángeles Martín-Lara *ORCID
11. 대한민국특허청(KR) : 등록특허 10-0925851
12. 대한민국특허청(KR) : 등록특허 10-1130337
13. 대한민국특허청(KR) : 등록특허 10-1849296
14. Optimization of process parameters of catalytic pyrolysis using natural zeolite and synthetic zeolites on yield of plastic oil through response surface methodology (18 November 2024) Pitchaiah Sudalaimuthu, Usman Ali & Ravishankar Sathyamurthy
15.혼합 폐플라스틱 열분해 유화 처리용 제올라이트계 촉매 개질과 활용기술 (2011년 4월 15일) 한국과학기술정보연구원 전문연구위원 민병일