촉매연구소
프로젝트 개요
기술개발 과제
국문 : 태양광 물분해 반응의 수소 생산 증대를 위한 아연 기반의 광촉매 개발
영문 : Development of zinc based photocatalyst for enhanced hydrogen evolution from solar water splitting
과제 팀명
촉매연구소
지도교수
김정현 교수님
개발기간
2024년 9월 ~ 2024년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20193400** 한*준(팀장)
서울시립대학교 화학공학과 20213400** 하*서
서론
개발 과제의 개요
개발 과제 요약
◇ 탄소 중립을 위한 친환경 수소 에너지 기술 연구 개발의 필요성이 증가하였다.
◇ 황화아연(Zinc sulfide, ZnS) 합성 방법을 달리하여 입자의 형태 및 크기 조절을 진행한다.
◇ 전이금속의 도핑을 추진, 해당 물질을 탐색하고 수소 생산 증대를 목표로 최적화를 진행한다.
◇ UV-Vis spectroscopy, SEM, PL spectroscopy, Band gap 측정 등 다양한 분석을 통해 최적화된 광촉매의 특성 및 메커니즘을 분석한다.
개발 과제의 배경
◇ 탄소중립의 필요성
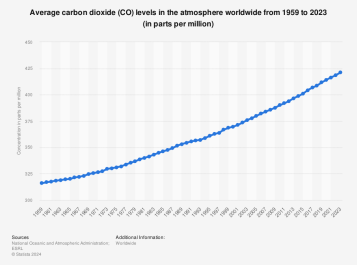
인류문명은 화석연료의 에너지로부터 이룩되었다. 석탄 및 석유를 포함한 화석연료는 다양하게 활용되어 증기기관을 가동했고 산업혁명의 단초를 제공했다. 그러나 화석연료의 사용에 따라 배출되는 이산화탄소의 양은 매년 증가하여 2023년 기준 약 510억톤에 달했다. 그림1에 따르면 산업화 이후 대기 중의 이산화탄소 농도는 계속 증가함을 알 수 있다.
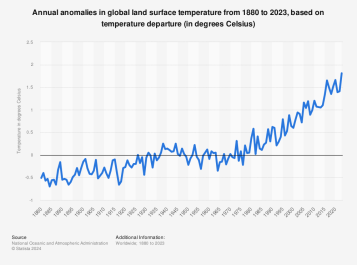
그림2에 의하면 1880년 이후 매년 전 세계 토지 온도는 전반적으로 상승하는 추세를 보인다. 2023년 전 세계 지표면 온도는 1901년부터 2000년까지 전 세계 평균보다 섭씨 1.81도 높았다. 이는 해당 기간 동안 기록된 연간 기온 이상 현상 중 가장 높은 수치다. 전 세계 해수면 온도의 이상 현상은 같은 기간 동안 비슷한 추세를 보였다.
이산화탄소는 지구온난화를 일으키는 가스 중 하나로 복사열을 늘려 지구 평균 지표면 온도를 상승시킨다. 기후변화에 관한 정부 간 협의체(Intergovernmental Panel on Climate Change, IPCC) 보고서에 따르면 지구온난화 수준이 섭씨 1.5도를 초과하게 되면 기후 재난의 일상화로 돌이킬 수 없는 수준의 피해가 예상된다고 한다. 산업화 이후 지구온난화 수준은 섭씨 1.1도 높아진 상태이므로 탄소배출 억제가 필수적임을 알 수 있다.
◇ 수소 생산의 효율 증대
2021년 우리나라는 2050 탄소중립 시나리오를 발표했다. 이산화탄소 감축을 위해 화력발전을 전면 중단하고 수송부문은 전기/수소차 등으로 전환한다. 또한 그린수소를 사용하여 이산화탄소를 포집 및 활용하려는 계획을 세웠다. 이처럼 기후변화와 환경오염으로 인해 친환경 에너지 전환에 대한 움직임이 커지고 있다. 그중 수소는 연소 후에도 잔여물로 물만 배출하기 때문에 보다 친환경적이고 고갈되지 않는 에너지원으로 주목받고 있다. 이러한 수소를 생산하는 방법 중 하나로 ‘태양광 물분해’ 기술이 차세대 수소 생산 기술로 꾸준히 연구되고 있다. 따라서 태양광을 이용해 효과적으로 물을 분해하여 수소 생산 효율을 높이는 것이 중요한 과제로 대두되고 있다.
◇ 광촉매 활용
광촉매는 빛을 에너지원으로 하여 태양에너지를 화학에너지로 변화시킨다. 특히 물 분해 반응을 이용하는 광촉매는 태양광을 사용해 물을 분해하여 그린수소를 생산할 수 있어 주목받고 있다. 자연에 풍부하고 지속가능한 태양에너지와 물을 사용하여 수소를 배출한다는 점에서 중요하다. 수소 에너지를 활용해 탄소 포집, 활용 및 저장 기술(Carbon Capture, Utilization and Storage, CCUS) 등 여러 차세대 기술이 개발되고 있는 시점에서 광촉매를 사용한 효율적인 수소 생산 연구에 관해 관심이 집중되고 있다. 따라서 본 연구에서는 다양한 방법으로 광촉매를 합성하여 수소 생산의 효율을 극대화하는 광촉매를 개발하려 한다.
개발 과제의 목표 및 내용
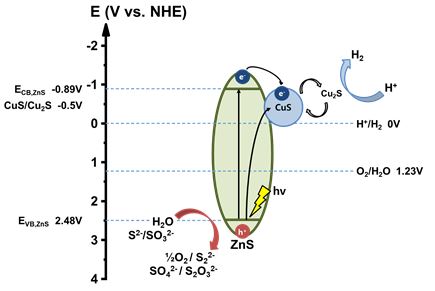
◇ 광촉매의 수소 생산 원리는 다음과 같다. 빛에너지가 가해질 때 가전자대(valence band)에 위치하던 전자가 전도대(conduction band)로 이동하고 valence band에는 정공이 생긴다. 이때 정공에 의하여 물이 산화되는데 산소 기체와 수소 이온이 발생한다. 또한 conduction band로 이동한 전자가 수소 이온을 환원시키면서 수소를 만들어낸다. 이렇게 수소를 생성하는 광촉매의 활성에 가장 큰 영향을 미치는 요인은 band position이다. valence band의 전위가 물 분해 반응의 전위인 +1.23V보다 클 때 광촉매에 의한 물 분해 반응이 일어날 수 있고 conduction band의 전위가 수소 이온의 환원전위인 0V보다 작을 때 광촉매에 의한 수소 생산이 가능하다. 본 연구에서 사용하고자 하는 황화아연(zinc sulfide, ZnS)의 경우 valence band의 위치가 약 +1.8V, conduction band의 위치가 약 –1.8V이므로 물 분해 반응, 수소 환원 반응으로 수소 생산이 가능한 적합한 소재이다.
◇ 앞서 설명한 ZnS의 band gap은 약 3.6eV로 약 350nm의 자외선에 해당하는 파장을 흡수할 때 전자 정공 쌍이 생성되어 물 분해 반응이 일어날 수 있다. 그러나 자외선은 지표에 입사되는 태양광의 약 5%에 불과하므로 95%의 태양광을 이용하지 못해 비효율적인 수소 생산을 하게 된다. 이를 해결하기 위해 doping, heterojunction, heterostructure, oxidation, morphology의 변화 등 다양한 방법이 연구되고 있다. 그중 heterojunction 및 heterostructure는 두 가지 이상의 물질을 붙여 band gap을 조절하는 방법이다. 이때 서로 다른 물질의 접점에서 band gap의 겹침, 휘어짐 등의 변화가 생기며 band gap이 감소하거나 전자-정공 쌍의 재결합을 줄여줄 수 있어 많이 사용되는 방법이다. 한편 morphology의 변화는 기존 물질의 합성 방법 등을 달리하여 입자의 모양이나 크기 등을 조절하는 방법으로 active site 및 표면적의 변화를 주어 효율적인 반응이 진행되도록 한다. 본 과제에서는 구리, 아연, 황의 세 가지 전구체를 수열합성법 및 이온교환반응을 이용해 hollow 구조의 ZnS-CuS heterostructure를 제작한다. 구리의 도핑 농도 변화 등을 변수로 두어 수소 생산의 최적화를 진행할 예정이다.
◇ 수소 생산의 성능은 크게 수소 생산량과 stability로 확인할 수 있다. 광촉매를 물에 균일하게 분산시키고 solar simulator에 중위도 태양 빛과 같은 AM1.5G filter를 장착한 빛을 사용하여 물분해 반응을 진행한다. 이때 생성되는 수소의 양을 gas chromatography를 사용해 측정한다. 기체 양이 면적으로 표시되기 때문에 reference를 측정해 mol %로 calibration한다. 환산된 mol %와 이상기체 방정식을 이용해 수소량(mol/g/h)을 구할 수 있다. 수소량을 확인하여 광촉매의 생산량을 평가한다. 또한 일정 시간 간격으로 새로 질소를 purging 하며 수소 생산 실험을 반복적으로 수행함으로써 광촉매의 내구성을 확인한다. 여러 번의 시간 동안 같은 성능을 유지할수록 촉매의 내구성이 뛰어나다고 볼 수 있다.
◇ 또한 촉매의 활성 메커니즘 및 특성을 분석하기 위해 UV-vis spectroscopy(UV-Vis), Tauc analysis, SEM, photoluminescence(PL) spectroscopy, Mott-schottky plot 등을 방법을 사용하며 이를 통해 Band gap, 격자 내 결함, 흡광도 등을 측정함으로써 해당 광촉매의 특성 및 수소 발생 효율이 증가하게 된 원인을 분석한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
- 전 세계적인 기술현황
◇ Heterostructured metal sulfide (ZnS–CuS–CdS) photocatalyst for high electron utilization in hydrogen production from solar water splitting[2]
- Eunpyo Hong(2014)의 논문에서는 ZnS-CuS-CdS의 광촉매를 설계하였다. 금속 황화물은 적절한 띠 간격 에너지 및 촉매 활성의 특징을 지니고 있어 광촉매 물질로써 유망하다. 그 중에서도 ZnS는 전자-정공 쌍의 생성 속도가 빠르고 높은 음전하 전위를 갖고 있지만 상대적으로 넓은 띠 간격(3.35eV)으로 인해 가시광선 활용에 있어서 한계가 있다. 따라서 ZnS를 기본 물질로 하여 CuS와 CdS을 순차적으로 합성해 복합 화합물(ZnS–CuS–CdS)을 생성한다. 이때 ZnS는 콜로이드 침전법, CuS는 양이온 교환 반응, CdS는 이온 반응을 통해 결합한다. CuS를 ZnS 표면에 합성하면 interfacial charge transfer의 영향으로 ZnS의 valence band에서 CuS로의 전자가 이동하며 전자-정공 재결합이 억제되며 CuS가 active site로써 작용하게 된다. 또한 CdS는 band gap 에너지가 2.45eV로 ZnS에 비해 상대적으로 작아 합성한 광촉매의 가시광선 흡수를 증가시킨다. 따라서 CdS는 ZnS 표면에 형성되어 가시광선 영역의 빛 흡수를 높이게 된다.
CuS의 경우 0.33 wt%일 때 가장 높은 수소 생산 속도인 210.6 mmol/(g·h)를 보였다. 또한 Cd의 최적 농도가 24.2 wt%일 때 수소 생산 속도는 208 mmol/(g·h)에 달한다. ZnS–CuS–CdS 시스템의 수소 생산 속도는 최고 837.6 mmol/(g·h)이며 이는 단일 ZnS와 비교했을 때 뛰어난 성능임을 알 수 있다.
◇ One-Pot Template-Free Synthesis of Monodisperse Zinc Sulfide Hollow Spheres and Their Photocatalytic Properties[4]
- Xiaoxiao Yu(2009)의 논문에서는 온도와 반응 시간별로 수열합성법을 통해 균일 크기의 ZnS hollow 구조를 합성하였다. ZnS hollow의 합성은 아세트산 아연과 thiourea를 전구체로 사용했으며 이를 통해 약 200nm 직경의 hollow 형태를 갖는 입자가 높은 수율로 합성된다. 합성 온도가 증가함에 따라 ZnS의 band gap 에너지는 감소했는데 이는 작은 크기의 결정이 더 높은 산화 환원 잠재력을 갖는다는 것을 알 수 있다. UV 빛 아래에서 hollow 구조는 OH 자유 라디칼이 아닌 photogenerated hole이 직접 광촉매 반응에 참여한다.
뿐만 아니라 hollow 구조는 높은 표면적과 우수한 표면 투과성 및 균일한 특성을 지녀 반응 물질의 흡착을 최적화하여 일반 구조의 ZnS보다 높은 광촉매 활성을 보인다.
◇ Controllable hydrothermal synthesis of hollow ZnS nanospheres: Morphological evolution mechanism and photocatalytic performance[1]
- Shao Hui Xu(2024)의 논문에서는 ZnS hollow 구조의 형성 메커니즘과 광촉매를 이용한 유기물 분해 성능을 분석했다. ZnS는 II-VI족 반도체로서 뛰어난 광전기적 특성이 있고 응용 가능성이 넓어 주목받고 있다. 본 논문은 Polyvinylpyrrolidone(PVP)과 과량의 thiourea를 이용한 수열합성법으로 균일하고 잘 분산된 ZnS hollow 나노구조를 합성하였다. hollow 구조는 높은 비표면적과 낮은 밀도를 갖는다. 이때 thiourea의 농도 증가에 따라 ZnS는 구형 입자에서 hollow 구조로 바뀌었다. PVP는 입자들이 고르게 성장하도록 하는 steric hindrance 효과를 통해 분산성과 크기 균일성을 향상시키는 역할을 한다.
이렇게 합성된 광촉매의 성능은 RhB 분해 실험을 통해 평가하였다. thiourea의 양이 증가하고 PVP가 첨가될수록 우수한 분해 효율을 보였으며 성능이 가장 좋았던 90nm 크기의 ZnS hollow 구조는 300분 내에 RhB를 95.6% 분해하는 성능을 보였다.
- 특허조사 및 특허 전략 분석
◇ 중공구조를 가지는 광촉매 입자, 그 제조방법, 이를 포함하는 코팅 조성물, 상기 코팅 조성물에 의한 강판 및 강판의 코팅방법[19]
- 출원번호: 10-2015-0181915
- 요약
- 본 발명은 중공구조의 TiO₂ 입자, 그 제조방법 및 상기 중공 구조의 TiO₂ 입자를 포함하는 수지 코팅강판과 그 제조방법을 제공하며, 상기 중공구조의 TiO₂ 입자 제조방법의 일 구현 예시는 스티렌 입자를 메틸메타크릴레이트, 메틸아크릴산 또는 이들의 혼합물의 아크릴레이트와 반응시켜 스티렌 입자의 표면을 아크릴레이트로 개질하는 표면개질된 스티렌 입자를 얻는 단계, 상기 표면개질된 스티렌 입자를 용매 및 TiO₂ 전구체와 혼합하고 반응시켜 상기 표면 개질된 스티렌 입자 상에 TiO₂ 층을 형성하여 코어-쉘 구조의 스티렌-TiO₂를 제조하는 단계, 및 상기 스티렌- TiO₂로부터 스티렌 코어를 제거하여 중공 구조의 TiO₂ 입자를 얻는 단계를 포함한다.
본 발명에 따르면 물 분해를 통한 수소 생산에서는 더 많은 빛 에너지를 흡수할수록 광활성도가 높아진다. 중공 구조를 사용하면 동일한 입자 크기에서도 더 많은 빛이 반응에 참여할 수 있기 때문에 수소 생산량이 증가하게 된다. 중공 구조는 전자와 정공의 분리 및 전자 이동 경로에 영향을 줄 수 있어 전하 재결합을 억제하는 데 도움이 된다. 물 분해 반응에서 전자-정공 쌍의 재결합이 억제되면 전자는 물과 반응하여 수소를 생성할 가능성이 높아진다. Cu 도핑과 중공 구조를 병행하여 전하 재결합을 더욱 효과적으로 억제한다면 수소 생산 효율을 극대화할 수 있다.
◇ ZnS-ZnO 광촉매의 제조방법 및 이에 의해 제조된 ZnS-ZnO 광촉매[20]
- 출원번호: 10-2006-0077137
- 요약
- 본 발명은 ZnS-ZnO 광촉매의 제조방법 및 이에 의해 제조된 ZnS-ZnO 광촉매에 관한 것으로, 특히 가시광선을 제한적으로 흡수하는 ZnO에 제2의 반도체 물질을 첨가하여 공침법으로 ZnS-ZnO 복합광촉매를 제조함으로써 반응체의 가시광 흡광도를 현저히 향상시킬 수 있고, 가시광선 하에서 오염물질들을 효율적으로 제거할 수 있으며, 가시광선 하에서의 수소생산, 공기정화 등에 응용할 수 있는 ZnS-ZnO 광촉매의 제조방법 및 이에 의해 제조된 ZnS-ZnO 광촉매에 관한 것이다.
ZnS는 단파장으로 높은 에너지의 빛을 흡수하는 특성을 갖고 있다. ZnO와 결합하면 가시광선 영역에서도 광흡수를 할 수 있게 된다. 가시광선 흡수 범위가 넓어지면 태양광 에너지를 더 효율적으로 사용할 수 있다. 이는 자연광을 이용한 물 분해 반응을 통해 수소 생산을 가능하게 하기 때문에 실외 조건에서도 촉매를 효율적으로 활용할 수 있게 된다. ZnS-ZnO 복합체에 추가로 Cu나 다른 금속을 도핑하여 전자 이동을 촉진하고 반응성을 높일 수 있다. Cu를 도핑하면 전하 이동 속도를 더욱 향상시킬 수 있으므로 ZnS-ZnO 복합체에 금속을 도핑하여 수소 생산 성능을 극대화할 수 있다. 이를 통해 복합 광촉매의 효율을 극대화할 수 있으며 수소 생산 효율이 크게 향상시킬 수 있다.
◇ 전이금속 도핑 이산화티탄 광촉매의 제조방법[21]
- 출원번호: 10-2013-0029336
- 요약
- 본 발명은 전이금속 도핑 이산화티탄 광촉매의 제조방법에 관한 발명이다. 본 발명의 전이금속 도핑 이산화티탄 광촉매의 제조방법은 이산화티탄 수용액에 전이금속의 염화물을 첨가하고 이를 밀링한 후 여기에 치환금속을 첨가하고 이를 다시 밀링한다. 그리고 이러한 혼합물을 원심분리기로 원심분리하여 전이금속 도핑 이산화티탄 광촉매를 수득한 후 이를 건조하여 제조한다. 본 발명은 전이금속을 이산화티탄 광촉매에 도핑하여 가시광선 영역에서도 광촉매 반응을 일으킬 수 있다. 또한 이러한 전이금속의 도핑에도 불구하고 이산화티탄 광촉매의 형태에 변형이 생기지 않는 이산화티탄 광촉매를 제조함으로써 가시광선하에서 광촉매의 반응성이 우수한 이산화티탄 광촉매를 제공한다.
순수한 이산화티탄()은 주로 자외선 영역에서만 활성화되지만 구리와 같은 전이금속을 도핑하면 가시광선 영역으로 흡수 범위가 확장된다. 이는 태양광을 활용한 물 분해 반응에 활용되어 환경 친화적인 수소 생산에 기여할 수 있다. 전이금속 도핑은 이산화티탄의 전자-정공 재결합 속도를 낮추는 역할을 한다. 이는 전자 이동을 촉진해 전자와 정공이 분리된 상태를 유지하게 만들어 재결합을 줄여준다. 구리와 같은 금속 도핑은 이산화티탄 표면에서 전자 밀도를 변화시켜 반응성을 높아지게 한다. 보다 낮은 에너지 조건에서도 활성화가 가능해 촉매 효율을 증가시키고 반응 속도를 개선하여 다양한 환경에서 효율적으로 사용할 수 있게 된다. 뿐만 아니라 전이금속 도핑은 이산화티탄의 내구성을 높여 반복적인 반응 사이클에서도 촉매 성능이 유지될 수 있도록 도와준다.
- 특허전략
◇ 신규성 확보
- 기존 수소 생산 기술 특허 중 가시광을 이용한 광촉매에 대한 특허는 대부분 나 ZnO에 집중되어 있다. ZnS와 같은 황화물 기반의 광촉매는 기존 특허에서 거의 다루어지지 않았기에 신규성 확보에 유리하다. 뿐만 아니라 Cu를 도핑한 hollow 구조의 ZnS는 독특한 소재와 구조적 특성을 바탕으로 한다. 따라서 이러한 신규성을 바탕으로 특허를 주장할 수 있다.
◇ 진보성 확보
- Cu의 도핑은 수소 생산 효율 측면에서 우수한 성능을 보인다. 전자와 정공 재결합 억제와 더불어 ZnS hollow 구조의 높은 비표면적은 수소 생산을 극대화할 수 있다. 기존 광촉매 대비 효율이 더 높다는 점에서 진보성을 주장할 수 있다.
따라서 Cu 도핑된 ZnS hollow 구조의 제조 방법으로 인해 얻어질 수소 생산 특성에 대해 상세히 서술해야 한다. Cu 도핑 농도 변화에 따른 수소 생산량 변화를 비교하는 실험, 가시광 활성도와 안정성 실험 등 다양한 조건에서의 수소 생산 성능 데이터를 확보하여 Cu 도핑된 ZnS hollow 구조가 기존 촉매 대비 우수하다는 것을 입증해야 한다. 또한 최적의 수소 생산 성능을 가진 Cu 농도 조건 등을 규명하는 연구를 병행하여야 한다. 본 특허 전략을 통해 독창성과 진보성을 동시에 확보해 가시광을 이용한 수소 생산용 Cu 도핑 ZnS hollow 구조 광촉매의 독자적인 기술적 가치를 확보할 수 있을 것이다.
개발과제의 기대효과
기술적 기대효과
본 연구에서는 광촉매 물질로 적합한 특징을 갖는 ZnS에 구리를 도핑하여 band gap을 조절하는 과정을 통해 가시광선 영역의 빛 흡수를 증가시킨다. heterojunction 구조를 통해 전자와 정공의 재결합을 막는다. 따라서 광촉매의 수소 생산 능력 향상을 확인하고 변수와 결과와의 관계를 살펴본다.
◇ 수소 에너지 생산 광촉매를 통해 수소가 생산되는데 이 수소를 에너지원으로 사용할 수 있다. 현재 수소는 많은 양을 장기간 저장하는데 용이하며 유해물질을 배출하지 않아 차세대 재생 에너지로 주목받고 있다. 광촉매의 성능을 향상하여 수소 생산의 효율을 높이는 것은 해마다 증가하는 수소 에너지 수요에 대한 해결책이 될 수 있다. ◇ 유해물질 분해 광촉매는 물분해 반응을 통해 수소를 생산하는 것 뿐만 아니라 유기성 오염물질을 분해하기도 한다. 광촉매 나노 구슬에 자외선이 닿게 되면 오염물질이 파괴되어 수증기 등으로 배출된다. 광촉매는 그 성능이 입증되어 수처리 분야 등에 상용화되어있다. 지속적인 연구를 통해 다양한 분야에 적용될 수 있으리라 기대한다.
경제적, 사회적 기대 및 파급효과
◇ 탄소 중립 지구온난화가 가속화됨에 따라 선진 각국 기업에서는 화석연료를 대체할 교통수단 개발에 박차를 가하고 있다. 중국은 2025년까지 수소차를 10만대까지 늘리기로 했다. 우리나라 환경부는 ‘제6차 수소경제위원회’에서 ‘수소전기자동차 보급 확대 방안’을 발표하며 2030년까지 수소차 30만대를 보급하고 수소충전소는 660기 이상을 구축하기로 했다. 또한 BMW는 연례 기자회견에서 2020년대 중반 이후까지 수소차 판매 비중을 확대할 것이라고 발표했다. 이렇게 수소차 산업이 활성화되면 수소 제조 및 공급이 관건이 될 것이다. 그러나 2016년 기준으로 전체 생산 수소의 약 96%는 이산화탄소를 생성하며 제조된다. 본 연구에서는 향상된 수소 생산 능력을 가진 광촉매 개발을 통해 태양광 에너지를 효율적으로 사용하는 법을 다룰 것이다. 이 과정에서 발생한 그린수소를 상용화하면 수소차 산업에 기여함과 동시에 경제적, 산업적 측면에서도 긍정적인 효과를 기대할 수 있을 것이다.
기술개발 일정 및 추진체계
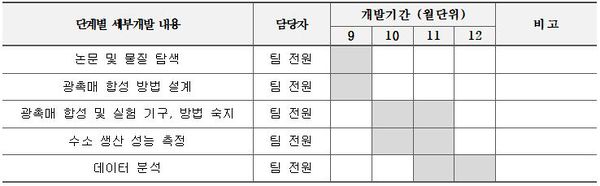
개발 일정
구성원 및 추진체계
◇ 9월: 논문 학습 및 이론 숙지를 통한 광촉매 물질 탐색 (팀 전원)
◇ 10월: CuZnS 광촉매 합성 및 Gas chromatography를 통한 수소 생산량 측정 (팀 전원)
◇ 11월: UV-vis spectroscopy 장비를 통해 Absorbance 측정 (팀 전원)
◇ 12월: 데이터 분석 및 결론 도출 (팀 전원)
설계
목표 달성을 위한 실험 방법
Materials
ZnS를 합성하기 위한 아연, 황, 분산제로 zinc acetate dihydrate(Zn(Ac)2∙2H2O, 99%, SAMCHUN), thiourea(CH4N2S, >99.0%, Sigma Aldrich), polyvinylpyrollidone(PVP, average Mw=40000, Sigma Aldrich)가 사용되었다. CuS 이종접합을 위한 구리 전구체로 copper nitrate trihydrate(Cu(NO3)2∙3H2O, Sigma Aldrich)가 사용되었다. 수소 생산 평가 단계에서 희생 시약(sacrificial agent)으로 sodium sulfide nonahydrate (Na2S·9H2O, >98%, Sigma Aldrich)와 sodium sulfite (Na2SO3, 97.0%, SAMCHUN)를 사용하였다. 반응 용매 및 수소 생산 평가의 용매로 증류수(DI water, resistivity >18 MΩ)와 Ethanol(C₂H₅OH, 99.5%, SAMCHUN)을 사용하였다.
Synthesis of uniform sized ZnS
Xu et al.[1]의 결과를 참고하여 균일한 크기의 ZnS 입자를 합성하였다. Hydrothermal method를 사용하였으며 160mL의 증류수에 1.4049g zinc acetate dihydrate와 17.5334g thiourea를 녹여 투명한 용액이 될 때까지 교반하고 4.8g의 PVP를 첨가해 완전히 녹을 때까지 교반하였다. 이후 200mL 용량의 테플론 라이너에 담은 후 오토클레이브에서 5℃/min의 속도로 상승 후 140℃의 온도에서 5시간 동안 열처리하였다. 이후 상온에서 식히고 물과 에탄올을 이용해 3차례 4000rpm, 20분 동안 원심분리를 진행해 세척하고 60℃ 오븐에서 밤새 건조하였다.
ZnS-CuS heterojunction via cation exchange
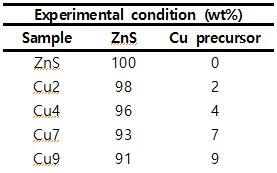
ZnS-CuS 이종접합 구조를 합성하기 위해 Hong et al.[2]의 합성 방법을 참고하였다. 먼저 앞서 합성된 ZnS 입자 0.2g을 15mL 에탄올에 넣은 후 1시간 동안 초음파분산을 진행하여 흰색의 탁한 용액(용액1)을 만들었다. 한편 일정 비율의 copper nitrate trihydrate를 5mL 에탄올에 녹여 투명한 연파랑 색의 용액(용액2)을 만들었다. 이후 용액1에 용액2를 dropwise로 떨어뜨리고 10분간 강하게 교반하였다. 이후 물을 이용해 3차례 4000rpm, 20분 동안 원심분리를 진행해 세척하고 60℃ 오븐에서 밤새 건조하였다. 이때 사용된 copper precursor의 양과 샘플의 이름은 아래 표 1에 제시하였다.
Photocatalytic hydrogen production
합성된 광촉매의 수소 생산을 평가하기 위해 뚜껑이 수정판으로 된 250mL의 pyrex 반응기를 사용하였다. 합성한 ZnS-CuS 광촉매 0.01g을 15mL 증류수에 15분간 초음파 분산하고 희생시약을 첨가하여 총 60ml의 0.35M Na2S·9H2O와 0.25M Na2SO3이 들어간 용액으로 혼합하였다. 이후 용액을 반응기에 넣고 질소로 10분간 퍼징한 후 측정을 시작했으며 태양광 시뮬레이터(Solar simulator, PEC-L11, Peccell technologies, 150 W Xe lamp with an AM 1.5G filter)를 사용하여 표준 태양광 전력(1kW/m2) 조건에서 수소 생산을 진행하였다. 30분 간격으로 1mL 가스 시린지를 이용해 반응기 내의 기체를 포집하였고 가스 크로마토그래피(gas chromatography, Agilent 7890B)를 이용해 수소 생산량을 측정하였다. 이때 측정된 수소의 환산은 2종류의 표준가스(reference gas, 1 vol% H2, 4 vol% H2)의 측정값을 기준으로 환산하였다.
Characterization
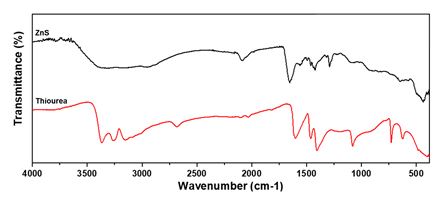
합성된 광촉매의 표면의 형태, 모양, 크기 분포, 표면의 원소 분포 등을 분석하기 위해 에너지 분산형 X-ray 분석(energy dispersed X-ray spectroscometer; EDX) 기기가 부착된 주사 전자 현미경(field emission scanning electron spectroscopy; FE-SEM, SU8010, Hitachi)을 이용하였다. 광촉매의 광학적 특성을 분석하기 위해 자외선 가시광선 분광기(UV-visible spectroscometer; UV-vis, S-4100, Scinco)를 통해 흡광도를 측정하였다. 또한 공초점 라만 분광기(confocal Raman spectrometer, LabRAM HR Evolution, HORIBA)를 이용해 325nm의 광원으로 상온 조건에서 광발광(photoluminescence; PL) 분석을 위해 측정하였다. 푸리에 변환 적외선 분광법(Fourier transform infrared spectrometer; FT-IR, Frontiers, PerkinElmer)를 이용해 380-4000cm-1의 범위에서 thiourea와 ZnS 광촉매의 적외선 분광을 진행하였다.
결과 및 평가
완료 작품의 소개
SEM, EDX
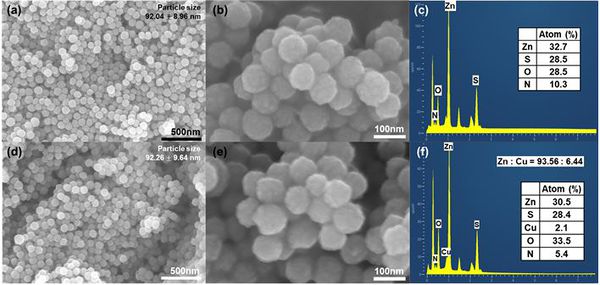
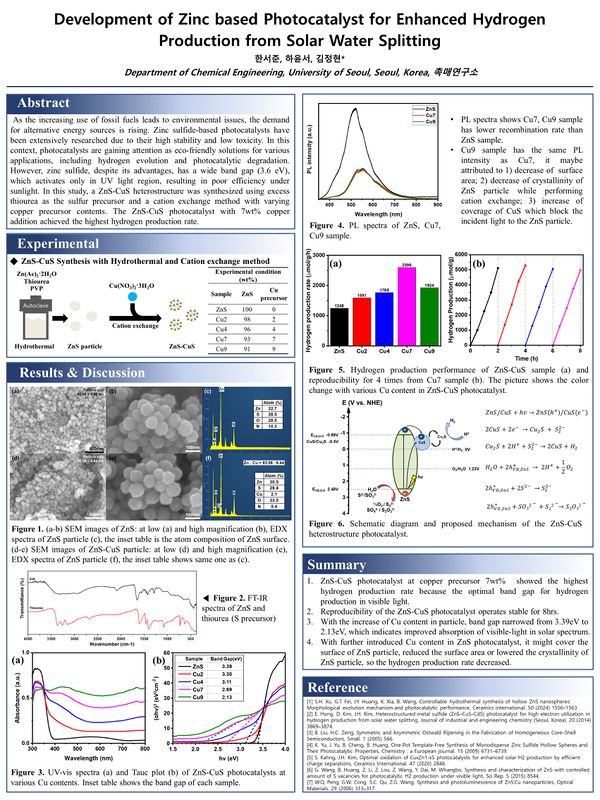
합성된 ZnS 및 Cu7 광촉매 입자의 미세구조 및 형태, 표면의 원소 분포를 확인하기 위해 SEM과 EDX를 측정하였으며 이를 그림 3에 나타내었다. 그림 3(a)와 3(d)에서 알 수 있듯 합성된 입자가 균일한 크기를 갖는 것을 확인할 수 있다. 이는 과량의 thiourea를 첨가하게 되면 thiourea와 Zn2+ 이온이 리간드를 형성하고 PVP의 steric effect로 인해 ostward ripening을 통한 입자의 성장이 제한된 것으로 보고된 바 있다[1, 3, 4]. 그림 3(b)는 ZnS 입자의 고배율 사진으로 입자의 표면이 울퉁불퉁한 형태를 보여주고 있음을 확인할 수 있다. 또한 500개 내외의 입자 크기를 측정했을 때 ZnS 입자(그림 3(a))와 Cu7 입자(그림 3(d)) 모두 약 92nm의 크기와 9-10nm 정도의 표준편차를 가지는 것을 분석하였다. 이는 cation exchange를 이용해 이종접합을 진행할 때 기존 입자의 형태를 유지할 수 있다는 것을 보여준다. 그림 3(c)에서 EDX mapping을 통해 합성된 ZnS 입자 표면의 원소를 분석한 결과 Zn과 S의 원소 비는 Zn 원자가 더 많아 sulfur vacancy가 존재함을 시사한다. O 원자는 hydrothermal 합성 과정에서 화학 흡착(chemisorped)된 물 분자나 수산화기에 의한 것으로 판단된다[5]. 또한 그림 4의 ZnS에서 1654cm-1 peak은 화학결합된 물 분자의 H-O-H 가위질 진동에 의한 것으로 보고된 바 있다[25]. 그림 3(f)에서 Cu7 입자의 표면에서 Cu가 Zn 대비 6.19 atom%로 존재하는 것을 확인하였다. 한편 Yu et al.[4]에 따르면 thiourea를 이용한 ZnS의 수열 합성 과정에서 thiourea는 Zn2+이온과 쉽게 리간드를 형성할 수 있지만 ZnS, Cu7 광촉매 모두 N 원자가 비교적 높은 비율로 발견되었는데, 그림 4에서 알 수 있듯 thiourea의 특성 peak이 보이지 않으므로 합성 과정 중 발생한 thiourea의 열분해 중간체가 Zn2+이온과 리간드를 형성하며 ZnS 표면을 둘러싸고 있음을 추론할 수 있다.
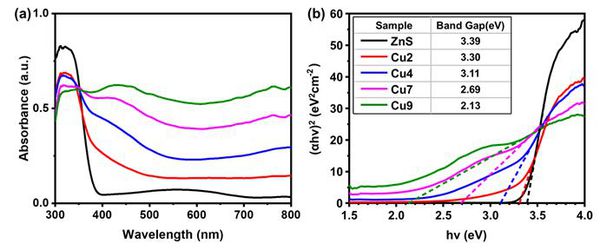
UV-vis spectroscopy
그림 5는 광촉매의 광학적 특성을 확인하기 위해 UV-vis 분광분석 결과와 이를 바탕으로 띠 간격을 계산하기 위해 Tauc plot을 진행하였다. 그림 5(a)에서 CuS가 접합되지 않은 ZnS는 약 380nm에서 absorption edge를 보이면서 자외선 영역의 흡수만을 보이는데, 일반적으로 알려진 ZnS의 띠 간격이 3.6eV임을 고려하면 다소 낮은 값임을 알 수 있다. 이러한 띠 간격의 감소는 ZnS에 존재하는 sulfur vacancy에 의해 발생한 ZnS3 dangling bond가 만들어지고, 이로 인해 가전자대와 전도대 부근에 각각 새로운 밴드를 형성에 의한 것이 보고된 바 있다[6]. 또한 N을 포함한 비금속의 도핑 방법은 가전자대의 위치를 상승시켜 띠 간격을 좁히고 황화물 광촉매의 안정성 증대시킨다는 연구가 보고된 바 있어 앞서 설명한 thiourea의 중간체가 N 도핑과 같은 효과를 내고 있음을 추측해 볼 수 있다[7, 8]. 한편 구리의 함량이 늘어날수록 가시광선 영역에서의 흡광도가 증가하는 것을 확인할 수 있다. 이는 cation exchange 반응의 특성상 CuS 입자가 ZnS 입자 표면에 형성되므로 구리의 함량이 증가할수록 표면에 존재하는 CuS의 입자가 많아져 ZnS의 흡광 특성보다 CuS의 흡광 특성이 더 나타나게 되고 따라서 가시광선 영역의 흡광도가 증가한 것으로 보이며 앞서 그림 3(f)의 EDX 분석의 결과와 같은 추론이 가능하다. 그림 5(b)는 UV-vis 분광분석 결과를 바탕으로 Tauc plot을 도시한 결과이다. ZnS의 경우 3.39eV의 높은 밴드 갭을 보이고 있으며 구리의 함량이 증가함에 따라 2.13eV까지 띠 간격이 감소하는 것을 확인할 수 있다. 이는 ZnS보다 띠 간격이 작은 CuS의 양이 증가하면서 흡수할 수 있는 빛의 파장이 증가했기 때문이다. 따라서 띠 간격이 감소하게 되면 낮은 에너지의 파장을 흡수할 수 있게 되므로 태양광을 이용한 수소 생산이 증대될 수 있다.
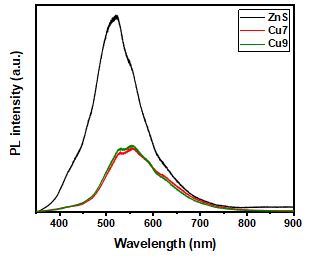
PL spectroscopy
광여기된 전하의 분리 효율을 측정하기 위해 PL 분석을 실시하였다. 그림 6은 ZnS, Cu7, Cu9 광촉매의 PL 스펙트럼 결과이다. ZnS 광촉매는 520nm 부근에서 peak을 보였으며 이는 합성 과정 중 발생한 ZnS 격자 내 결함(defects) 혹은 틈새(interstitial)와 연관되었다고 보고된 바 있다[9-13]. 한편 CuS가 접합된 광촉매의 경우 peak의 위치가 약 550nm 부근의 높은 파장으로 이동되는 모습을 보였다. 이러한 현상은 CuS의 접합에 의한 ZnS 광촉매보다 낮은 강도를 보였는데, 이는 CuS의 접합으로 인해 전자 혹은 정공이 CuS 쪽으로 흐르게 되며 전하가 분리되어 재결합이 감소했음을 나타낸다[14]. 또한 Cu7, Cu9 광촉매 모두 기존 ZnS 광촉매보다 적색 편이(red shift) 된 것을 확인할 수 있는데, 이는 CuS의 접합됨에 따라 Cu2+의 3t 준위의 낮은 donor level로 재결합하게 되며 발생한 것으로 확인된다[15]. 한편 Cu7, Cu9 광촉매는 거의 유사한 정도의 강도를 보였다. 이런 점을 미루어 볼 때 ZnS 표면에 접합된 CuS는 일정 비율을 넘어서게 되면 전하 분리 효율에 영향을 주지 못하는 것을 확인할 수 있다.
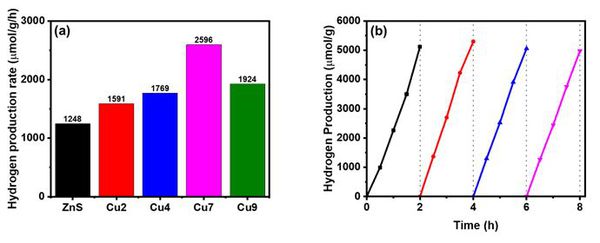
Hydrogen production performance
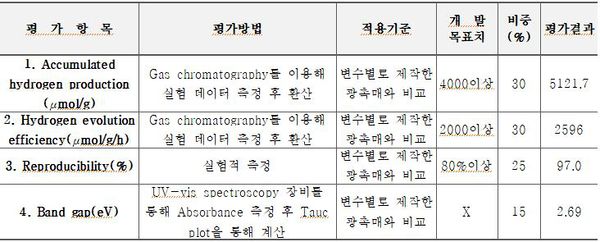
다음으로 광촉매의 수소 생산을 측정하였다. 그림 7에서 알 수 있듯, 구리가 첨가되지 않은 ZnS의 경우 평균 1248μmol/g/h 의 수소 생산을 보였으며 이는 기존 ZnS의 띠 간격을 구리의 함량이 증가함에 따라 최대 2596μmol/g/h까지 증가하는 것을 확인할 수 있다. 이는 cation exchange를 이용해 표면에 CuS 입자가 접합됨에 따라 전체적인 띠 간격이 감소했고 따라서 가시광 영역에서의 흡광도가 증가하여 발생한 결과라고 추측된다. 한편 Cu10 광촉매의 경우 수소 생산이 오히려 감소했는데, 이러한 원인으로 1) ZnS 입자의 pore에 CuS가 embedding 되며 표면적과 pore volume이 감소하여 활성 부위가 감소하게 된 것; 2) ZnS 표면에 CuS 입자가 많아지며 ZnS에 입사되는 빛의 양이 감소해 여기되는 전자가 작아진 것; 3) CuS의 입자 크기가 증가하여 촉매 특성이 저하된 것으로 추정해 볼 수 있다[14, 16]. 시간당 수소 생산량이 가장 높은 Cu7 광촉매의 내구성 평가를 위해 4회 동안 수소 생산을 측정하였고 각 수소 생산이 종료된 후 오차의 최소화를 위해 질소로 10분간 퍼징하여 실시하였다. 첫 번째 실험에서는 5121.7μmol/g의 수소 생산을 보이고 네 번째 실험에서 4970.4μmol/g의 수소 생산을 보여 초기 수소량의 97.0% 재현성을 확인하였다. PL의 결과에서 확인할 수 있듯 전자 정공의 재결합 정도가 감소함에 따라 ZnS 내의 전하가 효율적으로 분리되면서 일반적으로 알려진 황화물의 광부식 현상[2, 8, 22-24, 26]을 효과적으로 억제하고 있음을 알 수 있다.
그림 8은 합성된 광촉매의 전하 이동 메커니즘을 모식도로 나타낸 것이다. PL의 결과에서 알 수 있듯 태양광에 의해 ZnS와 CuS에서 여기된 전자는 접합 부위를 통해 CuS로 모이게 되고 CuS의 일부가 Cu2S와 S2-로 환원되며 전자를 소모한다. 동시에 Cu2S와 S2-는 수소 이온과 반응하며 CuS로 산화되어 수소를 생산하게 된다. 한편, ZnS와 CuS에서 생성된 정공은 희생시약(S2-, SO32-)의 강력한 환원 작용에 의해 전자 정공 쌍의 재결합을 막아 수소 생산 효율을 높이고 황화물 광촉매의 광부식을 억제한다. 따라서 CuS는 광여기된 전자를 받아 수소를 생산하는 활성 부위(active site)와 전자 우물(electron sink)의 역할을 수행하게 된다. 이러한 CuS의 접합은 ZnS 광촉매 내에서 발생하는 재결합의 감소, 높은 띠 간격으로 인한 제한적인 광여기 전자의 생성 등의 문제를 해결할 수 있음을 나타낸다.
결론적으로 ZnS 광촉매는 과량의 thiourea와 PVP를 이용한 수열합성법으로 제조되었고, cation exchange method를 통해 CuS 입자를 접합시켰으며 cation exchange의 특성상 ZnS 입자 표면에 CuS가 주로 분포하고 있는 것을 확인할 수 있다. 한편 접합 과정 중 광촉매 입자의 형태 변화는 발견되지 않았다. 구리 함량의 증가함에 따라 가시광 영역에서의 흡광도가 증가하였고, 이는 띠 간격의 감소로 인한 결과로 판단된다. Cu7과 Cu9 광촉매는 ZnS 광촉매보다 낮은 재결합 정도를 보였으며 효율적인 전하 분리가 이루어졌음을 시사하지만, Cu7과 Cu9 광촉매의 재결합 정도가 비슷한 것으로 보아 일정 농도 이상의 구리 함량 증가가 전하 분리 효율을 개선하지 못하는 것을 알 수 있었다. 또한 ZnS-CuS 광촉매는 type-II 이종접합을 하고 있으며 ZnS, CuS에서 여기된 전자가 CuS로 이동하며 CuS/Cu2S의 산화/환원 작용에 의해 수소 생산이 진행되는 것을 알 수 있었다. 최적화된 수소 생산은 Cu7 광촉매에서 2596μmol/g/h로 측정되었으며, CuS의 접합으로 ZnS-CuS 이종접합 활성 부위의 증가로 인한 수소 생산의 증가와 ZnS 표면에서 CuS의 coverage의 증가로 인한 수소 생산의 감소 사이에서 적절한 CuS의 조성을 달성했음을 알 수 있었다.
포스터
관련사업비 내역서
완료작품의 평가
개발 과제 관련 향후 전망
최근 전 세계적으로 탄소중립에 대한 관심이 커지면서 수소에너지가 주목받고 있다. 2050년까지 글로벌 수소 시장은 약 2조 5,000억 달러 규모로 성장할 것으로 예측된다. 이는 수소 생산 기술의 경제성을 확보하는 것이 중요한 과제임을 의미한다. 그러나 현재 수소의 약 96%는 화석연료를 통해 만들어져 이산화탄소를 다량 배출하는 그레이 수소이므로 온실가스 배출이 없는 지속 가능한 그린 수소 생산 기술의 개발이 중요한 시점이다. 광촉매를 활용한 수소 생산은 태양광을 이용하여 물을 분해하는 친환경 방법으로 무한한 태양에너지를 사용한다. 또한 이산화탄소 등 온실가스를 배출하지 않는다는 점에서 핵심 기술로 각광받고 있다. 하지만 기존의 광촉매 수소 생산 방식은 효율성이 낮아 상용화에 어려움이 있다. 본 과제는 광촉매 성능 향상을 통해 수소 생산의 효율성을 증대시키고 이를 기반으로 한 기술 상용화 가능성을 높이는 중요한 발판을 마련할 것이다. 따라서 과제와 관련된 연구 전망은 밝을 것으로 보인다.
참고 문헌
[1] S.H. Xu, G.T. Fei, J.Y. Huang, K. Xia, B. Wang, Controllable hydrothermal synthesis of hollow ZnS nanospheres: Morphological evolution mechanism and photocatalytic performance, Ceramics international. 50 (2024) 1556–1563.
[2] E. Hong, D. Kim, J.H. Kim, Heterostructured metal sulfide (ZnS–CuS–CdS) photocatalyst for high electron utilization in hydrogen production from solar water splitting, Journal of industrial and engineering chemistry (Seoul, Korea). 20 (2014) 3869–3874.
[3] B. Liu, H.C. Zeng, Symmetric and Asymmetric Ostwald Ripening in the Fabrication of Homogeneous Core–Shell Semiconductors, Small. 1 (2005) 566.
[4] X. Yu, J. Yu, B. Cheng, B. Huang, One‐Pot Template‐Free Synthesis of Monodisperse Zinc Sulfide Hollow Spheres and Their Photocatalytic Properties, Chemistry : a European journal. 15 (2009) 6731–6739.
[5] S. Kahng, J.H. Kim, Optimal oxidation of CuxZn1-xS photocatalysts for enhanced solar H2 production by efficient charge separations, Ceramics International. 47 (2020) 2848.
[6] G. Wang, B. Huang, Z. Li, Z. Lou, Z. Wang, Y. Dai, M. Whangbo, Synthesis and characterization of ZnS with controlled amount of S vacancies for photocatalytic H2 production under visible light, Sci Rep. 5 (2015) 8544.
[7] Y. Zhou, G. Chen, Y. Yu, Y. Feng, Y. Zheng, F. He, Z. Han, An efficient method to enhance the stability of sulphide semiconductor photocatalysts: a case study of N-doped ZnS, Physical chemistry chemical physics : PCCP. 17 (2015) 1870–1876.
[8] G. Jiang, B. Zhu, J. Sun, F. Liu, Y. Wang, C. Zhao, Enhanced activity of ZnS (111) by N/Cu co-doping: Accelerated degradation of organic pollutants under visible light, Journal of Environmental Sciences. 125 (2022) 244
[9] Y. Zhu, Y. Bando, D. Xue, Spontaneous growth and luminescence of zinc sulfide nanobelts, Applied Physics Letters. 82 (2003) 1769–1771.
[10] Y. Jiang, X.-. Meng, J. Liu, Z.-. Xie, C.-. Lee, S.-. Lee, Hydrogen-Assisted Thermal Evaporation Synthesis of ZnS Nanoribbons on a Large Scale, Adv Mater. 15 (2003) 323–327.
[11] J. Hu, Y. Bando, J. Zhan, D. Golberg, Sn-Filled Single-Crystalline Wurtzite-Type ZnS Nanotubes, Angewandte Chemie International Edition. 43 (2004) 4606–4609.
[12] J. Gong, S. Yang, J. Duan, R. Zhang, Y. Du, Rapid synthesis and visible photoluminescence of ZnS nanobelts, Chem. Commun. (2005) 351–353.
[13] T. Zhai, Z. Gu, Y. Ma, W. Yang, L. Zhao, J. Yao, Synthesis of ordered ZnS nanotubes by MOCVD-template method, Materials Chemistry and Physics. 100 (2006) 281–284.
[14] J. Zhang, J. Yu, Y. Zhang, Q. Li, J.R. Gong, Visible Light Photocatalytic H2-Production Activity of CuS/ZnS Porous Nanosheets Based on Photoinduced Interfacial Charge Transfer, Nano Lett. 11 (2011) 4774–4779.
[15] W.Q. Peng, G.W. Cong, S.C. Qu, Z.G. Wang, Synthesis and photoluminescence of ZnS:Cu nanoparticles, Optical Materials. 29 (2006) 313–317.
[16] J. Yu, J. Ran, Facile preparation and enhanced photocatalytic H2-production activity of Cu(OH)2 cluster modified TiO2, Energy Environ. Sci. 4 (2011) 1364–1371.
[17] National Oceanic and Atmospheric Administration, ESRL, Average carbon dioxide (CO₂) levels in the atmosphere worldwide from 1959 to 2023 (in parts per million), Chart, Statista, 2024. Available: https://www.statista.com/statistics/1091926/atmospheric-concentration-of-co2-historic/ [Accessed 19 November 2024].
[18] National Oceanic and Atmospheric Administration, Annual anomalies in global land and ocean surface temperature from 1880 to 2023, based on temperature departure (in degrees Celsius), Statista, 2024. Available: https://www.statista.com/statistics/224893/land-and-ocean-temperature-anomalies-based-on-temperature-departure/ [Accessed 19 November 2024].
[19] 금오공과대학교 산학협력단. "전이금속 도핑 이산화티탄 광촉매의 제조방법". 10-1307647, 2013년 3월 19일, 2013년 9월 5일.
[20] (재)대구경북과학기술연구원. "ZnS-ZnO 광촉매의 제조방법 및 이에 의해 제조된 ZnS-ZnO 광촉매". 10-0744636, 2006년 8월 16일, 2007년 7월 25일.
[21] 주식회사 포스코 및 포항공과대학교 산학협력단, "중공구조를 가지는 광촉매 입자, 그 제조방법, 이를 포함하는 코팅 조성물, 상기 코팅 조성물에 의한 강판 및 강판의 코팅방법". 10-1736623, 2015년 12월 18일, 2017년 5월 10일.
[22] T. Lange, S. Reichenberger, S. Ristig, M. Rohe, J. Strunk, S. Barcikowski, R. Schlögl, Zinc sulfide for photocatalysis: White angel or black sheep?, Progress in Materials Science. 124 (2022) 100865.
[23] G. Lee, S. Anandan, S.J. Masten, J.J. Wu, Photocatalytic hydrogen evolution from water splitting using Cu doped ZnS microspheres under visible light irradiation, Renewable Energy. 89 (2016) 18–26.
[24] Y. Hong, J. Zhang, F. Huang, J. Zhang, X. Wang, Z. Wu, Z. Lin, J. Yu, Enhanced visible light photocatalytic hydrogen production activity of CuS/ZnS nanoflower spheres, Journal of Materials Chemistry A. 3 (2015) 13913–13919.
[25] L. Tie, R. Sun, H. Jiang, Y. Liu, Y. Xia, Y. Li, H. Chen, C. Yu, S. Dong, J. Sun, J. Sun, Facile fabrication of N-doped ZnS nanomaterials for efficient photocatalytic performance of organic pollutant removal and H2 production, Journal of Alloys and Compounds. 807 (2019) 151670.
[26] E. Kang, J.H. Kim, Highly boosted photocatalytic H2 production from ZnS particles assisted by Cd-Cu co-doping, Journal of Environmental Chemical Engineering. 11 (2023) 109833.