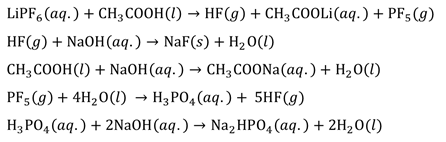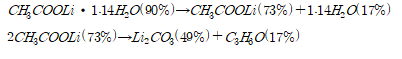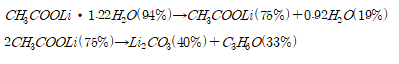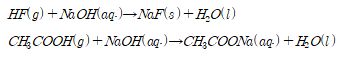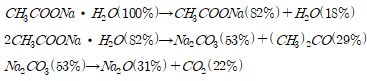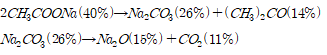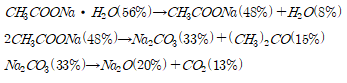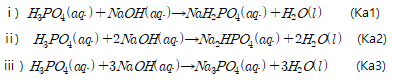플리
프로젝트 개요
기술개발 과제
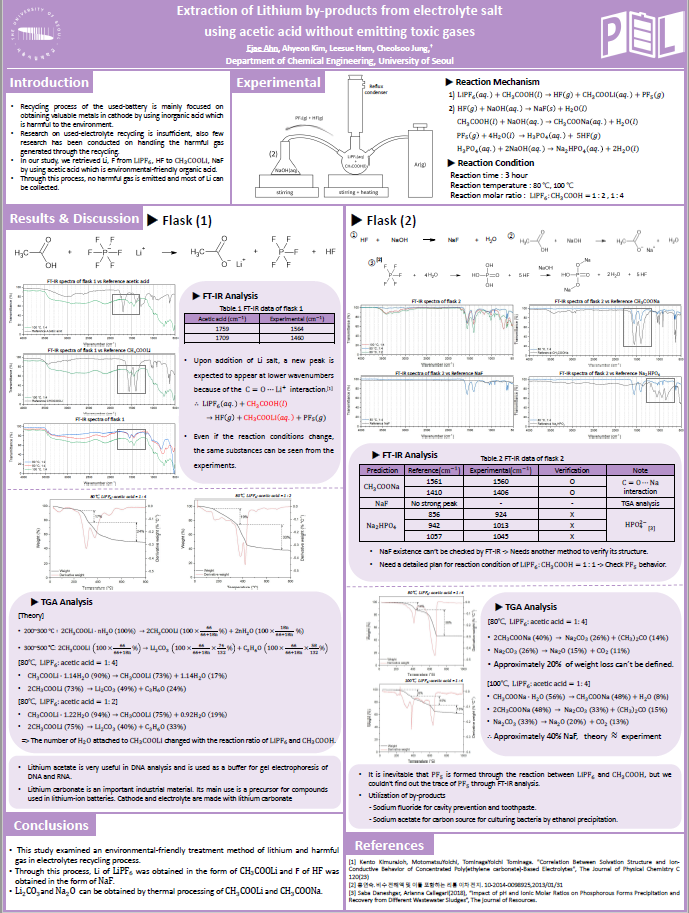
국문 : 리튬이온전지의 전해질염과 아세트산의 반응을 이용한 리튬 추출 및 유해가스 처리에 관한 연구 ..
영문 : Extraction of Lithium by-products from electrolyte salt using acetic acid without emitting toxic gases..
과제 팀명
플리
지도교수
정철수 교수님
개발기간
2022년 9월 ~ 2022년 12월 (총 4개월)
구성원 소개
서울시립대학교 ㅁㅁ공학부·과 2011XXX0** 김**(팀장)
서울시립대학교 ㅁㅁ공학부·과 2011XXX0** 정**
서울시립대학교 ㅁㅁ공학부·과 2011XXX0** 조**
서울시립대학교 ㅁㅁ공학부·과 2011XXX0** 이**
서울시립대학교 ㅁㅁ공학부·과 2011XXX0** 남**
서론
개발 과제의 개요
개발 과제 요약
◇ 대부분의 폐배터리 재활용 공정은 환경에 해로운 무기산을 사용하여 양극재 속 유가금속을 추출하는 것에 주로 초점이 맞춰져 있다. ◇ 폐전해질 재활용에 대한 연구가 미흡하고 재활용과정에서 발생하는 유해가스를 처리하는 연구도 거의 이루어지지 않고 있다. ◇ 본 과제에서는 친환경 유기산을 사용하여 의 Li을 로 의 F를 의 형태로 회수한다.
개발 과제의 배경
◇ 일반적으로 사용한 리튬이온배터리는 생활폐기물로 매립, 소각 등의 방법을 통해 처리된다. 이 과정으로 인해 매립지에서는 중금속이 토양, 지하수 또는 지표수로 침출될 가능성이 있으며 소각 과정에서 배터리에 포함된 중금속이 금속 형태로 전환되어 수질 오염을 유발할 수 있어 폐배터리 재활용이 필요하다. ◇ 리튬이온배터리에 사용되는 원료들은 리튬, 코발트, 니켈, 망간 등 광석에서 추출되는 금속으로 생산국이 적으며 추정 매장량이 적어 향후 몇 년간 원료 수급에 문제가 생길 것으로 예상된다. ◇ 대부분의 배터리 재활용은 양극재에서의 금속 추출에 초점이 맞춰져 있음. 일반적으로 배터리를 파쇄하여 내부 물질을 입자화해 공정을 통해 추출한다. 이 과정에서 전해질에 있는 육불화인산리튬()이 공기 중 수분과 반응하여 불화수소(), 오플루오린화 인() 등의 독성 가스를 배출함. 이를 해결하기 위해 전해질에서의 유가 금속 추출과 독성 가스 처리가 필요하다.
개발 과제의 목표 및 내용
◇ 폐배터리 전해질 속 육불화인산리튬()이 아세트산과 반응하여 대기중에서 반응성이 낮은 상태의 유용한 리튬염을 얻도록 한다. ◇ 재활용 과정에서 나오는 독성 가스를 수산화나트륨 수용액((aq.))을 이용해 처리하도록 한다. ◇ 폐배터리 재활용 과정에서 사용되는 무기산이 아닌 환경에 덜 해로운 유기산을 사용하여 독성 가스 배출양을 줄이고 폐수 처리를 용이하게 한다. ◇ 실제 리튬이온배터리 재활용 공정에서 사용 가능성을 판단하고 적용하는 데 필요한 추가적인 요소에 대해 논의한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
- 전 세계적인 기술현황
◇ 기업 측면: 수집 및 전처리 후 습식제련을 통한 고순도 배터리용 소재 생산 (성일하이텍)
◇ 연구 측면: 젖산과 옥살산을 이용해 폐 이차 리튬이온 전지 양극활물질로부터 희유금속들의 회수
- 특허조사 및 특허 전략 분석
◇ 로디아 오퍼레이션스. 전해질 염을 회수하는 방법. 10-2017-0018048, June 16, 2015 and issued February 15, 2017 ◇ 폐리튬이온 2차전지의 양극재로부터 리튬을 회수하여 고순도 탄산리튬을 제조하는 방법. 10-1682217, Sep 02, 2016 and issued November 28, 2016
- 기술 로드맵
◇ 양극재가 아닌 전해질 환경에서의 연구 ◇ 재활용과정에서 유해가스처리 공정을 추가 ◇ 재활용과정에서 발생하는 폐기물 최소화 ◇ 환경에 이로운 유기산을 사용하여 효율 극대화
개발과제의 기대효과
기술적 기대효과
◇ 전해질에서의 리튬추출을 통해 전체 배터리 재활용공정에서의 리튬 회수 수율을 높일 수 있다. ◇ 전처리과정이 필요하지 않아 기존의 재활용 공정보다 간단한 처리공정이 될 수 있다.
경제적, 사회적 기대 및 파급효과
◇ 본 연구에서 전해액 속 리튬을 추출하여 최종적으로 형태로 리튬을 회수함으로서 불안정한 수급으로 인한 가격 상승을 해결하고 리튬 이온 배터리 공급을 안정화할 수 있다. ◇ 본 연구의 최종 product인 의 경우 실험실에서 DNA와 RNA의 겔 전기영동을 위한 완충제로 사용되며 세포벽을 투과시키는 데 사용하는 등 세포 및 DNA 연구에 중요한 역할을 한다. ◇ 폐배터리의 수거 및 재활용을 통하여 배터리 원료를 채굴하기 위해 사용되는 물 (리튬 1톤에 약 230만 리터)을 아낄 수 있으며 폐배터리 처분과정에서 발생할 수 있는 문제들을 예방할 수 있다. ◇ 본 연구에서는 보다 친환경적인 용매를 사용하여 리튬을 추출하고 독성물질을 처리하는 공정을 추가하여 보다 환경 친화적인 리튬추출방안이 될 것으로 예상된다.
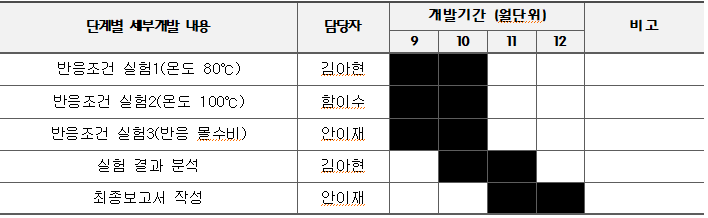
기술개발 일정 및 추진체계
개발 일정
구성원 및 추진체계
◇ 김아현 : 반응조건 실험1 및 실험 결과분석 담당 ◇ 함이수 : 반응조건 실험2 및 최종보고서 작성 ◇ 안이재 : 반응조건 실험3 및 최종보고서 작성
설계
설계사양
설계 사양
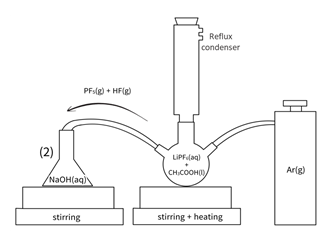
◇ 100mL 3 neck 플라스크를 이용해 위로는 콘덴서를 설치하여 기화하는 아세트산을 냉각시키고 한 쪽으로 Ar 기체를 주입하여 반응 중 생성되는 기체가 NaOH 수용액(1M) 안으로 들어가도록 설계하였다.
◇ 실험조건 Reaction time : 3 hour Reaction temperature : 80 ℃, 100 ℃ Reaction molar ratio : 1 : 2 , 1 : 4
◇ 예상 메커니즘
결과 및 평가
내용
1.1 리튬추출
아세트산(acetic acid)은 카르복실기(car boxyl group, -COOH) 1개를 갖고 있는데 이러한 카 르복실기는 금속이온과 결합(bonding)을 하기에 적 절한 구조와 조건을 가지고 있다. 아세트산과 전해질 염의 반응메커니즘은 다음과 같이 나타낼 수 있다.
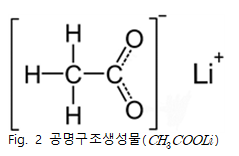
식(1)와 같이 수소이온이 분리되면 그 자리에 금속양이온이 들어가 추출 반응이 일어나게 된다. 수소이온대신 리튬이온이 카복실산에 붙게 되면 공명구조를 가지게 되어 C=O 결합이 약해진다.
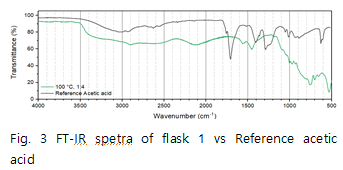
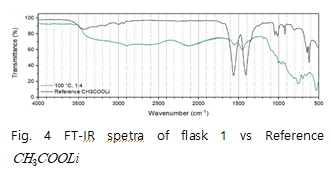
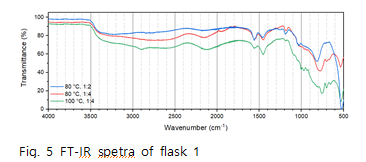
Fig.3의 data를 보면 acetic acid 의 1759, 1709에서에서 나타나던 C=O결합 peak가 오른쪽으로 이동해 1564,1460 부근의 두 peak로 이동 했다는 것을 확인할 수 있다. peak가 4이상 움직였는데 이는 C=O 결합의 peak가 acetic acid의 peak라기 보다는 생성된 또 다른 물질의 peak임을 예상할 수 있다. 이 peak는 Fig.4에서 볼 수 있듯이 Li+의 영향으로 이동된 C=O의 peak임을 알 수 있다 또한 Fig.4 data를 통해 flask1에서 수득한 고체는 임을 확인할 수 있으며 예상한 메커니즘대로 반응이 일어남을 알 수 있다. Fig.5를 통해 반응 조건이 바뀌어도 추출된 고체는 모두 동일함을 알 수 있다.
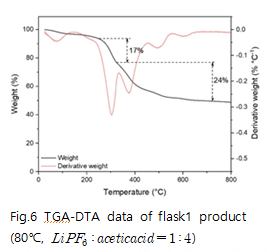
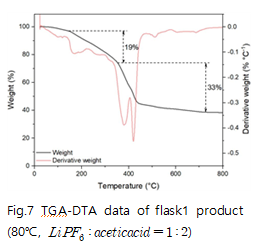
다음은 와 acetic acid를 반응시켜 수득한 고체의 TGA data 이다. 반응온도 80℃, 반응몰비 1 : 2, 1 : 4 에서 얻은 TGA data의 질량 감소를 측정하여 반응 메커니즘을 분석하였다.
실험에서 설계한 메커니즘은 다음과 같다.
ⅰ) in 200~300℃
ⅱ) in 300~500℃
예상한 메커니즘에 따라 분석하면 80℃에서 반응몰수비 1 : 2, 1 : 4로 반응시켰을 때 1 : 2의 몰수비에서는 , 1 : 4의 몰수비에서는 수화물을 수득 할 수 있다. 이를 통해 리튬아세테이트 수화물 H2O의 몰 수가 와 acetic acid의 반응 몰수비에 따라 달라짐을 확인할 수 있다.
추가적으로 기존 연구에서 진행한 리튬 아세테이트의 TGA 분석과 비교하였다. J. Hamalainen(2012)는 리튬아세테이트가 200-300℃와 300-500℃ 두 번에 걸쳐 연속적인 열분해가 일어나며 A. Ruud(2017)는 리튬 아세테이트가 300-400℃에서 열분해가 일어남을 확인했다. J. Hamalainen의 연구는 실험실에서 자체 제작한 리튬 아세테이트를 사용했으며 A. Ruud는 리튬 아세테이트 무수물을 이용해 TGA 분석을 진행하였기 때문에 이러한 차이가 발생함을 감안하면 본 실험의 예상 메커니즘과 TGA 분석을 통해 LiPF6와 acetic acid의 반응을 통해 수득한 고체가 리튬 아세테이트임을 알 수 있다.
1.2 HF 처리
아세트산과 리튬염의 반응으로 생성되는 독성가스 HF를 처리하기 위해 NaOH수용액을 이용하여 다음과 같은 반응을 유도했다.
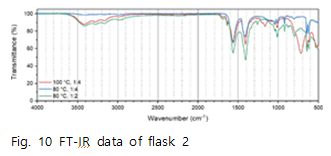
실험을 통해 얻은 고체 시료를 FT-IR을 이용해 우선 분석해 보았다.
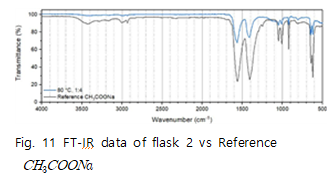
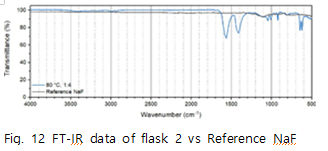
Fig.10은 반응 조건에 따라 수득한 flask2의 FT-IR data이다. 이를 통해 반응 조건이 달라져도 flask2에서 수득한 고체는 동일함을 알 수 있다. Fig.11~13은 flask 2에서 수득한 고체와 reference 물질을 비교한 FT-IR data이다. 먼저 Fig.11에서 reference 에 나타나는 1561,1410 peak 가 수득한 고체에서는 1560,1406 peak로 나타남을 알 수 있다. 이는
의 interaction의 peak로 수득한 고체에
가 존재한다고 판단할 수 있다. Fig.12에서 reference 의 FT-IR data는 특정 peak가 존재하지 않으므로 다른 구조분석 방법이 필요하다. 따라서 FT-IR 분석을 통해서는 NaF의 생성을 확인하지 못했고 수득한 고체에는
가 존재하다는 사실을 알 수 있었다. 즉 식(3)의 반응메커니즘이 일어났다고 할 수 있다. NaF의 존재성을 확인하기 위해 추가적으로 TGA 분석을 진행했다.
TGA 분석 과정에서 일어나는 decomposition 메커니즘은 다음과 같을 것이라 예측했다.
Flask1에서 전달된 acetic acid와 NaOH 수용액이 반응하여 와
가 생성된다. TGA 분석의 흡열반응으로
이 생성되며 파일:Na2CO3mPNG 은
와
로 분해된다.
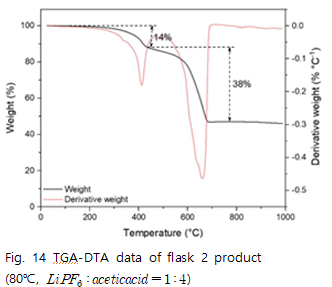
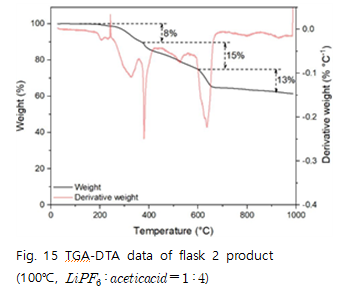
예상한 메커니즘에 따라 flask2에서 수득한 고체의 TGA분석을 진행하면 다음과 같다.
80℃ 반응몰수비 1 : 4의 실험에서 이론에 따른 질량감소율과 실험값을 비교해보면 400-700℃에서 40%의 감소를 보이는데 이론값에서는 약 20%의 감소를 보인다. 실험값과 이론값이 차이나는 이유는 외의 다른 물질이 400~700℃에서 열분해가 일어났다고 볼 수 있다. 이 때 열분해가 된 물질은
의 반응에 의해 생성된 것으로 판단할 수 있다.
100℃ 반응몰수비 1 : 4에서는 실험값과 이론값이 유사한 감소율을 보인다. 약 60%의 잔여물이 남는데 열분해로 인해 생성된 20%의
를 제외하면 40%의 잔여물은 NaF라고 판단할 수 있다.
와
의 반응 과정에서는 HF와 더불어
또한 생성된다.
는 가수분해가 잘 일어나며 다음과 같은 메커니즘에 따라 발생한다.
이와 더불어 인산은 다양성자 산이기 때문에 NaOH와의 반응이 총 3가지 메커니즘으로 나타난다.
실험에서 수득한 고체의 성분은 위의 3가지 반응의 생성물 모두 가능할 것으로 예상이 된다. 세 가지 고체 모두 흰색 결정이므로 육안으로는 구분할 수 없다. 위의 반응 중에서 ii) 반응이 두드러질 것이라 판단했다. 기체는 물과 만나면 가수분해반응이 잘 일어나 인산이 생긴다. 인산과 HF중 인산의 산도가 높으며 인산은 다양성자 산이므로 3가지의 Ka를 가진다. Ka는 산의 세기의 척도로 총 4가지의 수를 비교하면 Ka1 > HF의 Ka > Ka2 >Ka3이다. 따라서 순수한 산의 세기로 비교한다면
와 NaF가 주요 생성물일 것으로 예측할 수 있다.
하지만 TGA 결과는 위와 상반된 결과를 보인다. 메커니즘에서 확인할 수 있는 물질들의 열분해 온도를 살펴보면 다음과 같다. 의 열분해 시작 온도는 100℃ 내외로 실험 시료에서는 100℃ 부근의 열분해를 확인할 수 없다.
는 녹는점이 1000℃ 이상이며 열분해 온도를 확인할 수 없다. 따라서 NaOH 플라스크TGA 그래프의 600℃ 부근에서의 약 30%의 질량손실을 의
의 열분해로 예측할 수 있다.
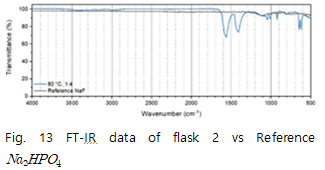
따라서 FT-IR과 TGA를 통해 NaOH 플라스크에서 수득한 고체의 조성을 판단하였다. Fig 13(FT-IR data of flask 2 vs Reference )에서 1000 부근에 특징적인 peak가 나타나는데 실험 시료에서는 이 peak를 확인할 수 없다.
위 분석 결과를 통해 시료의 조성이 기체와 관련되어 있다고 판단할 수 있다. 따라서
기체의 거동을 확인하기 위해 추가로 플라스크에 중성의 물을 넣어두고 2번 플라스크와 호스를 통해 연결하였다. 실험 시작 후 얼마 지나지 않아 물이 약간의 산성을 띄는 것을 확인할 수 있었다. 80℃로 실험을 했을 때 아세트산이 기화되지 않았다고 가정하면 물이 산성으로 변한 이유는 HF 혹은
일 것이다. 인산에 의해 물이 산성을 띈다면
에 의함이고 그 외에는 HF 때문일 것이다. 물이 산성을 띄는 이유를 파악한다면
기체의 거동을 확인할 수 있을 것이다.
결론
으로부터 아세트산을 이용한 추출 실험결과 다음과 같은 결론을 얻었다.
1) FT-IR, TGA 분석결과 의 Li을 의 형태로 HF의 F를 NaF의 형태로 얻어낼 수 있다.
2)
와
의 열처리공정을 통해
와
를 얻어낼 수 있다.
3) 파일:PF5,PNG의 성질과 반응성에 대한 연구가 더 있다면 더 많은 F를 회수할 수 있을 것이다.
포스터
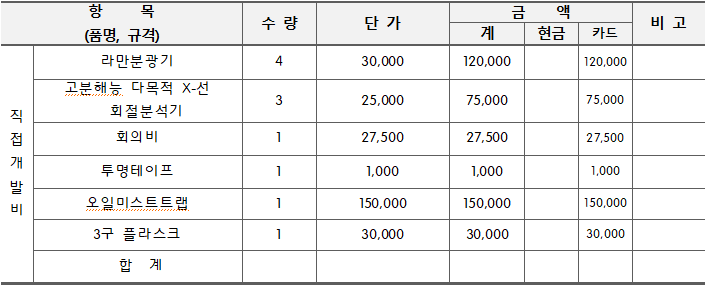
관련사업비 내역서
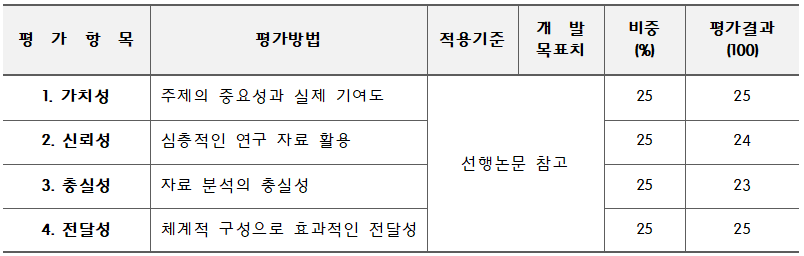
완료작품의 평가
향후계획
현재 폐 리튬이온 배터리 재활용 공정은 대부분 배터리를 분해, 파쇄하여 전극에서 Li, Co, Ni 등의 유용한 금속을 추출하는 것에 초점이 맞춰져 있고 전해질은 배터리 내 차지하는 비율이 작기 때문에 전해질의 주요 성분인 는 거의 추출하지 못하고 있다. 따라서 본 연구는 상대적으로 연구가 많이 진행되지 않은 전해액에서 리튬을 친환경적으로 추출하는 방법에 대해 연구하였다. 대부분의 재활용 공정에서 사용하는 무기산을 유기산인 acetic acid로 대체하여 리튬염을 상온에서 안정한 고체 형태로 수득하였고 공정에서 발생하는 HF가스를 NaOH수용액을 이용하여 NaF로 고체화하였다. NaF는 steady state에서 고체 상태이며 다양한 분야에서 플루오린 이온을 공급하는데 쓰이며. 살충제, 목재 방부제, 유리 제조 등에 사용된다. NaOH를 이용하여 HF를 NaF형태로 수득하게 되면 여러 분야에서 사용할 수 있을 것이다.
본 연구를 통해 공정에서 사용하는 무기산을 유기산으로 대체하여 용매의 회수를 용이하게 만들 수 있고 유독 가스를 고체화하여 친환경적인 공정을 설계할 수 있음을 확인하였다. 또한 배터리내의 이외의 다른 리튬염에도 공정을 적용한다면 폐배터리의 다른 구성물질인 분리막, 전극을 효율적으로 재활용하여 유용한 금속들의 회수율을 높일 수 있어 긍정적 효과를 가져 올 것으로 예상된다.
참고문헌
[1] Pratima Meshram 외 3, "Environmental impact of spent lithium ion batteries and green recycling perspectives by organic acids – A review", Chemosphere, vol 242, March 2020 [2] Bruce Musariri 외 3, "Evaluating organic acids as alternative leaching reagents for metal recovery from lithium ion batteries", Minerals Engineering, vol 137, 15 June 2019, page 108-117 [3] https://www.sungeelht.com/html/12 [4] 김진한,김용철,오승교,전종기,”폐 이차전지 리사이클링을 위한 건식공정 생성물 분석 [5] 로디아 오퍼레이션스. 전해질 염을 회수하는 방법. 10-2017-0018048, June 16, 2015 and issued February 15, 2017 [6] 폐리튬이온 2차전지의 양극재로부터 리튬을 회수하여 고순도 탄산리튬을 제조하는 방법. 10-1682217, Sep 02, 2016 and issued November 28, 2016 [7] https://en.wikipedia.org/wiki/Lithium_acetate [8] Amund Ruud 외 1명, "Enhanced process and composition control for atomic layer deposition with lithium trimethylsilanolate", Journal of Vaccum Science & Technology A 35, 21 December 2016 [9] Jani Hamalainen 외 6명, "Lithium Phosphate Thin Films Grown by Atomic Layer Deposition", Journal of The Electrochemical Society, January 2012 [10] 이화영, 조병원, “폐전지의 리사이클링 처리기술 현황” [11] 박순엽,"사용 후 배터리 재활용, 관련 기술에 미래 경쟁력 좌우",[이데일리],2022.03.07. [12] 한국지질자원연구원, “1차,2차 폐전지로부터 유가금속회수 및 소재화 기술개발” [13] 폐리튬 2차전지의 Re-Use와 Re-Cycling 산업 및 기술현황 [14] 교보증권 리서치센터(2020)===