515
프로젝트 개요
기술개발 과제
국문 : 핵산 물질의 효과적인 체내 전달을 위한 지질 나노 입자의 개선(개량) 연구
영문 : Improvement of Lipid Nanoparticles for Efficient Nucleic Acid Delivery in Vivo
과제 팀명
515
지도교수
이종범 교수님
개발기간
2021년 9월 ~ 2021년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20153400** 신*빈(팀장)
서울시립대학교 화학공학과 20153400** 김*찬
서울시립대학교 화학공학과 20153400** 김*준
서울시립대학교 화학공학과 20153400** 정*희
서울시립대학교 화학공학과 20153400** 최*종
서론
개발 과제의 개요
개발 과제 요약
- 핵산물질을 이용한 치료에 이용되는 Lipid nanoparticle(LNP)에 사용되는 지질들의 역할 파악
- LNP를 구성하는 각 지질들의 구조 변형, 개선 합성 을 위한 연구들에 대해 조사
- 지질 구조의 변경이 가져올 효과에 대한 조사
- LNP 구성 및 조성의 변경이 가져오는 효과에 대하여 조사
개발 과제의 배경
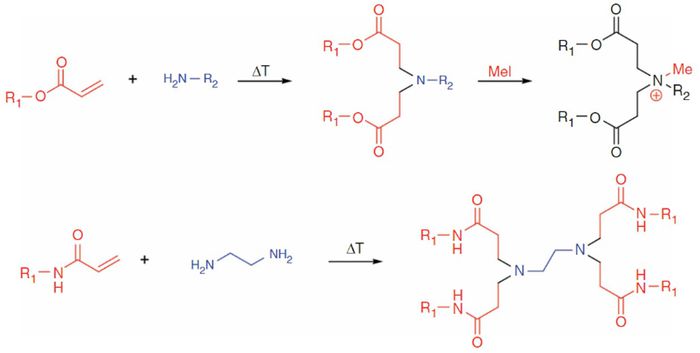
RNAi, 항체 생성, 특정 체내 부족 단백질 생성 등을 이용하는 핵산 물질을 이용한 치료가 활발히 연구되고 있으며, 코로나19 백신, 암 치료제 등으로 상용화되기까지 이르렀다. 그러나 이러한 핵산 물질들은 불안정한 상태의 물질로 분해되기 쉽기 때문에 목표 표적까지 핵산 물질을 안전하게 전달시킬 수 있는 효율적인 전달체가 필요하다. 또한 이같은 핵산 물질의 보호 뿐만 아니라 체내에서 이루어지는 면역반응의 회피, 세포독성, 안정성, 체내 분포, 전달 효율 등 고려해야 할 요소들이 추가적으로 존재하며 이들을 조절하기 위한 연구가 필요하다. 특히 주요 전달체로 이용되고 있는 지질나노입자(LNP)는 여러 방면에서 활발한 연구가 이뤄지고 있는 바, LNP를 구성하는 다양한 지질을 조사하고, 최신 LNP 연구 동향에 대해 알아본다.
개발 과제의 목표 및 내용
- LNP 제작에는 여러 지질이 사용된다. 이때 사용되는 지질에 따라 만들어지는 LNP의 구조에 안정성을 추가해 주거나 LNP의 크기 등에 영향을 주는 특정 지질의 특성에 대하여 조사한다.
- 조사한 지질의 특성이 지질의 어떤 구조, 작용기에 의해 정해지는지, 그리고 이를 이용하여 지질의 특성을 바꾸기 위한 비슷한 구조의 지질들을 연구한 논문들을 찾아본다.
- 약물이 몸 속에 전달되는 능력을 향상시키기 위한 어떤 시도들이 있었는지 찾아본다.
- 의도한 시간 이상으로 몸에 존재하는 약물은 부작용을 일으킬 수 있어 적절한 분해성이 요구되는 바 몸 속으로 들어온 LNP가 효과적으로 분해되기 위해 영향을 미치는 요소에 대해 찾아보고 실제 체내에서 분해되는 메커니즘을 살펴본다.
- 약물이 투여되는 방식에 따라서 달라지는 지질 성능에 대하여 살펴본다.
- LNP의 구성을 변경하였을 때 달라지는 성능에 대하여 조사한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
전 세계적인 기술현황
- RNA interference 치료제인 Onpattro가 최초로 FDA승인을 얻어 상용 제품으로 출시되었다.
- Pfizer, moderna 사의 백신이 LNP에 바이러스 단백질 mRNA를 담아 백신으로 이용하고 있다.
- 다발성 골수종, 난소암 치료제인 DOXIL이 개발되었다.
- 수용성 아밀로이드증 치료제이며 siRNA 기반 LNP 약물인 Patisiran이 개발되었다.
특허조사 및 특허 전략 분석
향상된 지질 조성물 - 특허번호 : PCT/US2010/038224 - 출원일 : 2010.6.10. - 등록일 : 2010.12.16. - 특허권자 : 알닐람 파마슈티칼스 인코포레이티드 본 발명은 화학식 (I)의 양이온성 지질, 화학식 I의 양이온성 지질을 포함하는 향상된 지질 제제 및 상응하는 이용 방법을 특징으로 한다. 또한, 표적화 지질, 그리고 이런 표적화 지질을 포함하는 특정한 지질 제제가 개시된다.
폴리에틸렌글리콜과 트리페닐포스포늄이 컨쥬게이트된 물질 및 이를 적용한 미토콘드리아 표적 자기조립형 나노약물 전달체 - 특허번호 : KR1017433990000 - 출원일 : 2016.05.31. - 등록일 : 2017.05.29. - 특허권자 : 충남대학교산학협력단 폴리에틸렌글리콜(PEG)의 말단에 트리페닐포스포늄(TPP)이 화학적으로 결합된 하기 화학식 1의 PEGTPP (Polyethylene gylcol-Triphenylphosphonium) 컨쥬게이트.
약물전달체 - 특허번호 : KR1010783020000 - 출원일 : 2008.05.29. - 등록일 : 2011.10.25. - 특허권자 : (주)제테마 (a) 생체 적합성 중합체; 및 (b) 상기 중합체에 컨쥬게이션된 소수성기를 포함하는 약물전달체.
생체활성 친유성 화합물을 갖는 PEG화된 지질 나노입자 특허번호 : KR1020187006989 출원일 : 2016.08.11. 등록일 : 2018.03.30. 발명자 : 가이야르,피테르얍,립,야콥 본 발명은 친유성 진단 또는 치료 제제를 이를 필요로 하는 대상에게 전신 또는 국소 전달하기 위한 나노입자에 관한 것이다. 본 발명의 나노입자는 수용성 중합체 및 생체 적합성 지질 및 친유성 제제 중 적어도 하나를 포함한다. 나아가,본 발명은 본 발명의 나노입자를 사용한 안과 치료에 관한 것이다. 또한, 본 발명은 본 발명의 나노입자를 포함하는 조성물 및 포뮬레이션에 관한 것이다.
산화된 콜레스테롤을 함유하는 약물 전달 시스템 - 특허번호 : PCT/US2020/013639 - 출원일 : 2020.01.15. - 등록일 : 2020.07.23. - 특허권자 : 조지아 테크 리서치 코포레이션 나노입자 조성물은 이온화가능한 지질, 인지질, PEG-지질, 및 D-스테롤 고리 근처에서 히드록실 기로 변형된 콜레스테롤을 포함하는 것으로 개시된 나노입자 조성물은 간세포(hepatocyte)보다는 간 쿠퍼 세포(Kupffer cell) 및 내피 세포(endothelial cell)를 더욱 우선적으로 표적화할 수 있다. 이는 치료 mRNA를 신체의 특정 조직에 효과적으로 전달하기 위한 조성물 및 방법을 제공하고 이로써 기능장애 쿠퍼 세포 및 내피 세포가 질환 발병기전에 관여하는 간 질환을 치료하는 데 유익할 수 있다.
선행기술인 Ionizable lipid (MC3) 및 PEG lipid, 콜레스트롤 등을 상위개념으로 일부 하위개념들을 선택적으로 포함하는 구성인 지질나노전달체를 청구범위로 하여 기존 LNP에 비해 이질적이거나 동일하더라도 현저한 효과를 가진 LNP를 개발할 수 있다면, 선택발명의 특허요건을 만족함과 동시에 구성요건 완비 원칙을 회피할 수 있을 것이다.
개발과제의 기대효과
기술적 기대효과
- LNP를 구성하는 각 지질들의 개선방안들과 그에 따른 효과들을 이용한다면 개발자가 원하는 방향의 고성능 LNP 약물을 제조하는 데 도움이 될 수 있다.
- LNP 표면 형태(morphology)에 따른 유전자 전달 효율에의 영향을 알고 적절한 지질상 및 형태를 설계할 수 있다.
경제적, 사회적 기대 및 파급효과
- 백신을 개발할 때 중요한 것은 신속하게 개발을 진행하는 것과 개발 비용을 절감하는 것이다. mRNA백신의 특징이 핵산물질의 개발이 빠르게 이루어질 수 있는 점을 감안하면, 이 때 이미 연구가 진행된 LNP나 구성 지질 성분을 이용한다면 개발 목표를 더욱 빠르게 이루어낼 수 있을 것이다.
- 효율적일 수 있는 지질을 테스트 전에 평가하는 기준을 제시해 동물 실험, 임상 실험에 들어갈 비용을 절감하는 데 도움을 줄 수 있을 것이다.
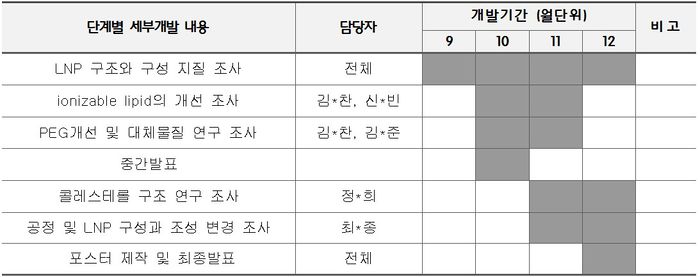
기술개발 일정 및 추진체계
개발 일정
5인 각각이 조사를 진행하였으며, 주 1회 이상 모임을 가져 조사 내용을 공유하며 설명,발표하는 시간을 가졌음.
주 1회 조사한 내용을 종합하여 조교님께 제출하여 피드백을 받음.
본론
이론적 배경
약물 전달 경로
핵산이라는 약물을 전달하기 위한 LNP의 성능을 향상시키기 위해서는 이 약물이 전달되는 경로에 대하여 이해하는 것이 가장 중요하다.
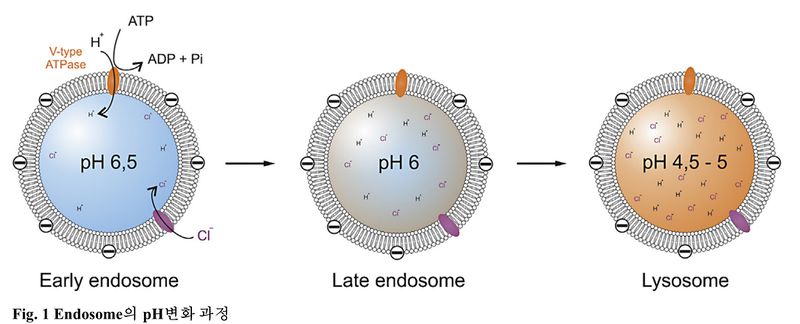
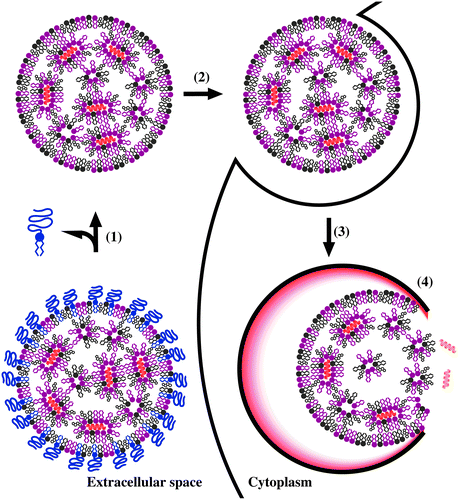
이 LNP는 Intravenous injection(IV) 혹은 Intramuscular injec-tion(IM) 경로로 체내에 주입되는 것이 일반적이며, 체내로 들어온 약물은 세포 내로 이입되게 되고(endocytosis), 이후 핵산물질이 세포질로 이동해서 작용하게 된다. 이 때 endocytosis의 가장 일반적인 경로는 clathrin-mediated endocytosis이다. 그리고 이 clathrin-mediated endocytosis는 세포 내로 유입된 소포가 초기 엔도솜을 거쳐 리소좀에서 분해되어 소멸되는 경로를 거치게 된다. 이 과정은 V-type ATPase가 엔도솜에 proton을 제공하여 엔도솜 내부를 산성화시키는데, 초기 엔도솜(pH 6.0-6.5)과 후기 엔도솜(pH 4.5-5.5)을 거쳐 리소좀(pH 4-5)으로 향하면서 산성화되고 리소좀에서 가수분해되는 순서로 세포 내로의 유입을 원하지 않는 물질의 제거가 이루어진다. 따라서 이 엔도솜을 탈출하여 세포질로 약물을 전달시키는 과정이 매우 중요하다. 특히 LNP를 전달 매체로 하여 siRNA를 전달하는 경우에 대한 연구에서 endosomal escape rate는 1~3%에 불과하였다는 결과를 보인 사례도 존재하는 등 이 endosomal escape가 약물 전달에 있어 rate limiting step이라고 볼 수 있다. 즉, 이 부분에 대한 개선이 결과적으로 약물 투여량을 줄이는 효과를 낼 수 있고 나아가 핵산 물질을 활용한 약물의 상용화에 중요한 장벽이라는 것을 시사한다.
하지만 이 endosomal escape가 일어나는 메커니즘은 정확하게 밝혀지지 않았다. 그에 따라 정확히 어떠한 방식으로 구조 개선을 해야 엔도솜 탈출을 개선할 수 있을지에 대한 방향은 확실하지 않다. 아직까지 이 메커니즘을 조사하거나 정량적으로 측정하기 위한 분석방법이 여럿 제시되었지만, 공통된 합의를 이루어내지는 못했다. 그에 따라 현재 개발되는 LNP에 사용된 지질들은 지금껏 제시된 여러 가설들에 기반하여 개발이 이루어졌다.
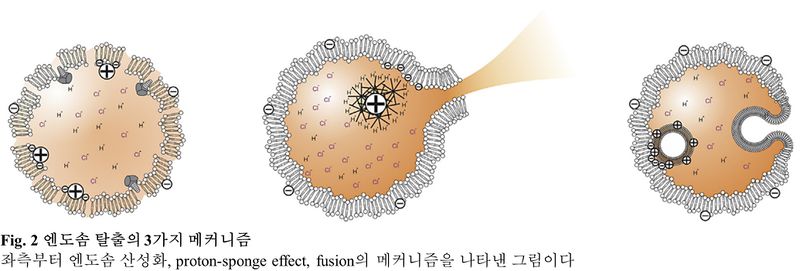
첫 번째 가설은 엔도솜의 산성화가 엔도솜막과 지질의 상호작용을 촉진시키고 이는 엔도솜막을 계속 불안정하게 만들어 작은 구멍을 형성하고 나노물질의 누출을 일어나도록 한다는 것이다. 이 메커니즘은 이후 제시되는 것과는 막과의 상호작용이 직접적으로 막에 구멍을 나게 한다는 점에서 다르다.
다른 가설은 proton-sponge effect이다. 이 가설은 엔도솜 내부가 보다 상대적으로 낮은 pH를 가진다는 점에서 만약 완충효과를 띌 수 있는 물질이 들어간다면 V-type ATPase의 작용을 더욱 많이 일어나게 할 것이라는 주장을 한다. 이 결과로 pro-tonated된 LNP가 막과의 상호작용으로 막을 더 불안정하게 만들 것이고, 또한 LNP 내부 지질 간의 정전기적 반발력이 부피적 팽창을 유도하여 막의 불안정에 기여한다. 또한 지속적인 이온의 유입은 삼투효과를 일으켜 물의 유입을 촉진하게 되고 그 결과 엔도솜이 파괴(rupture)되는 결과를 가져와 내부의 핵산물질이 세포질로 옮겨질 수 있게 한다고 설명한다. 이는 일반적으로 가장 주된 메커니즘으로 받아들여졌다. 이 과정을 잘 일으킬 수 있을 것으로 제시된 지질들은 head group에 아민기를 포함한 지질들이었으며, 그에 따라 연구되는 많은 지질들이 아민기를 포함하거나 또 다른 완충 효과를 할 수 있는 지질들을 기반으로 개발되었다.
또 다른 가설은 막의 융합(fusion)에 의한 메커니즘이다. 이 가설은 마찬가지로 불안정해진 엔도솜막이 나노입자막과 융합하여 내부 물질을 세포질로 방출하게 되는 메커니즘으로 여러 helper lipid들이 이 효과를 위해 LNP에 추가되었다. 그 중 하나인 콜레스테롤 또한 여러 다른 기능도 있지만 이 막과의 융합성(fusogenicity)를 향상시키기 위한 목적으로 LNP에 포함되었다고 한다. 지금까지 약물의 전달능력을 향상시키기 위해서 약물 전달 메커니즘에 대하여 살펴보았다. 이를 정확히 분석할 수 있는 방법이 나와준다면 LNP를 통한 핵산물질 전달은 더욱 발전할 수 있을 것이다. 하지만 그 메커니즘이 확실하게 밝혀지지 않은 지금, 약물의 상용화 및 개선을 위해서 이루어지는 연구들은 전달 능력의 개선에 대한 수치적 비교 뿐 아니라 targetting, cytotoxicity 등 또 다른 측면에서의 연구 등을 통해 활발하게 이루어지고 있다.
지질의 정량적 평가법
여기서는 본 리뷰에서 리뷰한 연구들의 보편적인 실험 과정에 대해 설명한다. 합성된 지질들은 실제 사용 환경과 비슷하게 LNP를 형성한 뒤 in vitro screening, in vivo screening(mice, rat, Non-human Pri-mates)을 거쳐 검증을 진행한다.
먼저 in vitro screening의 경우는 HeLa세포주와 luciferase를 이용하여 screening을 거치게 된다. siRNA 전달을 목표로 하는 경우 HeLa 세포주에 firefly luciferase와 Renilla luciferase를 발현시키도록 만든 뒤 LNP에 antifirefly luciferase RNA를 집어넣어 전달시켜 얼마나 firefly 발현이 억제되는지, 그와 동시에 Renilla에는 변화가 없는지를 확인하여 전달능력과 세포독성(cytotoxicity)을 평가하는 것이 일반적이다. mRNA의 경우에는 firefly를 생산할 수 있는 mRNA를 전달하여 측정을 하는 방식이 일반적이다. 물론 in vitro screening은 체내와 환경이 달라 체내 전달과 상당히 다른 결과를 내는 경우가 자주 있어 이것으로 최적의 지질을 판단하기에는 무리가 있다. 다만 번거로운 절차, 시간, 비용이 들어가는 in vivo screening에 앞서 적절하지 않은 것으로 판단되는(낮은 전달, 세포독성) 지질을 선상에서 제외하기에 적절하다고 할 수 있다.
다음으로 in vivo screening의 경우에는 흔히 혈액 응고에 기여하는 제7인자 (Factor VII)에 대한 억제를 측정하는 것이 siRNA 측정에는 일반적이다. 7인자는 간조직에서만 생성되며 혈액으로 분비되어 정량화가 쉽다는 특징을 가진다. 이 때부터는 필요에 따라 다양한 여러 핵산물질이 사용되기도 한다(주로 정량적 측정이 용이함이 주된 선택의 기준이다). 면역 반응이나 항체 생성 확인을 위해 인플루엔자 바이러스 mRNA를 넣는 등이 그 예이다.
조사 내용
Ionizable lipids
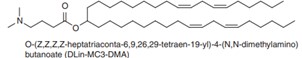
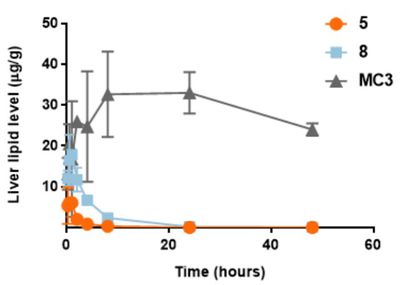
Ionizable lipid는 앞서 설명했던 endocy-tosis 등의 과정에 중요한 영향을 미치는 지질이다. 상술했듯 완충작용을 할 수 있는 아민기를 가진 지질들이 여럿 제시되었고, 그 중에서 가장 성공적으로 상용화에 성공한 지질이 DLin-MC3-DMA(이하 MC3)이다. 이 지질은 siRNA 전달을 이용한 RNAi 치료에 사용하기 위해 개발되었고 최초의 상용 RNAi 치료제인 Onpattro에 사용된다. 이 지질의 주요한 개선점으로 지적되는 점은 체내에 너무 오래 잔류한다는 점이다. 연구에 따르면 다양한 투여 경로에서 24시간까지도 유의미한 체내 농도를 유지한다는 사실이 확인되었다.
생분해성을 높이기 위한 연구
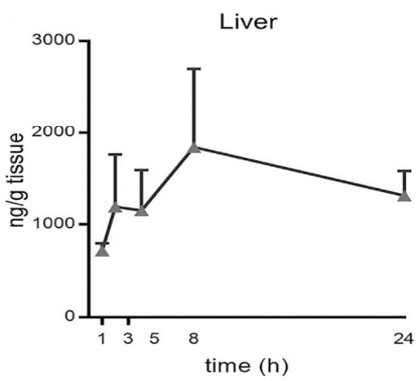
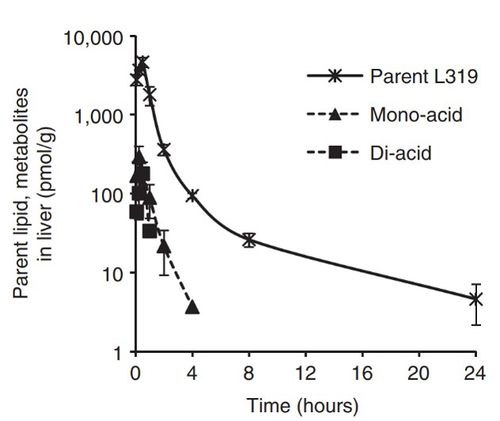
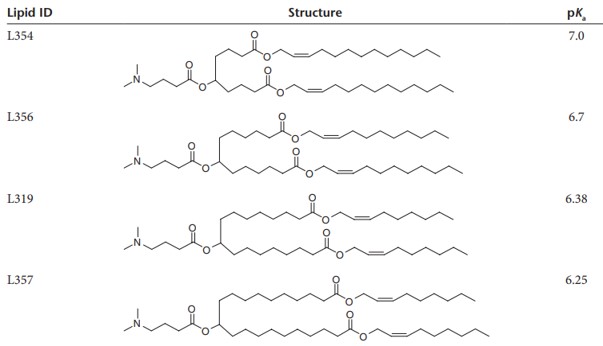
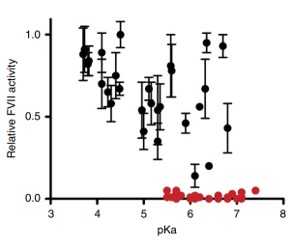
의도한 것보다 더 긴 체내 잔류는 의도하지 않은 부작용의 가능성을 시사하므로 투여한 약물이 적절하게 체내에서 제거되는 것은 아주 중요하다고 할 수 있다. 따라서 체내에서 자연스럽게 가수분해되어 제거될 수 있는 생분해성을 추가하는 것이 개선의 방향으로 지목되었다. 그 방법으로 Martin A. Maier 등은 지질의 소수성 꼬리부분에 에스터를 추가하여 가수분해 가능한 구조로 만드는 방법을 제시했다. 이 방법으로 앞서 설명한 MC3에 에스터를 추가한 여러 지질들이 제시되었다. 지질들은 에스터의 위치를 다르게 하는 방식으로 만들어졌고 그에 따른 영향을 측정하였다. 투여 방법은 IV로 진행되었다. 만들어진 지질 중에서 L319가 체내에서 빠른 속도로 제거되는 것을 확인했으며 mono-acid와 di-acid도 확인되어 에스터가 분해되는 것임을 확인했다. L319에 비해 에스터기가 헤드그룹으로 이동할수록 pKa 높아지는 것을 확인할 수 있었다. 엔도솜 내부의 pH가 낮은 것이 엔도솜 탈출에 중요한 요인인만큼 이 L319 지질의 pKa값이 기존 연구에서 제시된 적절한 pKa범위인 6.2-6.5에 존재한다는 사실은 본래의 기능을 잃지 않으면서도 생분해성을 추가할 수 있음을 보여주었다. 또한 이 연구에서 에스터기 끝에 tert-butyl기를 추가한 지질에 대하여도 분해성을 측정하였는데 이 경우에는 작용기의 입체적인 방해로 분해능력을 잃음도 확인할 수 있었다.
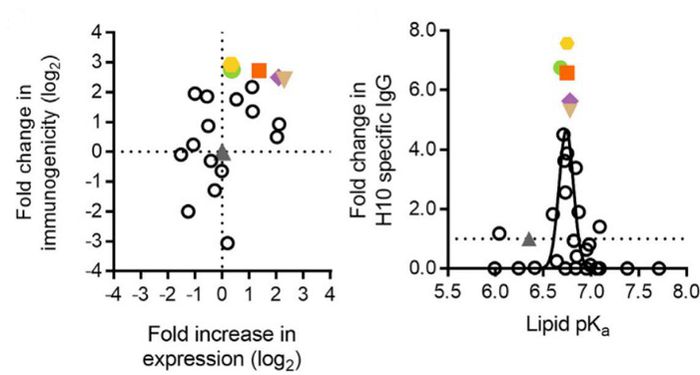
이런 연구에 힘입어 추가적인 연구들이 진행되었는데, 먼저 Staci Sabnis 등에 의해 수행된 연구는 mRNA를 전달하기 위한 지질을 개발하였다. 마찬가지로 아민기를 포함하는 지질이지만 이번에는 2차 에스터를 추가하여 그 영향을 확인하였다. 이번에도 중요한 판단의 요소인 pKa와 잔류농도를 기반으로 테스트 한 결과 두 개의 1차 에스터를 추가한 경우 pKa값이 너무 높아졌고 하나의 1차 에스터와 하나의 2차 에스터가 들어간 경우에 적절한 pKa를 보였다. 이 연구에서는 그 결과물로 lipid 5를 제시하였다.
이후 Kimberly J. Hassett 등에 의해 mRNA전달을 위한 LNP의 IM injection에 대한 연구들도 진행되었다. 투여 경로가 달라지게 되면 지질의 성능 평가도 다시 이루어져야 한다. 둘의 차이점을 간단히 설명해보자면 IV의 경우는 혈관을 통해 주사하기 때문에 순환계를 통해 몸 전체에 퍼질 수 있으며, 주로 간에 축적된다. 하지만 백신 등의 경우 다양한 사람들이 맞아야 하고 주사부위에 대한 반응성, 내약성(tolerability) 등이 좋아야 한다는 점에서 IV는 부적합하다. 이걸 위해서는 근육에 주사하는 것이 효과가 좋다. 그래서 기존에 siRNA용으로 연구된 지질들에 대해 mRNA를 IM injection할 때 좋은 효과를 보이는 지질을 찾기 위한 연구가 진행되었다. 연구의 결과로 제시된 결과 먼저 in vitro screening에서 LNP안에 firefly lucifer-ase와 인플루엔자 항체를 동시에 넣어서 발현을 측정한 결과 둘의 상관관계가 있지만 동일시하기 힘들 다는 결과를 얻었다. 즉, firefly luciferase 발현을 측정하는 것만으로 좋은 성능을 가지는 지질을 판단하기에는 무리가 있다는 점이었다. 또한 신기한 점 중 하나는 IV에서 좋은 단백질 발현을 보인 지질도 IM에서 좋지 않은 결과를 보인 경우가 있었다는 점이다. 다음으로 얻은 결과는 좋은 immunogenicity를 가지는 지질의 pKa값에 대하여 조사한 결과 IV와는 다른 6.6-6.9에서 최적의 결과를 보여주는 것을 확인했다.
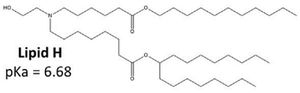
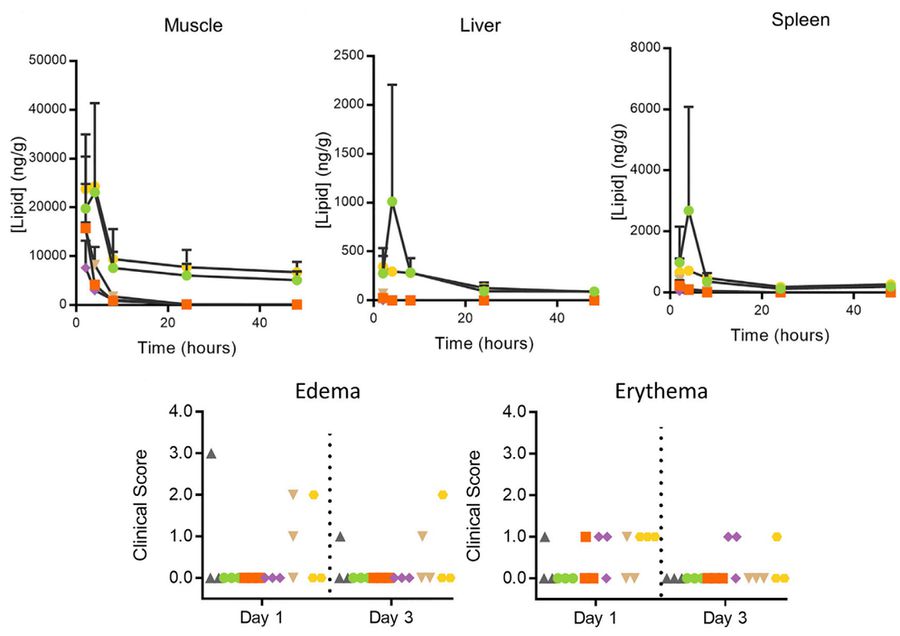
항체 발현이 우수한 5개의 지질(색깔 마커)에 대해 생분해성과 내약성(tolerability)를 측정했다. 그 결과 가장 좋다고 판단된 Lipid H는 현재 모더나에서 생산중인 COVID-19 백신인 mRNA-1273에 이용되고 있다. 하나 살펴볼 점은 이 Lipid H가 가장 좋은 생분해성을 보인 지질이 아니었다는 점인데, 좋은 생분해성이 독성을 줄여주고 내약성에 도움이 되지만 또 다른 요인들이 존재한다는 점을 잊지 않아야 할 것이다.
Combinatorial chemistry를 이용한 지질의 합성
이와 같이 MC3를 기반으로 시작한 지질들의 개선에 대해 살펴보았다. 다른 한편으로 구조와 성능 개선 간의 관계를 잘 파악하기 힘든 만큼 양적 측면에서의 접근법을 취한다면 통계적 접근을 가능하게 해 앞으로 있을 지질 개선에 기여할 수 있다. 그에 따라 사용된 방법이 조합화학(combinatorial chemistry)을 이용한 지질의 대량 합성이다. 수많은 종류의 반응물을 모두 집어넣은 라이브러리를 만들고 반응시켜 나오는 모든 생성물을 그 결과물로 취하는 방식을 통하면 한번에 많은 지질을 만들 수 있을 뿐 아니라, 기존 합성 방식에서 존재하는 여러 반응을 거치고, 특정 작용기에 보호처리, 정제, 용매제거 등의 과정을 거치지 않아도 된다는 장점이 있다. 일련의 연구들은 이런 라이브러리를 통해서 좋은 지질을 찾기도 하지만 그보다 구조와 지질의 관계를 통계적으로 설명하기 위한 많은 시도들을 하였다.
Akin Akinc 등에 의해 siRNA 전달을 위하여 Alkyl-acrylate, alkyl-acrylamide가 아미노 분자와 결합하여 만들어진 수백개의 지질유사체(lipidoid)들이 만들어졌고 좋은 성능을 보인 지질들에 대한 통계적 분석을 한 결과로 4가지 요소를 얻을 수 있었다.
- 연결부가 아민
- 알킬 꼬리가 2개 이상
- 꼬리의 탄소가 8-12
- 아민에서 꼬리 하나가 치환이 안된 형태, 즉 2차 아민인 경우
Kevin T. Love 등도 아민과 에폭사이드를 합성하여 siRNA 전달을 위한 120여개의 아미노알콜 라이브러리를 만들어냈다.
그 중 좋은 결과를 보인 것들의 특징들은 다음과 같다.
- 최고성능 15개중 7개의 유사지질이 꼬리길이가 14 carbon이었음
- 꼬리가 12 carbon 미만인 물질은 침묵효율이 30%를 넘지 못함
- 113번 아민이 탑 2를 차지하고 탑 15 안에 3개나 있었음
- 그럼에도 113번 아민과 14 carbon의 조합이 무조건 좋은건 아님 또 siRNA가 낮은 경우에(저용량) 높은 침묵을 가능하게 하는 물질도 확인함
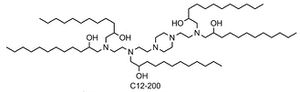
그 결과 이 논문에서 제시하는 물질은 C12-200이다.
이 지질에 대해 endocytosis를 분석한 결과가 상당히 의미있었는데, clathrin mediated endocytosis가 아닌 macropinocytosis일 것이라는 결과를 얻을 수 있었다. 이 macropinocytosis는 macropinosome을 형성하는데 일부 세포의 경우에서 앞서 설명한 일반적인 분해경로와 별개인 경우가 있다고 함. 이를 통해 리소좀에서 분해되는 것을 회피하여 좋은 성능을 보였을 가능성에 대하여 제시하였다.
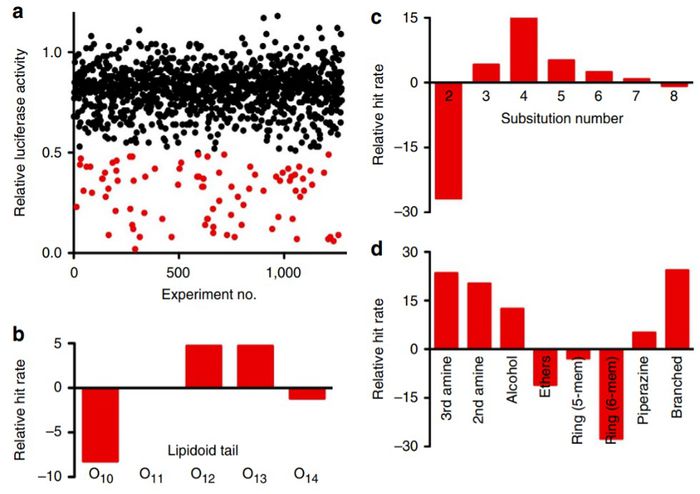
또 Kathryn A. Whitehead 등에 의해서 좀 더 의미있는 수량의 라이브러리를 통해 통계적인 분석에 초점을 맞춘 연구가 이루어졌다. 앞선 연구들에 기반하여 siRNA 전달을 위해 280개의 알킬 아민과 10-14의 카본체인을 갖는 아크릴레이트 5가지로 생분해성을 가지는 1400종의 lipidoid를 포함하는 라이브러리를 만들었다. 이들이 좋은 성능을 보인 지질들에 대해서 얻은 통계의 결과는 다음과 같다.
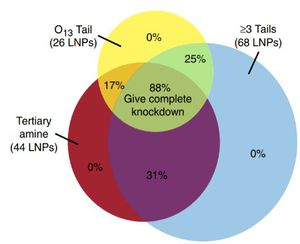
O13꼬리를 가지며 꼬리의 개수가 3개 이상이고, 3차 아민을 가지는 지질의 88%가 좋은 성능을 보여주었다. 이에 더해 중요한 지표 중 하나인 pKa가 5.5 이상이라는 범위까지 포함한 4가지의 기준을 제시하였다. 이후 pKa를 제외한 3가지 기준을 만족하는 12개의 lipidoid를 포함하는 라이브러리를 만들었고 이 라이브러리에 대하여 성능을 평가하였다. 그 결과 두 개를 제외한 나머지의 경우 pKa가 적절 범위였고, 성능도 준수한 수준을 보였다. 이렇게 기준을 세움으로써 in vivo screen-ing 전에 성능이 괜찮을 것으로 예상되는 후보군을 추리는데 도움을 줘 시간적, 물적 자원을 아낄 수 있을 것으로 제시했다.
PEGs
Polyethylene glycol(PEG)는 LNP를 구성하는 구성 성분 중 하나로서 LNP 표면에 결합되어 LNP를 보호하고 표적 세포까지 안전하게 약물을 전달하는 역할을 한다. 하지만 LNP에 PEG를 부착하는 PEGylation은 LNP를 보호하여 체내 혈액 순환 시간을 늘리고 표적 세포까지 안전하게 전달할 수 있는 이점이 있는 한 편 표면의 PEG가 LNP와 세포 사이의 상호작용을 방해하고 항 PEG 항체를 유발하는 부작용도 존재한다. 따라서 PEG는 표적 세포에 도달하기 전 혈액 내에선 LNP를 감싸고 보호해야 하며 표적 세포와 상호작용하기 전에는 LNP에서 떨어져 나가야 LNP 약물의 성능이 향상될 수 있다. 이러한 PEG의 특성을 PEG-dilemma라고 하는데 PEG-dilemma를 극복하기 위한 연구들을 소개하고자 한다.
LNP의 크기 조절
LNP의 크기는 LNP가 무사히 표적 세포까지 도달하는 데 있어서 매우 중요한 영향을 미칠 수 있다. 나노 미터 단위의 LNP의 크기는 작으면 작을수록 종양과 같은 질병 조직에 더 효과적으로 침투할 수 있다. 하지만 이번 연구에서 너무 작은 크기의 LNP는 적정 크기의 LNP보다 불안정하여 성능이 떨어질 위험이 있다는 사실을 발견해냈고 이는 PEG-dilemma와 연관이 있을 가능성이 존재한다.
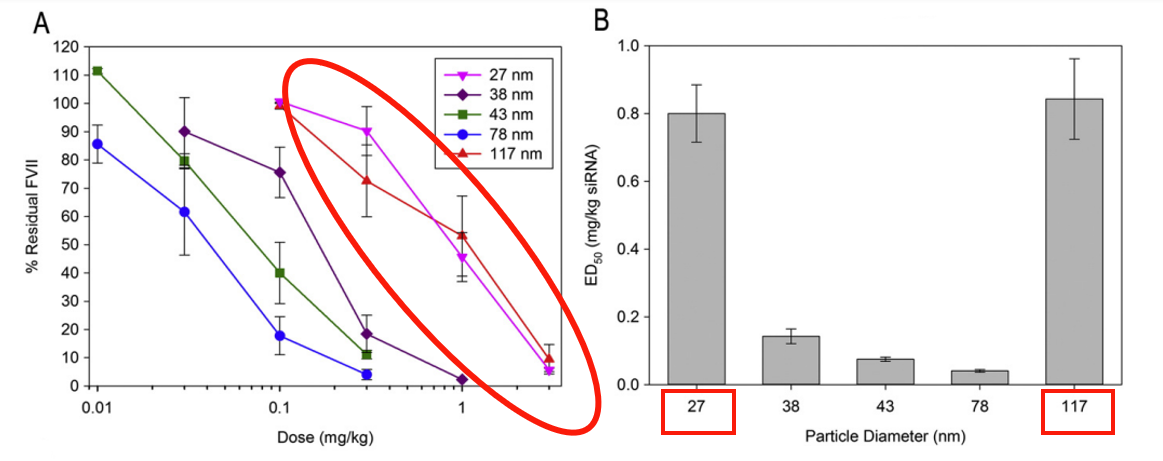
LNP-siRNA 약물을 쥐에 대한 정맥 주사 실험을 진행하여 LNP의 크기에 따른 유전자 침묵 성능을 조사해 보았다. 위의 그래프들은 LNP 약물이 일정 성능을 보여줄 때까지 필요한 LNP 약물의 양을 그래프로 도식화한 것이다. 중간 크기의 78nm LNP가 최대의 효율을 보여줬고 가장 작은 크기의 LNP(27nm)와 가장 큰 크기의 LNP(117nm)는 다른 LNP들보다 성능이 떨어지는 것을 확인할 수 있었다. 가장 큰 크기를 가진 LNP의 낮은 성능은 쥐의 간 모세혈관 구조(약 100-140nm)를 통과할 수 없기 때문일 것이라 추측된다. 하지만 27nm의 가장 작은 크기의 LNP의 성능 감소에 대한 이유는 쉽게 설명되지 않았다.
추가로 진행한 실험에서는 PEG가 LNP로부터 해리되는 속도를 측정하였는데 PEG는 LNP의 크기가 작으면 작을수록 해리되는 속도가 빠른 경향이 있는 것으로 나타났다. 이는 입자의 크기가 작을수록 부피에 대한 표면적의 비가 커져 LNP의 표면에서 PEG가 더 빠른 속도로 해리되는 것으로 추측된다. 작은 크기의 LNP의 PEG가 빠른 속도로 해리되는 것을 성능과 연관지어 고려해보면 표적 세포로 도달하기 전에 PEG가 너무 빠른 속도로 해리되어 LNP를 보호하기에 충분한 양의 PEG가 남아있지 않아 LNP의 성능이 감소되는 것으로 예상된다.
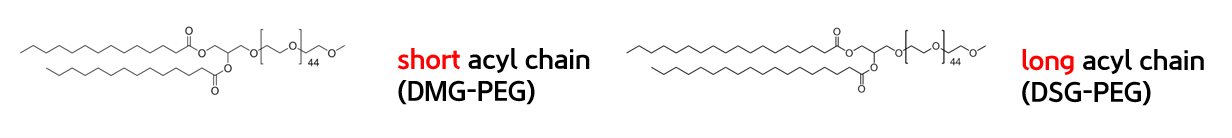
short acyl chain
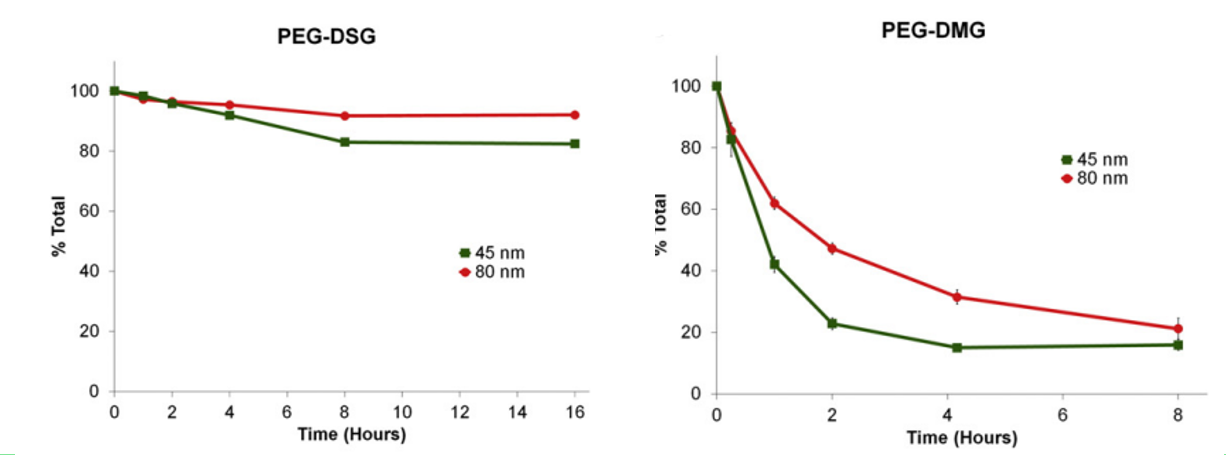
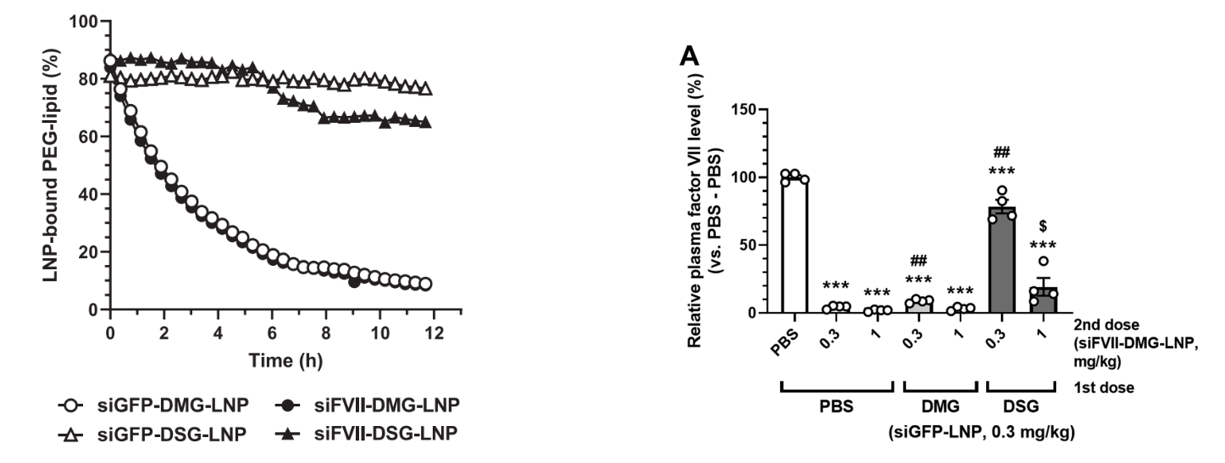
PEG 지질은 PEG 분자의 끝에 있는 소수성 아실 체인을 통해 LNP의 표면에 고정될 수 있다. 이 아실 체인의 길이는 PEG가 LNP로부터 해리되는 속도를 결정할 수 있으며 이 특성을 이용해 PEG-dilemma를 극복하는 전략으로 사용할 수 있다.짧은 아실 체인을 가진 PEG, DMG-PEG와 긴 아실 체인을 가진 PEG, DSG-PEG를 이용하여 실험을 진행했다.
왼쪽 위의 그래프는 각각의 LNP를 쥐 혈청에 배양하고 NMR를 통해 시간에 따른 PEG와 결합된 LNP의 양을 측정한 것이다. 즉 LNP로부터 PEG가 해리되는 속도를 도식화한 그래프이다. 실험 결과 짧은 아실 체인을 가진 DMG-PEG가 더 빠른 속도로 LNP로부터 해리되는 것을 확인할 수 있었다. 또한 LNP 안의 siRNA는 해리 속도에 영향을 주지 않았으며 이는 아실 체인의 길이가 해리 속도에 영향을 주었음을 의미한다. 다음으로 LNP의 성능에 대한 실험을 진행하였는데 siRNA를 이용하여 단백질 발현이 억제된 정도를 측정하여 그래프로 나타내었다. 짧은 아실 체인의 DMG-PEG를 가진 LNP가 긴 아실 체인의 DSG-PEG를 가진 LNP보다 단백질 발현을 확실하게 억제하는 것을 보여주었고 짧은 아실 체인을 가진 PEG-LNP가 더욱 뛰어난 유전자 침묵 성능을 가진 것을 확인할 수 있었다.
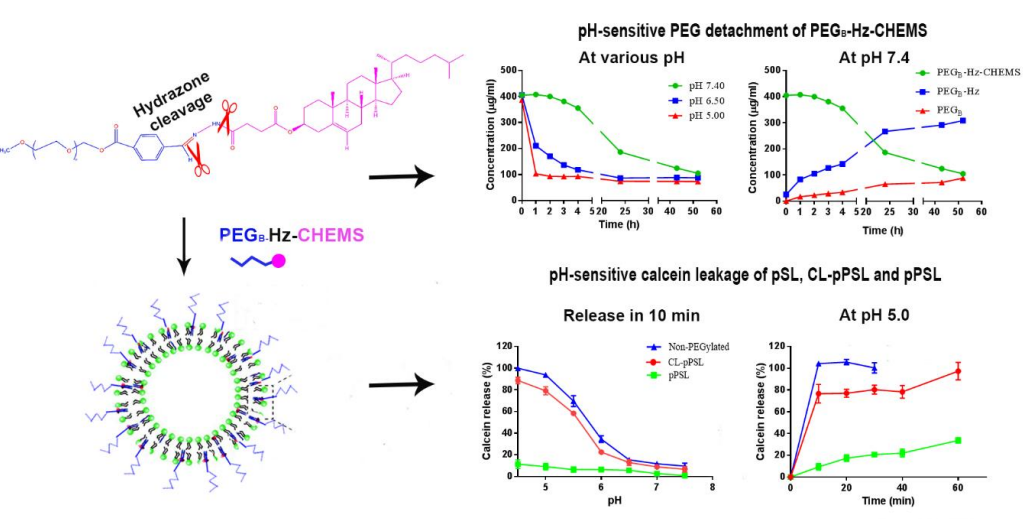
pH-labile PEGylation
PEG-dilemma를 극복하기 위해 수많은 방법중 하나는 주변 pH 환경에 민감한 결합을 PEG에 도입하여 표적 세포의 안과 밖에서 PEG를 선택적으로 제거하는 pH-labile PEGylation 이다. 혈액 내와 같은 생리학적 pH인 약 7.4에서는 PEG 결합을 유지하여 LNP를 보호하다가 세포 내부 환경(엔도좀,라이소좀)의 pH인 약 5.5에서는 결합이 끊어져 PEG가 제거되며 표적 세포와의 상호작용이 잘 이루어 질 수 있게 하는 원리이다. pH-sensitive 결합이 도입된 PEG-Hz-CHEMS 약물은 다른 LNP들과 비교하였을 때 pH 7.4 환경에서 느린 속도로 해리되며 안정적으로 LNP를 보호하였으며 pH-sensitive 결합이 2개 존재하는 PEG-cleavable pH-sensitive liposomes (CL-pPSL)은 주변 pH환경에 더욱 더 민감하게 반응하며 PEG를 배출하는 것을 확인할 수 있었다
Alternatives for PEGs - POEGMA
PEG의 문제점 - 항원성
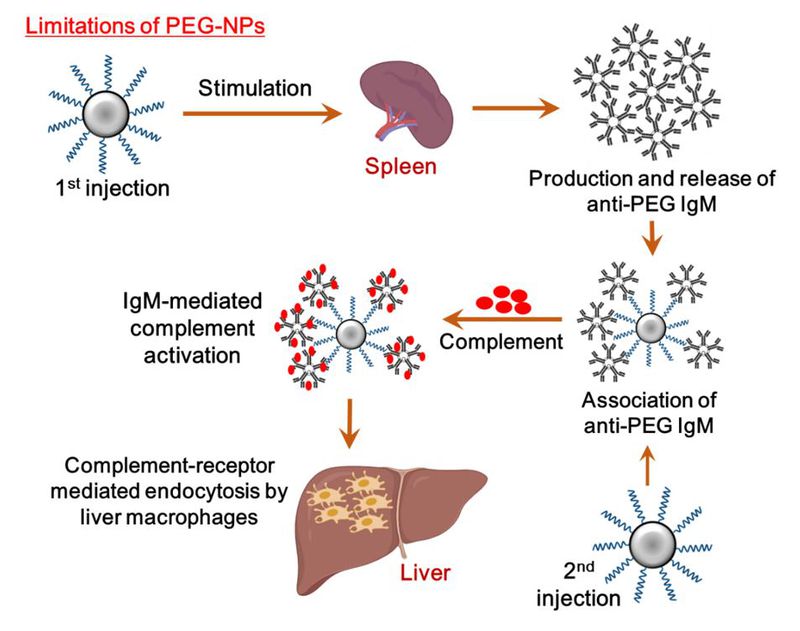
EG화된 약물의 투여는 항-PEG항체(IgM)의 생성 및 면역반응을 일으킬 수 있다.(그림2) 이러한 현상으로 PEG가 결합된 나노전달체의 투여는 때로 첫 투여 때에만 생물학적 이점을 제공하며, 두 번째 투여에서는 비장과 간에서 식세포 시스템에 의해 인식돼 혈액에서 빠르게 제거된다. 이를 ABC현상(Accelerated Biological Clearance)이라 하는데, 특히 체내 항PEG IgM의 비율은 PEG화된 나노전달체의 효능에 있어 중요한 지표로 볼 수 있다. 최근 유행하는 코로나와 관련해 유명한 백신 중 하나인 화이자 백신을 접종받은 사람들 중 소수가 경험한 알레르기 유사반응의 원인은 백신의 주요성분을 구성하는 물질인 PEG때문인 것으로 추측되고 있다. PEG는 수많은 약물과 가공식품, 개인 미용, 청소 제품 등에 사용되어 왔지만, 지금껏 승인된 백신에 사용된 적이 없었기에 PEG와 생체 내 면역반응이 큰 문제가 된 것이다.North Carolina 대학교의 새뮤얼 라이가 2016년에 발표한 연구결과에 따르면, 약 72%의 사람들이 PEG에 대한 항체를 어느 정도 보유하고 있으며, 약 7%정도가 아나필락시스 반응의 원인을 제공할 정도의 높은 수준의 항체를 보유하고 있다고 보고되었다. 즉, PEG 약물을 접해본 사람뿐만이 아니라, 한번도 PEG화된 약물로 치료받은 적 없는 사람에게도 항PEG IgM이 발견될 수 있다는 것이다. 실제로 PEG가 수많은 일상 제품들의 재료로 이용되어왔기 때문에 항PEG 항체에 관한 본 연구결과는 타당해보이고, PEG 약물을 사용하는 안정성에 대한 상당한 우려가 예상된다.[Analysis of pre-existing IgG and IgM antibodies against polyethylene glycol (PEG) in the general population Qi Yang, Samuel K Lai]
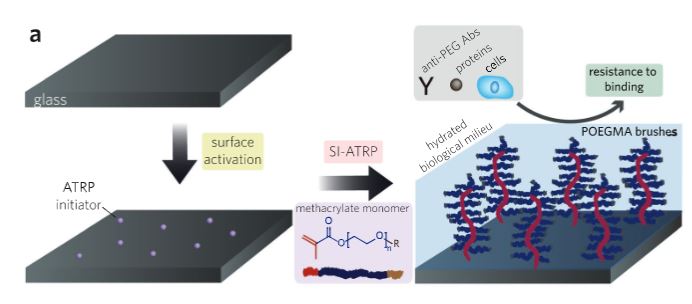
대안제시 - POEGMA
이러한 PEG의 대안으로, poly(oligo(ethylene glycol)methyl ether methacrylate)(이하 POEGMA)가 제시된다. POEGMA는 병-브러쉬 (bottle brush) 구조를 가진 PEG의 파생모델로, PEG와 같은 stealth기능과 non fouling 특성을 보여준다. FDA 승인을 받은 통풍 약물 Krystexxa의 최근 연구에서, 약물 - POEGMA 결합체가 평균 9개의 EG단위(이하 "EG9")의 곁사슬 길이를 갖는 것이 환자의 혈장에서 PEG항원을 현저히 감소시켰다는 것을 발견했다. 또한 같은 연구에서, POEGMA 곁사슬 길이를 EG9에서 EG3로 단축시키면 환자 혈장 검체의 Anti-PEG Antibodies (이하APA)에 대한 약물 - POEGMA 결합체의 반응성이 사실상 제거되고 동물 모델에서 생체내 약동학이 크게 변하지 않고 작동하는 것이 확인되었다. 따라서 대부분의 PEGylated 제품에 사용되는 긴 선형 PEG구조를 POEGMA(일반적으로 <= EG9)의 짧은 초분지 구조로 대체한다면, 스텔스 기능을 유지하면서 항원성을 완화하는 성공적인 대안이 될 것으로 예측된다. 체인길이 EG1에서 EG9까지의 항원 반응성을 조사하기위해서, 실험은 고체표면에서 박막으로 자란 POEGMA 브러시에 대해 연구가 진행되었다.[Architectural Modification of Conformal PEG-Bottlebrush Coating Minimizes Anti-PEG Antigenecity While Preserving Stealth Properties Daniel Y. Joh]
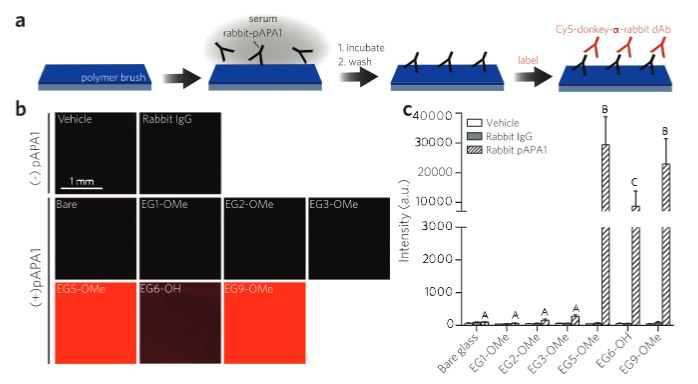
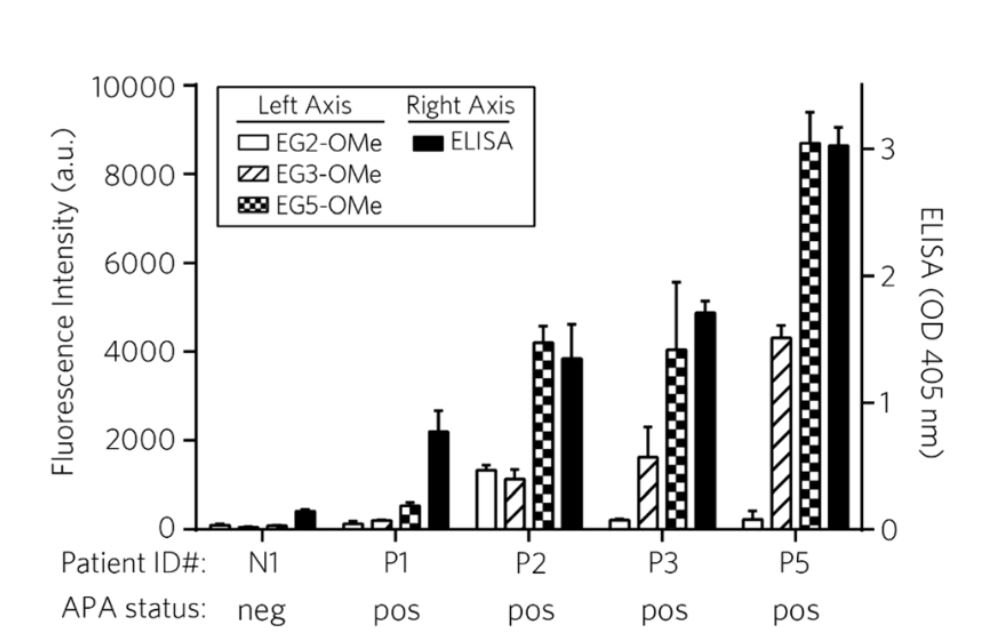
항PEG항체 결합성 실험
그림 a에서 그려진 것처럼, 형광물질을 이용해 토끼에서 유래한 폴리머 APA에 대한 폴리머 코팅의 반응성을 검토했다. 형광 강도는 폴리머 표면에 결합된 APA의 표면 농도에 따라 커질 것으로 예상된다. EG5-OME, EG6-OH 및 EG9-OME 표면에 대한 형광은 크게 증가한 반면, EG1-OME, EG2-OME 및 EG3-OME 표면에서는 거의 기준선에 가까운 반응을 보였다.(그림 c) 이는 poly APA1에 대한 반응성이 EG3 및 더 작은 사이드체인이 있는 POEGMA 브러시 표면에 대해 상당히 낮음을 나타낸다. 물론 EG3>EG2>EG1의 순으로 형광이 감소하긴 했지만, 이러한 차이가 EG5 이상의 사이드체인과 비교했을 때 통계적으로 유의미하지 않았다. 또한 EG6-OH 표면이 poly APA1에 명확히 반응하긴 했지만, EG5-OME 및 EG9-OME에 비해 낮은 반응이 관찰되었고, 이는 메톡시 말단 PEG 면역 물질에서 유래한 APA에 대해 메톡시 말단 PEG보다 하이드록시 말단 PEG가 항원성이 더 낮다는 것을 보여준다.
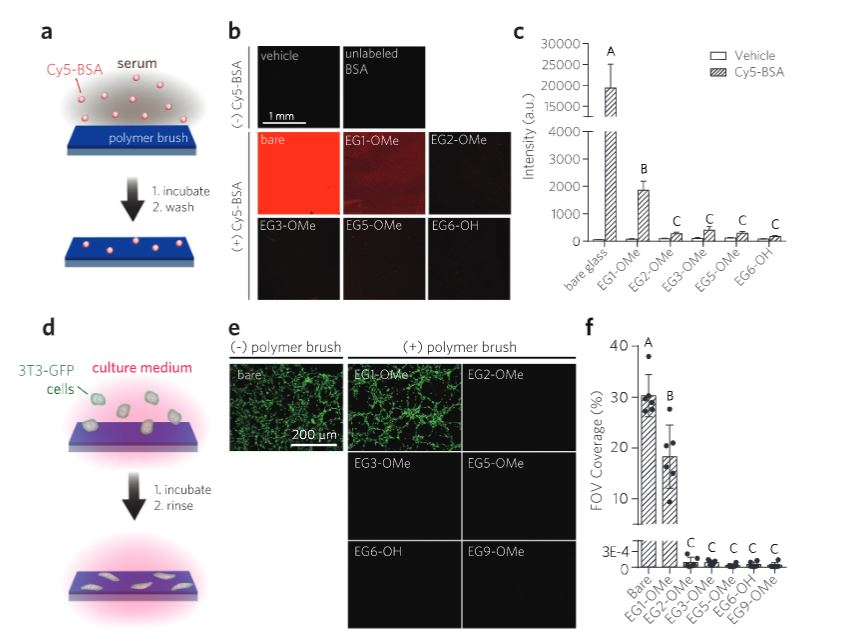
BSA 및 배양섬유아세포 비특이적 반응 실험
다음으로, 이러한 표면에서 단백질과 세포의 비특이적 결합을 방지하는 능력을 평가해 POEGMA 브러시의 stealth 기능을 비교했다. (위 그림) 단백질 흡착은 표면에 흡착하는 경향으로 잘 알려진 단백질 BSA(소형청알부민)를 사용했다. 표면에 결합된 잔류 BSA를 검출하기 위해 형광 스캐너로 이미지를 찍었고,(그림 a) 각 표면의 원시 형광 강도는 그림 b에 나타나있다. 그림 c에서, 코팅되지 않은 유리표면은 비특이적 흡착이 가장 높게 나타났고, EG1-OME 코팅은 전체 결합을 어느정도 감소시켰지만, 상당한 형광 반응을 관찰했다. 반면 EG2 이상인 POEGMA 브러시는 상당히 낮은 비특이적 BSA 흡착을 보였다. 그림 d에서 배양된 섬유아 세포가 표면에 부착하는 것을 조사했을 때도 유사한 경향이 관찰된다. BSA실험과 유사하게 코팅되지 않은 표면과 EG1-OME 표면 모두에서 상당한 부착이 관찰되었고, EG2 이상의 긴 사이드체인을 가진 POEGMA 브러시에서는 사실상 제거되었다. (그림 e,f)
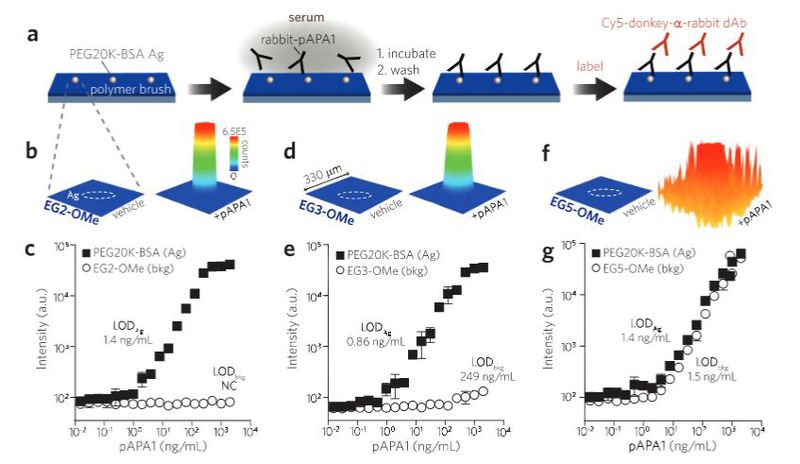
PEG와의 직접 비교
이러한 실험은 EG2-OME 및 EG3-OME POEGMA 표면이 APA 반응성, BSA흡착 및 세포부착을 최소화 하는 조건을 충족시키는 가장 좋은 후보군임을 시사한다. 이 실험들을 바탕으로, poly APA1과 POEGMA 브러시의 결합을 선형 PEG 결합과 직접 비교하였다. PEG 단백질 접합체의 마이크로스팟을 EG2-OME, EG3-OME, EG5-OME POEGMA 브러시 위에 고정시켰고, APA1에 노출되어 형광 스캔 하였다. 그림 c에서, EG2-OME POEGMA는 최소한의 값을 보여주나, PEG의 경우 poly APA1 농도에 비례하는 신호를 보여주었다. EG3-OME 표면 역시 유사한 모습이 관찰되었다. 대조적으로, EG5-OME POEGMA 표면에 대해 급격한 반응성 손실이 일어나는 것을 관찰했다.
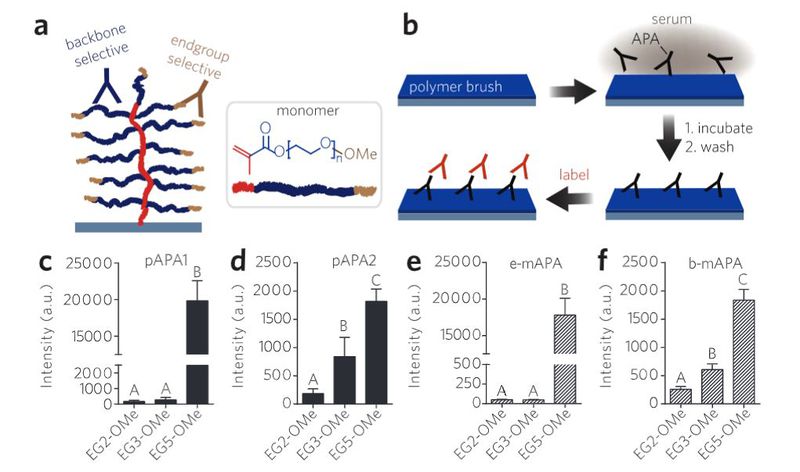
EG2-OME와 EG3-OME의 선택적 항체와의 반응 실험
다음으로 PEG(메톡시 말단기 vs backbone)의 다른 구조적 특징을 대상으로하는 APA가 POEGMA 브러시 표면과 상호작용하는 방법을 더 잘 이해하기 위한 실험이 진행되었다. PEG backbone에 선택적인 다른 poly APA2와 기존의 APA1로 EG2와 EG3 표면의 반응도를 측정했다. 이전에 관찰된 것과 같이 EG5-OME에 비해 EG2-OME와 EG3-OME는 pAPA1 결합에 저항성이 있었다.(그림c) 그러나 pAPA2에 노출된 후, EG3-OME 표면과 EG5-OME 표면 모두 상당한 pAPA2 결합이 관찰된 반면, EG2-OME 표면은 내성을 유지했다.(그림d) 이러한 결과는 EG3-OME POEGMA 브러시가 그룹 내 반응성 APA에는 선택적 저항할 수 있으나, Backbone 반응성 APA에는 저항할 수 없다는 것을, EG2-OME는 두 가지 모두에 저항할 수 있음을 보여준다. 이러한 결과들에 의해, 다음과 같은 점을 추론할 수 있다. 첫째로, POEGMA 병 브러시의 사이드 체인을 EG3정도로 짧게하면 end group 선택형 APA에 대한 반응성이 제거된다. 특히, 이는 메톡시 말단을 보다 반응성이 높은 하이드록시 엔드 그룹으로 대체할 필요 없이 달성된다. 둘째로, Backbone 선택형 APA에 대한 반응성을 피하기 위해서는 EG3에서 EG2로 사이트체인 길이를 더 줄여야한다.
실제 환자 혈장에 대한 최종 항원성 평가
마지막으로 이전에 PEGylated 약물인 Krystexxa로 치료된 환자의 혈장 샘플에 EG2-OME, EG3-OME, EG5-OME POEGMA 브러시 코팅의 반응성을 조사했다. 환자 혈장에 대해 간접ELISA를 수행해 Adagen(PEGylated Adenosine Deaminase)에 대한 IgG 결합 수준을 정량화 한 후, 서로 다른 환자 4명 (P1-P4)과 APA 음성인 환자(N1)에 대해 테스트를 진행했다. N1은 기준 값을 보였고, P1-P4는 예상대로 아다겐에 대한 반응성에 대해 양성 반응을 보였다. 이러한 샘플은 EG에도 적용되었고, 당연히 EG2-OME 표면은 APA 양성 검체에 대한 그룹 내에서 가장 낮은 수준의 반응성을 보였다. 흥미롭게도 P2의 경우 EG2-OME의 형광이 다른 샘플에 비해 약간 증가했고, 이는 EG3-OME와 유사했으나 EG5-OME보다는 훨씬 작은 정도였다. 대체로 인간 혈장에서 얻은 실험 결과 역시 위에서 관찰된 발견과 유사하며, PEG 유도 병 브러시의 항원성은 EG사이드 체인 길이와 관련이 있다.
이러한 연구 결과에 따라, APA 항원성과 BSA 흡착 및 섬유 아세포 접착을 이용해 EG2-OME, 그리고 조금 낮은 정도로는 EG3-OME POEGMA 브러시 표면이 두 속성을 최소화 하는 최적의 구조를 가진 것으로 확인되었다.
특이하게도, EG3-OME 병 브러시 표면이 Backbone 선택형 APA에 대한 결합 수준은 낮지만 일부의 결합을 보인다는 것을 볼 수 있었다. EG3-OME 병 브러시가 Backbone 선택형 APA를 결합하는 경향은 POEGMA 사이드체인에서 메톡시 엔드 그룹이 백본보다 더 "노출"되기 때문에 다소 반직관적이다. 따라서 이 현상을 명확히 하기 위해서는 추가적인 연구가 필요하다고 본다.
추가로 일부 환자는 PEG에 강력한 면역반응을 보이는 반면 다른 환자는 그렇지 않은 이유에 대해 아직도 논란이 있으며, 본 연구 결과는 APA에 대한 POEGMA의 항원성에 초점을 맞추고 있어, 면역 유발성에 대해서는 조사하지 않았기 때문에 본 연구의 해석에 있어 주의해야 한다는 점을 강조한다. 따라서 POEGMA 접합체에 대한 노출이 강력한 체액성 면역반응을 유도할 수 있는지 여부에 관해서는 더 많은 연구가 필요하다 할 것이다. 그럼에도 불구하고, 본 연구 결과는 PEG의 항원성에 관한 우려와 관련하여 다양한 분야에서 PEG의 잠재적 대안으로서 연구될 수 있을 것으로 보인다.
콜레스테롤의 역할과 구조
콜레스테롤은 코어쉘 구조의 LNP가 형성되는 과정에서 ionizable lipid와 융합될 때 막의 무결성(integrity) 및 경도(rigidity)를 조절함으로서 입자 안정성을 높인다. 콜레스테롤 및 그 파생 형태의 구조는 콜레스테롤의 산화 형태에 따라 생체 내에서 반응하는 효소를 다르게 하고 산화된 콜레스테롤의 구조가 변형 없는 콜레스테롤과 다른 신호를 보냄으로써 막 및 유전자 발현을 조절하는 수용기와의 상호작용에 변화를 일으킨다. 이로써 전달 효율에 영향을 미치며 선행 연구에 따르면 구조를 달리할 때 특정 세포에 대한 선택성( targeting 및 biodistribution)이 달라진다.
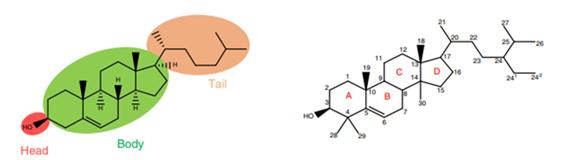
콜레스테롤은 head, body, tail 세 부분으로 나눠 볼 수 있으며, head인 C-3의 OH기는 고리 위쪽으로 tilting되어 리포솜을 형성할 때에 그 극성과 수소결합으로 인해 aqueous phase와 상호작용하는 부분으로 여겨진다. body는 4개의 고리로 구성되며 꼬리는 알킬기 사이드 체인을 갖고 있으며 유동성을 갖게 하는 성질과 관련된다. LNP의 구조 및 세포 내 흡수, 엔도솜 탈출에 콜레스테롤이 기여한다는 것은 이미 밝혀져 있으며 LNP 형태(morphology)는 유전자의 효율적인 패킹과 방출에 있어 중요한 역할을 하며 흥미로운 분야로 연구가 활발하다.
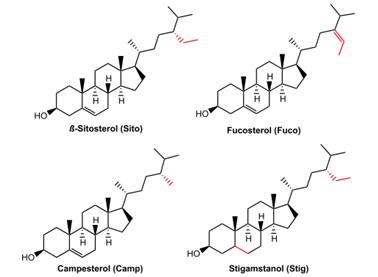
Phytosterol Lnp
최근 코로나 백신 뿐 아니라 약물 전달에 lipid nanoparticle을 통한 방법이 많이 쓰이고 있지만 그 구조에 대한 특징 분석은 아직 명확하지 않다. 또한 ionizable lipid의 변형을 통한 효율 향상에 대한 연구가 활발한 반면 상대적으로 콜레스테롤에 대한 연구는 부족하다. 이에 콜레스테롤을 피토스테롤(β-sitosterol(=Sito), fucosterol (Fuco), campesterol (Camp), stigmastanol (Stig))으로 치환함으로써 LNP의 새로운 구조 및 궁극적으로 LNP 사이즈, mRNA캡슐화, 내부화 및 핵산 전달에 영향을 미치는 영향에 대해 알아보았다. 피테스테롤이란 식물에 존재하는 콜레스테롤과 유사한 형태로 탄소 곁사슬 또는 이중 결합의 유무만 다르며 식물성 스테롤 및 스테놀을 포함한다. 스테놀이란 스테롤 고리 구조에 이중결합이 없는 포화 스테롤을 이른다.
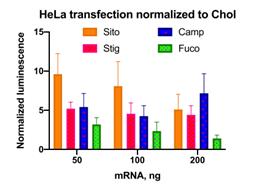
피토스테롤 결합을 통해 mRNA 전달 효율이 콜레스테롤에 비해 향상되는 결과를 확인할 수 있었다. 피토스테롤에서 C-24 알킬 스테롤은 막을 구성하면서 식물 세포의 움직임에 기여하는 유동성을 조절하는 부분에 속한다. 피토스테롤은 콜레스테롤과 비교할 때 C-24에 적어도 한 개 이상의 지방족 탄소 사슬을 가져 지질 패킹을 방해함으로써 막의 유동성을 높인다.
Sito, Stig, Camp, Fuco를 살펴보면 Sito, Stig, Camp는 모두 탄소 1개 또는 2개의 포화 지방족 꼬리를 추가한 형태이고 Fuco는 2개의 탄소를 더하고 이중결합이 있는 구조이다. 또한 Stig의 경우 다른 유사체들과 달리 전체가 포화 형태인 스테놀 중심을 갖는다. 선행 연구에서 콜레스테놀은 콜레스테롤과 비교할 때 융합할 때 더 낮은 엔탈피를 갖는다고 하였다. 또한 피토스테롤의 C-24 알킬기에서 유래한 결정 결함(crystal defects)이 알킬기 사이드 체인의 길이에 비례한다는 연구가 있다. 이에 길이 측면에서 cholesterol <campesterol <β-sitosterol 이고 Stig는 베타 시테롤과 비교할 때 고리 B 부분에서 이중결합이 없는 차이가 있어 body 부분에 있어 더 큰 유동성을 갖는다. 또한 Fucosterol의 경우 꼬리의 에틸그룹으로 인한 불포화로 훨씬 감소된 유동성을 갖는다. 결국 스테롤 중심과 c-24 알킬기 꼬리의 추가가 전달 효율을 증가한다는 것을 알 수 있다. 그 중 β-sitosterol의 경우에 가장 향상된 전달 효율을 보였다.
Morphology (Cryo – TEM)
Phytestrol의 Cryo-TEM 결과를 통해 pytestrol이 LNP의 표면 형태에 영향을 주어 핵산 전달 효율을 높이는 결과를 확인할 수 있었다.
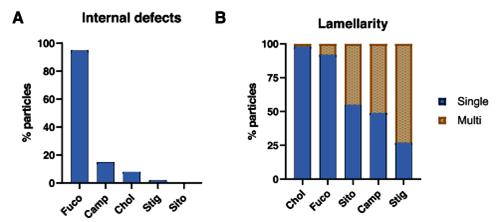
관찰 결과를 종합해 보면 다음의 세 파트로 나눠 볼 수 있고 다중 층상 구조가 세포 내 흡수 향상에 기여한다는 것을 알 수 있었다. -high lamellarity and few internal defects (Sito, Camp, and Stig) -low lamellarity and a high number of defects (Fuco) -low lamellarity and few defects (Chol)
막의 강성(Rigidity)
TMA-DPH는 막의 강성을 확인하는 데에 쓰인데 프로브는 bilayer 바깥쪽에 위치하여 각 lnp 마다 공간적 이방성(anisotropy)을 달리하게 되는데 이로써 상 분리 상태 및 lnp의 구성과 온도에 따른 상태를 알 수 있다. 이방성 정도가 낮을수록 이중층 막이 덜 정열된 구조를 의미한다. 선행 연구에서 더 강한(즉 rigidity가 높은) 다중 겹의 나노입자 일수록 부드러운 경우에 비해 세포 내 장벽을 통과하는 것이 성공적이라고 알려져 있는데 이는 rigidity가 유전자 전달과 관련 있음을 의미한다. 실험은 생리학적으로 관련 있는 온도인 20도에서 80도 사이의 온도에서 프로브의 이방성을 알아보는 방식으로 이루어졌다. 피토스테롤 lnp에 대한 anisotropy 정도의 순서는 Fuco-LNP <Sito-LNP, Stig-LNP < Camp-LNP, Cholesterol 였으며 Fuco-LNP가 가장 정열되지 않은 형태의 막을 가짐을 의미한다. 온도가 증가할수록 브라운 운동이 증가함에 따라 이방성은 감소하고 모두 온도 변화에 따라 비슷한 경향성을 보였다. 생리학적으로 가장 관련있는 온도인 35도에서 Fuco의 경우만을 제외하고 모두 코어와 가장자리의 이방성은 차이가 있었다. 또한 선행 연구를 포함해서 고려할 때 너무 약한 막의 경우 세포 내 흡수되기도 전에 막이 부서져 버리는 반면 과도한 강성 가진 막의 경우 그 과도한 안정성으로 인해 생물학적 환경에서 내부 물질(cargo)을 방출하는 것이 어렵다는 것을 알 수 있었다. 따라서 적절한 막의 강성 범위를 아는 것이 필요하다는 사실을 알 수 있었다.
Rigidity 및 multilamerllarity와 상 전이 온도의 관계
DSC(Differential scanning calorimetry)는 주로 리포솜에서 상 전이(phase transition)를 관찰하기 위한 열적 분석 방법이다. 리포솜은 생리학적 온도 범위에 따라 상 분리 과정을 겪게 되는데 이는 지질 구성을 바꾸고 지질 막의 곡률 변화를 유도할 수 있으며 궁극적으로 핵산 전달에 영향을 미치게 된다. DSC는 위의 콜레스테롤 유사체인 피토스테롤이 막의 구조에 영향을 미치는지 및 상 전이가 lnp의 막 표면에서 일어나는지 bulk부분에서 일어나는지 추론할 수 있게 한다. 따라서 mRNA를 포함하지 않는 LNP의 열적 행동을 mRNA 포함하는 경우와 비교하여 각 경우의 막의 강성을 비교하였다. 모든 피토스테롤 결합 LNP에 대해 눈에 띄는 상 분리 지점이 관찰되었다. Stig의 경우 가장 높은 상 분리 온도인 105°C 였고, Sito의 경우 55°C, Camp는 26°C, Fuco는 42°C, chol의 경우 38°C 였다. 또한 Camp, Chol의 경우 각각 26°C, 95°C에서 glass transition이 관찰되었다. Stig, Fuco의 경우 각각 약 56°C와 60°C 위치에서 추가적인 넓은 상 전이가 있었다. 모든 전이는 흡열 과정으로 이러한 전이는 정열성(ordering)을 감소시키는 과정으로 녹는 과정과 같다. 이는 겔에서 액체로 변화하는 전이이며 리포솜 구조에서 피토스테롤의 비율이 높을수록 막의 정열(ordering)성이 커지고 상 전이를 감소시킨다. 상 전이 피크의 이동은 LNP 형성에 있어 분자 사이의 상호작용의 척도로 이해될 수 있다. 상 전이 온도가 낮을수록 상호작용이 약하다는 것을 의미한다. 각 empty 피토스테롤 lnp에 대한 상 전이 피크 분석은 Camp lnp가 콜레스테롤과 비교할 때 가장 약한 상호작용을 갖고 나머지 lnp들은 상대적으로 더 강한 분자 간 상호작용을 갖는다는 것을 알 수 있다. 이것은 lnp 막의 강성으로 해석될 수 있으므로 Camp가 가장 막의 강성이 약하고 Stig이 가장 강하다. 스티그스테놀과 시토스테롤 모두 55도 부근에서 상 전이를 겪는 것을 통해 적절한 강성 정도를 알 수 있었고 스티그스테놀의 경우 102도에서 또 한번의 상전이를 보였지만 이는 물질 고유의 지질 배치에 따른 것을 보여진다. 또한 강성이 lamellarity와 관련됨을 생각해볼 때 스티그스테놀, 시토스테롤이 높은 온도에서의 피크 위치를 갖는 것을 통해 다중층 입자 비율이 높은 결과의 경향성과도 일치함을 확인할 수 있었다.
약간씩의 화학 구조 차이가 있지만 피토스테롤은 lnp 형성의 지질 패킹에 있어 상당한 영향을 끼치고 multilamellarity의 증가와 다양한 구조가 결합한 형태가 유전자 전달 향상에 기여하는 것을 알 수 있었다. 이는 핵산 전달 효율을 향상시키기 위한 lnp를 설계에 중요한 인사이트를 제공하였으며 추가적으로 다중층 구조와 유전자 전달 영향에 미치는 지질 상에 대한 연구가 더 필요할 것으로 생각된다.
LNP manufaturing
microfluidics
Microfluidics는 유체의 미세한 조절과 변형이 요구되는 실험, 산업에서 쓰이는 학문이다. mRNA-LNP 공정에서 mRNA 용액과 지질이 용해된 에탄올 용액을 혼합하여 mRNA-LNP를 제조할 때, Microfluidics를 이용한 Staggered herringbone micromixer를 사용한다. 이 공정에서 Total Flow Rate(TFR, 유체의 흐름속도), Flow Rate Ratio(FRR, 수용상과 유기상의 흐름비), Lipid 용액의 Composition, Material이 mRNA-LNP 특성을 결정한다.
manufacturing parameter
TFR
수용상과 유기상의 혼합속도 또는 전체 유체의 속도이다. 거시적으로는 생산속도로 볼 수 있다. 보통 5 mL/min ~ 20 mL/min 수준으로 사용된다.
FRR
수용상(mRNA와 buffer)과 유기상(지질)의 흐름비, 유량비 또는 각 수용상과 유기상의 syringe pump의 세기비로도 볼 수 있다.1:1 ~ 5:1 수준으로 사용된다.
각 Parameter가 LNP 크기와 균일성에 미치는 영향
TFR의 영향
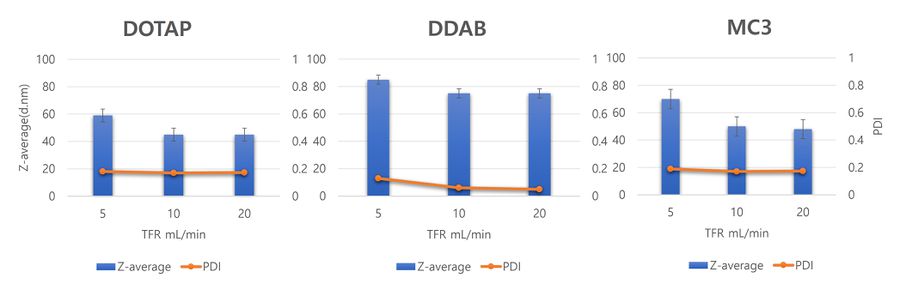
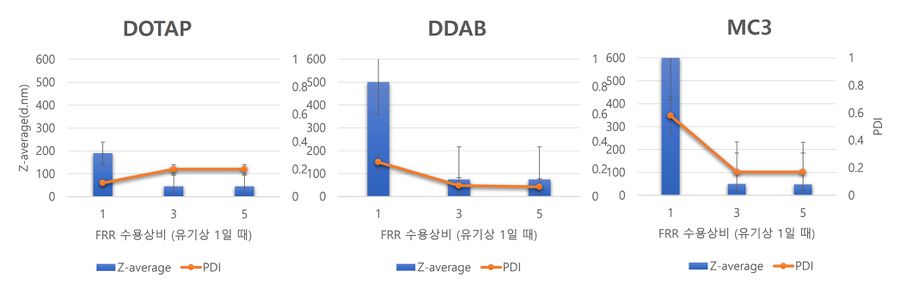
[그림1]TFR 변화에 따른 LNP크기와 PDI 변화
mRNA-LNP 제조 공정시 Total Flow rate가 LNP 크기에 미치는 영향을 알아보기 위하여 TFR을 5~20 mL/min 으로 변화시킨다. 이 때 FRR은 3:1 (수용상:유기상)로 고정하며 Lipid composition은 DSPC:Chol:X:PEG-2000=10:40:48:2 (X는 Cationic 또는 ionisable로 바꾸면서 관찰)로 고정시킨다. 최종적으로 얻은 혼합물의 밀도는 2 mg/mL가 되도록 정제한다. 결과는 다음 그래프와 같았다.
LNP의 크기는 DOTAP을 사용하였을 때 가장 작게 관측되었으며 MC3, DDAB 순으로 그 크기가 커짐을 알 수 있다. 또한 TFR이 5 mL/min 일 때 LNP의 크기가 커졌으며, TFR이 10 mL/min 일 때와 20 mL/min 일 때 크기는 거의 비슷하게 관측되었다. PDI값은 Lipid마다 달랐지만 모든 TFR에서 변화가 없었고 모두 0.2 이하로 안정적인 것을 관측할 수 있었다.
결론적으로 LNP는 빠른 TFR에서 작은 크기로 형성되며 TFR은 균질성에 미치는 영향이 미미하다고 사료된다.[3]
FRR의 영향
[그림2] FRR 변화에 따른 LNP크기와 PDI 변화
작은 크기의 mRNA-LNP가 세포질로 침투해야 하는 mRNA백신에 유리하다고 판단되어 TFR은 20 mL/min 으로 고정하고 Lipid composition은 DSPC:Chol:X:PEG-2000=10:40:48:2 (X는 Cationic 또는 ion-isable로 바꾸면서 관찰)로 고정시킨다. FRR은 (➀1:1, ➁3:1, ➂5:1, 수용상:유기상) 세 경우를 관측하여 LNP의 크기와 PDI값을 측정하였다.
FRR이 1:1 일 때 LNP의 크기가 다른 FRR의 비율에 비해 매우 크게 나타난 것을 관측할 수 있었으며 PDI값 역시 MC3와 DDAP Lipid에서 0.2를 초과하며 매우 불안정한 모습을 관찰할 수 있었다. FRR이 3:1인 경우와 5:1인 경우 LNP의 크기와 PDI 값의 변화가 미미하였음을 알 수 있었으며 mRNA-LNP 백신 제조시 FRR의 비율이 1:1 인 경우는 소거하며 3:1 ~ 5:1 이 가장 적합함을 시사하였다.
Lipid composition의 영향
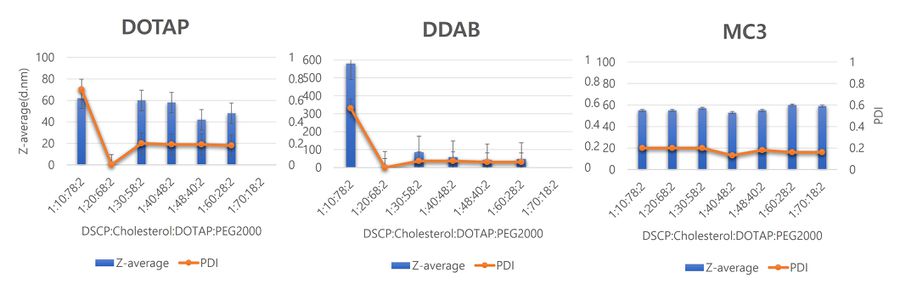
[그림3]Lipid composition의 영향에 따른 LNP크기와 PDI변화
위 두 실험에서 얻은 결론으로 TFR은 20 mL/min으로 FRR은 3:1로 고정하며 Lipid의 비율을 변화시키며 LNP의 크기와 PDI 값을 측정한다. Lipid composition의 변화는 Structural Lipid인 DSCP와 PEG-2000은 100중 10과 2인 상태로 고정하며 choles-terol과 ionisable lipid 또는 cationic lipid 조성을 변경하며 LNP의 크기와 PDI를 관측한다. DSCP:Cholesterol:X:PEG2000=(10:10:78:2 ~ 10:70:18:2) DOTAP의 경우 LNP크기의 변화는 cho-lesterol의 비율이 증가할수록 그 크기가 감소하였으며 PDI값이 작아지는 것으로 관측된다. Cholesterol의 함량이 증가할수록 제조공정에서는 유리할 것으로 판단된다. 그러나 MC3의 경우 Cholesterol 함량의 변화에도 LNP의 크기, PDI 값의 변화가 미미하게 관측된다. DDAB같은 경우 낮은 Cholesterol 함량에는 커다란 크기의 LNP, 높은 PDI값이 관측되면서 매우 불안정한 모습을 보였으며 cholesterol 함량이 100중 30 이후에는 함량이 증가할수록 LNP 크기는 작아졌으며 PDI값은 대개 비슷한 값을 가지는 것으로 관측되었다.
Parmater 선택
mRNA-LNP를 이용한 백신은 세포질 내로 침투하여 엔도솜 탈출과정을 거쳐 단백질 합성을 하는 것이 최종 목적이다. 이에 타겟 세포질 침투에 용이하도록 작은 크기의 LNP를 채택해야 한다. 또한 공정과정에서 낮은 PDI값을 갖도록 설계해야 할 것이다. 이와 같은 이유로 herringbone micromixer를 이용한 mRNA-LNP 공정에서는 높은 FTR값을 가져야 하며 FRR값은 수용상의 흐름속도가 더 빠르도록 설계해야하며, 콜레스테롤의 함량을 높이하되 타겟 조직과의 상호작용을 고려하여 Ionisable lipid 또는 Cationic lipid의 비율을 조절해야 한다.
결과 및 평가
완료 작품의 소개
조사 내용을 정리하여 리뷰 논문의 형식으로 작성하였다.
포스터
완료작품의 평가
이번 논문 리뷰를 통해 지질 나노입자의 성능 향상을 위한 다양한 방향의 연구에 대하여 살펴보았다. 지질 나노입자는 핵산 물질 약물을 안전하게 표적 세포까지 효과적으로 전달할 수 있어 최근 각광받고 있는 전달체 기술 중 하나이다. 현재 전 세계적으로 접종되고 있는 covid-19 백신도 이러한 지질 나노입자 기술을 활용한 백신이며 바이러스 백신뿐만 아니라 암이나 난치병 치료 같은 유전자 치료를 위한 RNA 약물을 효율적으로 전달할 수 있는 기술이기에 미래 잠재력이 매우 우수한 기술이다. 코로나19 팬데믹 선언 이후 2년이 다 되어가지만 언제 지금의 상황이 종식될지, 또는 유사한 상황이 다시 올지 모르는 상태이고, 이 같은 바이러스와 관련된 다양한 시도들이 행해지고 있는 가운데 나노입자 전달체의 중요성이 날로 부각되고 있다. 감염병 위기에 신속하고 맞춤형으로 대응하기 위한 백신 플랫폼 기술 개발 필요성이 강조되고 있고, 전 세계적인 팬데믹 상황에서 이와 관련된 국제적 노력과 경쟁이 그 어느 시기보다 치열하였기에 시장에도 많은 변화가 예상되며, 특히 각국의 정책적 지원과 투자가 지속될 것으로 예상된다.이러한 추세에 부응하여 리뷰논문을 통해 나노전달체를 구성하는 요소들의 최신 기술 동향과 관련 연구들을 조사하였으며, 이로인해 효과적이고 특성화된 나노전달체 제조공정의 발판을 마련하였다고 생각된다
향후계획
향후 좀 더 최신의 지질 합성에 대한 조사를 좀 더 하여야 하며, 추후 이루어질 엔도솜 탈출 메커니즘에 대한 분석이 정확하게 이루어지는지에 대하여 지속하여 정보를 탐색할 것이다
Reference
- Varkouhi AK, Scholte M, Storm G, Haisma HJ. Endosomal escape pathways for delivery of biologicals. J Control Release. 2011 May 10;151(3):220-8. doi: 10.1016/j.jconrel.2010.11.004. Epub 2010 Nov 13. PMID: 21078351.
- Ma D. Enhancing endosomal escape for nanoparticle mediated siRNA delivery. Na-noscale. 2014 Jun 21;6(12):6415-25. doi: 10.1039/c4nr00018h. PMID: 24837409.
- Martens, T. F., Remaut, K., Demeester, J., De Smedt, S., & Braeckmans, K. (2014). In-tracellular delivery of nanomaterials: How to catch endosomal escape in the act. Nano To-day, 9(3), 344–364. doi:10.1016/j.nantod.2014.04.011
- Samuel A. Smith, Laura I. Selby, Angus P. R. Johnston, and Georgina K. Such. Biocon-jugate Chemistry 2019 30 (2), 263-272 DOI: 10.1021/acs.bioconjchem.8b00732
- Cupic KI, Rennick JJ, Johnston AP, Such GK. Controlling endosomal escape using na-noparticle composition: current progress and future perspectives. Nanomedicine (Lond). 2019 Jan;14(2):215-223. doi: 10.2217/nnm-2018-0326. Epub 2018 Dec 4. PMID: 30511881.
- Maier MA, et al. Biodegradable lipids ena-bling rapidly eliminated lipid nanoparticles for systemic delivery of RNAi therapeutics. Mol Ther. 2013 Aug;21(8):1570-8. doi: 10.1038/mt.2013.124. Epub 2013 Jun 25. PMID: 23799535; PMCID: PMC3734658.
- Sabnis, S., Kumarasinghe, E. S., Salerno, T., Mihai, C., Ketova, T., Senn, J. J., … Benenato, K. E. (2018). A Novel Amino Li-pid Series for mRNA Delivery: Improved En-dosomal Escape and Sustained Pharmacology and Safety in Non-human Primates. Molecu-lar Therapy, 26(6), 1509–1519. doi:10.1016/j.ymthe.2018.03.010
- Hassett, K. J., Benenato, K. E., Jacquinet, E., Lee, A., Woods, A., Yuzhakov, O., … Brito, L. A. (2019). Optimization of Lipid Nanoparticles for Intramuscular Administra-tion of mRNA Vaccines. Molecular Therapy - Nucleic Acids, 15, 1–11. doi:10.1016/j.omtn.2019.01.013
- Akinc, A., Zumbuehl, A., Goldberg, M. et al. A combinatorial library of lipid-like mate-rials for delivery of RNAi therapeutics. Nat Biotechnol 26, 561–569 (2008). doi:10.1038/nbt1402
- Love, K. T., Mahon, K. P., Levins, C. G., Whitehead, K. A., Querbes, W., Dorkin, J. R., … Anderson, D. G. (2010). Lipid-like materi-als for low-dose, in vivo gene silencing. Pro-ceedings of the National Academy of Scienc-es, 107(5), 1864–1869. doi:10.1073/pnas.0910603106
- Whitehead, K., Dorkin, J., Vegas, A. et al. Degradable lipid nanoparticles with predicta-ble in vivo siRNA delivery activity. Nat Commun 5, 4277 (2014). doi:10.1038/ncomms5277
- [Analysis of pre-existing IgG and IgM an-tibodies against polyethylene glycol (PEG) in the general population Qi Yang, Samuel K Lai,
- [Architectural Modification of Conformal PEG-Bottlebrush Coating Minimizes Anti-PEG Antigenecity While Preserving Stealth Properties Daniel Y. Joh,
- Manju Kanamala, Brian D. Palmer, Wil-liam R. Wilson. Et al. Characterization of a smart pH-cleavable PEG polymer towards the development of dual pH-sensitive liposomes. International Journal of Pharmaceutics. 2018 july 2; S0378-5173(18)30477-0.doi:10.1016/j.ijpharm.2018.07.009
- Hashiba, Kazuki; Sato, Yusuke; Harashi-ma, Hi-deyosh. pH-labile PEGylation of siR-NA-loaded lipid nanoparticle improves active targeting and gene si-lencing activity in hepatocytes. Faculty of Pharma-ceutical Sci-ences. 2017 Sep 28; 262, 239-246. doi: 10.1016/j.jconrel.2017.07.046
- Sam Chen., Yuen Yi Tam., Paulo J.C. Lin. Et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of controlled release. 2016 may 25; 235(2016)236-244.doi:10.1016/j.jconrel.2016.05.059
- Takuya Suzuki., Yuta Suzuki., Taro Hi-hara. Et al. PEG shedding-rate-dependent blood clearance of PEGylated lipid nanopar-ticles in mice: Faster PEG shedding attenuates anti-PEG IgM production. Inter-national Jour-nal of Pharmaceutics. 2020Aug17;588(2020)1197992.
- Patel, S., Ashwanikumar, N., Robinson, E.. Naturally-occurring cholesterol analogues in lipid nanoparticles induce polymorphic shape and enhance intracellular delivery of mRNA. Nature Communications, 11(1). doi:10.1038/s41467-020-14527-2
- Eygeris, Y., Patel. Deconvoluting Lipid Nanoparticle Structure for Messenger RNA Delivery. Nano Letters, 20(6), 4543–4549. doi:10.1021/acs.nanolett.0c01386
- Carla B. Roces et al. Manufacturing Con-siderations for the Developmentof Lipid Na-noparticles Using Microfluidics. MDPI (2020). Doi:10.3390/pharmaceutics12111095