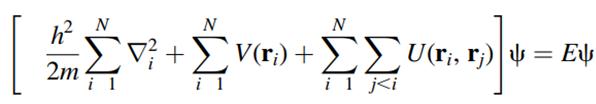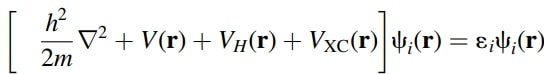CCMD
프로젝트 개요
기술개발 과제
국문 : 수소 생산을 위한 암모니아 분해 촉매 성능 개선
영문 : Improvement of Ammonia Decomposition Catalysts for Hydrogen Production
과제 팀명
CCMD
지도교수
유종석 교수님
개발기간
2024년 9월 ~ 2024년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20193400** 류*철(팀장)
서울시립대학교 화학공학과 20193400** 김*현
서울시립대학교 화학공학과 20193400** 김*
서울시립대학교 화학공학과 20193400** 노*권
서울시립대학교 화학공학과 20193400** 윤*현
서울시립대학교 화학공학과 20218900** 임*연
서론
개발 과제의 개요
개발 과제 요약
◇ 본 연구는 지속 가능한 발전을 목표로, 온실가스를 배출하지 않는 청정 에너지원인 수소 생산을 위한 암모니아 분해 반응 메커니즘을 분석하고, 이를 통해 루테늄(Ru) 금속 촉매의 성능을 향상시키기 위한 전략을 제시하는 것을 목표로 한다.
◇ 리튬 이온 배터리에 사용되는 NCA(Nickel-Cobalt-Aluminum, NixCoyAl1-x-yO2) 양극재를 Ru 촉매와 조합함으로써 암모니아 분해 촉매의 성능 변화와 그 원인에 대해 밀도범함수이론(Density Functional Theory, DFT) 계산을 기반으로 분석한다. 계산화학을 활용하여 도출한 Free energy diagram을 바탕으로 암모니아 분해 반응의 반응 에너지와 활성화 에너지를 낮출 수 있는 메커니즘을 규명하고자 한다.
◇ 이를 통해 Ru 촉매의 성능 및 한계점을 명확히 파악하여 암모니아 분해 반응에서 수소 생산 효율을 극대화할 수 있는 새로운 촉매를 설계하는 데 중점을 둔다. 이 과정에서 촉매의 구조적 안정성, 활성점, Li 이온의 영향 등을 분석하여 기존 촉매의 성능을 개선할 수 있는 방안을 제시한다.
◇ 최종적으로, 본 연구는 저비용, 고효율의 촉매를 개발함으로써 암모니아 분해를 통한 수소 생산 기술의 상업적 활용 가능성을 높이고, 장기적으로는 온실가스 배출 감소 및 환경 보호에 기여할 것으로 기대된다.
개발 과제의 배경
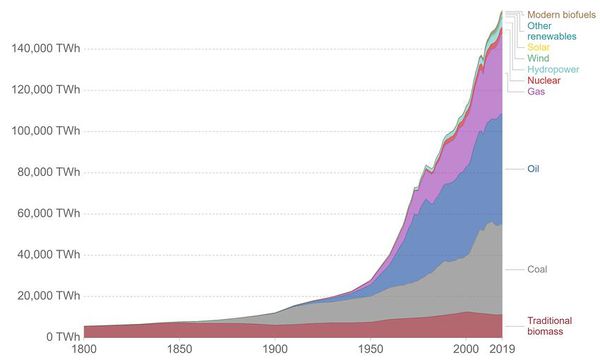
◇ 19세기 이후 전 세계적으로 에너지 소비량이 가파르게 증가하면서 석유, 석탄, 천연가스와 같은 화석연료에 대한 의존도가 높아지고 있다 (Figure 1). 화석연료는 연소 과정에서 온실가스를 배출하여 지구온난화의 주요 원인 중 하나로 지목되며, 이러한 문제를 해결하기 위해 화석연료를 대체할 수 있는 지속 가능한 에너지원에 대한 연구가 활발히 진행되고 있다.
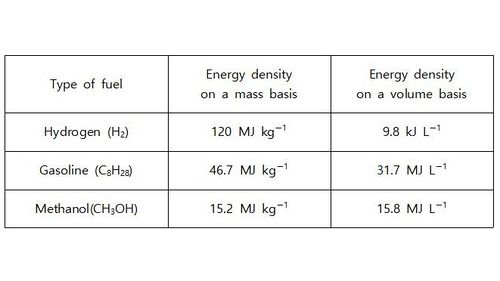
◇ 수소는 연소 시 물만 생성하고 온실가스를 배출하지 않기 때문에 탄소 중립을 실현할 수 있는 청정 에너지원으로 주목받고 있다. 그리고 다른 탄화수소 연료에 비해 질량 대비 에너지 밀도가 높아 단위 질량당 많은 양의 에너지를 저장할 수 있다 (Table 1). 하지만 부피 대비 에너지 밀도가 낮고 폭발의 위험성으로 인해 장거리 운송 및 저장이 어렵다는 한계가 있어 암모니아 형태로 저장하는 대안이 떠오르고 있다.
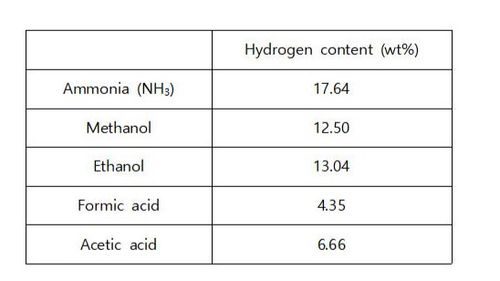
◇ 암모니아는 상대적으로 쉽게 액화되기 때문에 저장 및 운송이 용이하며, 기존에 상용화된 Haber-Bosch 공정을 통해 대량생산이 가능해 자원 확보에 유리하다. 암모니아는 가연성이 낮아 폭발 위험이 적으며, 유통 비용 또한 상대적으로 저렴하다는 장점이 있다. 그리고 메탄올이나 에탄올보다 질량 대비 수소 함량이 높으면서도 탄소를 포함하지 않아 온실가스를 배출하지 않는 효율적인 수소 운반체로 주목받고 있다 (Table 2). 하지만 기존의 암모니아 분해 공정은 고온·고압의 조건에서 진행되어 비용 및 안전성 측면에서 단점이 존재하며, 이를 개선하기 위해 촉매를 활용해 공정 온도를 낮추고 반응속도를 높이는 연구가 필요하다. 따라서 본 연구에서는 암모니아 분해 반응 메커니즘을 심층적으로 분석하고, 기존에 사용해오던 Ru 촉매의 성능을 개선할 수 있는 전략을 제시하고자 한다.
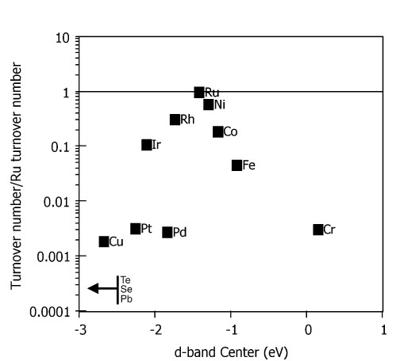
◇ 선행 연구에서 Ru 금속이 암모니아 분해에 가장 뛰어난 성능을 보인다 (Figure 2). 하지만, Ru 금속은 성능은 우수하나 비용이 높다는 단점이 있다. 이에 따라 상대적으로 낮은 성능을 보이지만 가격이 저렴한 니켈(Ni)이나 철(Fe) 금속 촉매도 많이 사용되고 있다. 하지만 본 연구에서는 최대한 촉매의 성능을 개선하는 것을 목표로 하여 Ru 촉매에 대해 분석을 진행하였다.
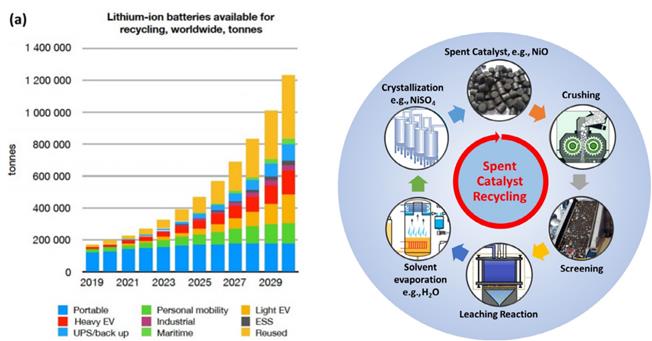
◇ 한편, 배터리가 활용되는 분야가 증가함에 따라 폐배터리의 양도 계속해서 증가하고 있다 (Figure 3). 이러한 폐배터리에는 Ni, Co와 같은 유용한 금속뿐만 아니라 유독성 물질도 포함되어 있기 때문에 자원 낭비와 환경오염을 줄이기 위해서 폐배터리의 재활용이 중요해졌다. 본 연구에서는 현재 다양한 분야에서 많이 활용되고 있는 리튬 이온 배터리의 양극재인 NCA를 재활용하여 암모니아 분해 반응을 촉진하고자 한다. NCA 양극재는 니켈(Ni), 코발트(Co), 알루미늄(Al) 산화물이 이루고 있는 층상 구조 사이사이를 리튬(Li) 이온이 이동하면서 충방전이 일어나는 방식이며, 상대적으로 자유롭게 이동 가능한 Li 이온이 촉매 성능에 중요한 영향을 미칠 것으로 판단된다.
◇ 궁극적으로, 폐배터리 소재와 기존의 촉매를 결합하여 암모니아 분해 반응에 사용되는 촉매의 성능을 개선함으로써 수소 연료 활용의 상용화를 가속화할 수 있을 뿐만 아니라, 배터리에 사용된 소재를 재활용함으로써 환경 보호에도 기여할 수 있을 것이다.
개발 과제의 목표 및 내용
◇ DFT 계산을 기반으로 순수 Ru 촉매의 terrace 및 step 표면에서 암모니아 분해 메커니즘을 분석하고, free energy diagram 분석을 통해 표면 구조에 따른 촉매 활성을 비교한다.
◇ NCA 양극재와 Ru 촉매를 동시에 사용했을 때의 암모니아 분해 촉매 성능을 예측한다. Li 이온이 촉매의 성능을 변화시켰을 것이라는 가정을 기반으로, 계산화학을 통해 흡착물의 위치를 변화시켜가며 Li 이온 혹은 Li 화합물이 첨가된 Ru 촉매의 terrace 및 step 표면에서의 암모니아 분해 메커니즘을 분석한다. 또한, Free energy diagram을 도출하여 최적의 반응 경로를 파악한다.
◇ 최종적으로, Li 이온 혹은 Li 화합물이 첨가된 Ru 촉매 표면의 구조를 결정하여 암모니아 분해 메커니즘을 분석한다. 이를 통해 NCA와 Ru을 혼합한 촉매의 성능 변화를 예측하고 촉매 성능 개선 전략을 설계할 예정이다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
◇ 암모니아는 부피당 수소 밀도가 높고 상대적으로 쉬운 조건에서 액화되기 때문에, 적은 비용으로 압축하여 수소 운반체로 널리 사용되고 있다. Asbjorn et al.은 수소 저장을 위한 암모니아의 활용에 대한 전반적인 내용을 정리하여 발표하였다. 수소는 공기 중에서 가연성이 강해 운송 시 폭발 위험이 있지만, 암모니아는 공기 중에서 불이 붙지 않아 상대적으로 안전하게 운송할 수 있다. 저온·저압의 조건에서 액화된 암모니아는 파이프라인, 선박, 기차 등 다양한 운송 수단을 통해 운송되며, 대부분 1bar, -33℃의 단열 탱크에 저장된다[7]. 이러한 특성 덕분에 암모니아는 전 세계 수소 공급망의 중요한 요인으로 자리 잡고 있다.
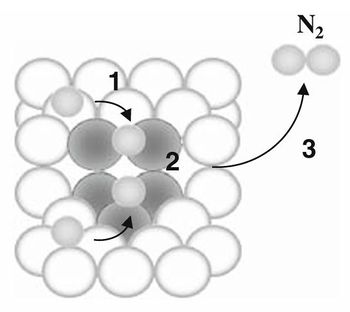
◇ Ganely et al.은 암모니아 분해 반응의 촉매 활성이 Ru, Ni, Rh, Co, Ir, Fe, Pt, Cr 순으로 감소한다고 설명하였다[8]. Active B5-type site가 암모니아 분해 반응의 속도 결정 단계(Rate-Determining Step, RDS)로 알려진 N-N association step에 관여할 가능성이 높아 암모니아 분해의 핵심 활성 사이트로 알려져 있다[9]. 선행 연구에 따르면, Ru는 위의 금속 중에서 가장 높은 촉매 활성을 보이지만, 저온에서는 활성이 저하되는 문제가 있다. 특히, 탄소나노튜브(carbon nanotube, CNT)를 지지체로 사용할 경우 Ru 촉매의 전환율이 50% 미만으로 나타나, 촉매 합성, 지지체 및 promoter에 대한 지속적인 연구가 필요하다. 예를 들어, Ru 금속에 MgO나 CNT를 지지체로 사용하고 KNO3와 같은 알칼리성 promoter를 추가하면, 기존의 Ru 금속과 달리 500℃ 미만에서 활성이 좋아지는 경향이 나타났다[8].
◇ García-García, F. R. et al.은 CO 흡착 방법을 통해 암모니아 분해 반응에 사용되는 Ru 촉매의 B5-type site가 중요한 역할을 한다는 것을 밝혔다[10]. B5-type site는 암모니아 분해 반응에서 N2 분자를 형성하는 RDS를 촉진하는 활성 site이다. Figure 5와 같이, 해당 step은 암모니아 분해 반응의 핵심 단계이며, 촉매의 성능을 결정짓는다. 또한, Figure 6에서 Ru 촉매의 다양한 사이트에서 CO 흡착 에너지를 비교한 결과, 촉매 사이트에 따라 유의미한 차이가 나타났으며, 이는 촉매 활성도에 영향을 미친다. 특히, 환원 온도가 증가할수록 CO 흡착 에너지가 커지고 균일해지는 경향을 보이는데, 이는 B5-type site의 배위수가 조건에 따라 달라짐을 의미한다. 배위수가 증가하면 촉매 반응이 더 유연해져 반응성을 높일 수 있다. 또한, 실험 결과 암모니아 분해 과정에서 Ru 촉매 표면은 새로운 구조를 형성하거나 변형되지 않고 안정적으로 유지되었으며, 이는 B5-type site가 고온 환원 과정에서 형성되어 암모니아 분해 반응을 촉진한다는 것을 의미한다. 최적의 촉매 성능을 위해선 Ru 입자의 크기가 중요하며, 보통 직경 2-3 nm 정도 크기의 입자가 가장 많은 B5-type site를 형성해 암모니아 분해 반응에서 뛰어난 활성을 나타낸다.
◇ Zheng et al.은 Ru 촉매에 Li 원자를 첨가해 암모니아 합성 성능을 향상시켰다. Li 원자는 다른 무거운 알칼리 도핑 물질에 비해 전자를 공급하는 능력은 떨어지지만, Ru 금속과 결합했을 때 뛰어난 촉매 성능을 보였다. Li 원자를 첨가하면 촉매 표면에서 N2 흡착이 원활해지고, Ru의 4d 오비탈이 흡착된 N2 분자의 anti-bonding 오비탈에 전자 밀도를 더 많이 제공해 N-N 결합 해리를 촉진한다. 일반적으로 promoter의 성능은 전기음성도에 의해 결정되며, 전기음성도가 높을수록 성능이 떨어지는 경향을 보인다. 하지만 Li 원자는 이러한 경향성을 따르지 않으며, Ru 원자와 흡착물의 결합을 방해하지 않는 것으로 밝혀졌다[11]. 또한, 암모니아 합성 반응에서 우수한 성능을 보이는 촉매는 N-N 결합 해리에도 효과적인 경우가 많으므로 암모니아 분해 반응을 통해 수소를 얻고자 하는 본 연구에서도 Li 원자를 첨가한 Ru 촉매가 뛰어난 성능을 보일 것을 기대된다.
특허조사
◇ PCT/KR2021/001089 (AMMONIA CRACKING CATALYST, AND METHOD OF CRACKING AMMONIA AND GENERATING HYDROGEN BY USING SAME)
해당 특허는 암모니아 분해 촉매 및 암모니아 분해를 통해 수소를 생산하는 방법에 관한 것으로, 비교적 저온 조건에서도 효과적으로 암모니아 분해 반응을 촉진하는 촉매 기술을 다루고 있다. 금속 산화물 중 산화란타넘(La2O3)과 산화세륨(CeO2)을 촉매 지지체로 사용할 때 저온에서의 암모니아 분해 성능이 향상되는 점에 착안하여, 란타넘 세륨 산화물(LaxCe1-xOy)을 지지체로 사용한 Ru 촉매(Ru/LaxCe1-xOy)를 제작한다. 이 촉매의 특징은 x가 0.25~0.45의 값을 가지고, y가 1.78~1.88의 값을 갖는 것이다. 또한, 조촉매를 첨가하여 암모니아 분해 반응 속도를 향상시킬 수 있는데, 조촉매 성분으로는 마그네슘(Mg), 이트륨(Y), 바륨(Ba), 란타넘(La), 세륨(Ce) 등의 알칼리 금속, 알칼리 토금속 및 란타넘족을 포함한다. 실험 결과, Ru 촉매를 사용할 때, 알루미나(Al2O3), 지르코니아(ZrO2), 산화란타넘(La2O3) 등을 지지체로 사용하는 경우보다 LaCeOx를 지지체로 사용하는 경우에 암모니아 분해 성능이 더 우수하며, 특히 Ru/La0.33Ce0.67O1.84를 사용할 경우 450℃ 이하의 저온 조건에서도 높은 암모니아 전환율을 보였다. 그리고 La과 Ce의 몰비에 따른 암모니아 전환율 실험에서도 La과 Ce의 몰비가 1:2일 때, 즉 Ru/La0.33Ce0.67O1.84 촉매가 가장 최적의 성능을 보였다.
◇ 10-2019-0138583 (루테늄계 암모니아 분해 촉매 및 그 제조방법)
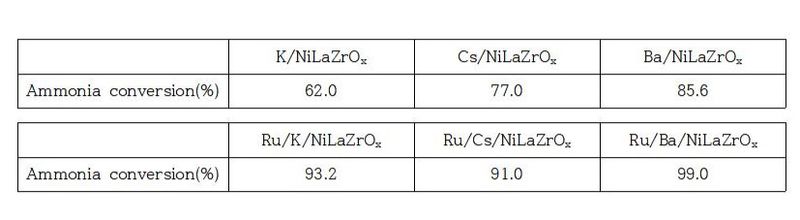
해당 특허는 Ru을 포함하는 암모니아 분해 촉매 및 그 제조방법에 대한 내용이다. Ru; 촉매 금속 복합 지지체; 및 알칼리 금속, 알칼리 토금속 및 그 혼합물로 이루어진 군에서 선택되는 금속을 포함하는 적절한 암모니아 분해 촉매를 찾는다. 또한, 분말, pellet, bead, 구조체 등의 다양한 형태의 금속 산화물과 알칼리 금속, 알칼리 토금속 및 지지체가 혼합된 구조로 되어 있으며, 이를 통해 암모니아 전환율을 향상시킬 수 있었다. 특히, 해당 구조에 루테늄을 함침 시키거나 적층하여 암모니아 분해 촉매의 성능을 향상시키는 방법을 제시하였다. 암모니아 분해 촉매는 Ru/M1M2Ox로 표시되고, M1은 알칼리 금속 및 알칼리 토금속이고, M2는 란타넘족 금속 또는 전이금속이다. 이들을 포함하는 합금이 될 수 있는 경우들에 대하여 특허 출원이 되어 있지만, 실험에서는 Ru/M1NiLaZrOx만을 이용하였다. M1은 위와 같이 알칼리 금속 또는 알칼리 토금속을 사용한다. 각각 M1이 칼륨(K), 세슘(Cs), 바륨(Ba)인 경우들에 대해 실험을 통하여 500℃에서 암모니아 전환율을 비교하였고, 비교를 위해 M1NiLaZrOx를 이용한 실험도 진행하였다 (Table 3). 그 결과, Ru을 첨가한 촉매의 암모니아 전환율이 더 뛰어났으며, Ru/M1NiLaZrOx 촉매끼리 비교하였을 때는 Ba, K, Cs 순으로 암모니아 전환율이 뛰어났다.
특허전략
◇ 본 연구는 촉매 반응을 통해 암모니아를 질소와 수소로 분해하는 촉매에 관한 것으로, 비교적 값비싼 Ru 금속이나 기타 여러 금속을 이용한 지금까지의 기술과는 달리, 폐배터리 소재를 재활용하여 제작한 합성 촉매의 성능을 확인한다. 이를 통해 상대적으로 저비용으로 고농도의 수소를 대량생산하는 촉매를 개발하는 것을 목표로 한다.
◇ 선행 연구를 통해 Ru 금속을 촉매로 사용했을 때 암모니아 분해 반응의 전환율이 뛰어나다는 것은 이미 밝혀진 바이며, Ru과 여러 금속의 혼합물을 이용한 암모니아 분해 실험도 이미 다수 진행되어 이를 이용한 특허가 많이 출원되어 있는 상황이다. 하지만 대다수의 연구가 단순히 활성 금속으로 어떤 물질을 침착시키는지에 초점을 두는데 비해, 본 연구에서는 계산화학을 활용해 우선 Ru 촉매의 표면 구조에 따른 암모니아 분해 메커니즘을 분석하여 촉매 활성을 비교한다. 또한, 이를 통해 비교적 연구가 이루어지지 않은 폐배터리 소재를 재활용한 합성 촉매의 성능을 예측 및 비교하고자 한다.
개발과제의 기대효과
기술적 기대효과
◇ 암모니아는 고중량 비율의 수소(17.8 wt%)를 포함하고 있어 수소 저장 및 운송에 적합한 물질이다. 암모니아 분해 반응에서 Ru 기반 촉매는 높은 효율과 안정성을 제공하는 장점을 가지고 있어 촉매로 주로 사용된다[12]. 또한, 다른 촉매에 비해 낮은 활성화 에너지를 가지고 있어 더 빠른 반응속도를 유도하고, 500°C 이하의 온도와 상압에서 평형 전환에 도달할 수 있다[13]. 이러한 Ru 촉매를 개선하면 낮은 온도에서도 높은 수소 전환율을 달성할 수 있을 것이다. 이는 수소 생산의 경제성을 높이고, 대규모 수소 생산 및 사용을 촉진할 것으로 기대된다.
◇ Ru 촉매는 반응 선택성이 높아, 암모니아가 다른 부산물로 전환되는 부반응을 방지하여 순도 높은 질소와 수소를 생성할 수 있다. 이로 인해 후처리 공정의 복잡성을 줄이고 공정의 효율성을 높일 수 있다[3]. Ru 촉매의 성능 개선은 공정의 복잡성을 줄이고, 산업 전반의 생산성을 높이는 데 기여할 것이다. 또한, 이를 통해 생산된 수소는 다양한 산업 분야에서 활용되어 경제적 파급효과가 클 것이다.
◇ 암모니아 분해 메커니즘은 일반적으로 암모니아의 흡착, N-H 결합 분해, 생성된 질소와 수소의 탈착으로 이루어진다. Ru 촉매는 이러한 메커니즘에서 중요한 역할을 하며, 결합 강도를 조절하여 반응성을 극대화한다[3]. Ru 촉매의 개선을 통해 암모니아 분해 반응에서 RDS를 용이하게 만들 수 있고, 이는 반응속도를 크게 증가시킬 것이다. 이로 인해 수소 생산의 효율성이 향상될 것으로 기대된다.
경제적, 사회적 기대 및 파급효과
◇ 암모니아는 고온이나 높은 압력에서도 안전하게 취급될 수 있는 장점을 가지고 있다. 따라서 다른 수소 운반법에 비해 안전한 수소 운반체로 활용될 수 있으며[14], 이는 대규모 수소 경제 구축에 기여할 수 있다. 안전한 수소 운반체의 개발은 수소 충전소 및 연료 전지와 같은 관련 기술의 성장도 이끌어낼 수 있다.
◇ 암모니아를 이용한 수소 생산은 에너지 자립도를 높이는 데 중요한 역할을 할 수 있다. 현재의 에너지 공급망은 석유 및 천연가스와 같은 화석연료에 크게 의존하고 있지만, 암모니아를 통한 수소 생산 기술은 화석연료의 의존도를 줄이고 에너지 공급망을 다각화할 수 있다. 그뿐만 아니라, 암모니아는 비료, 냉매제 등 현대 산업에 필수적인 화학물질로, 이를 생산하고 공급하는 인프라가 잘 갖추어져 있다[14]. 따라서 큰 추가 투자 없이 빠르게 기술을 도입할 수 있다.
◇ 암모니아 분해를 통해 수소를 생산하면 이산화탄소 배출이 없기 때문에 탄소 배출 저감을 달성하는 데 중요한 기술이다. 현재 많은 국가가 기후 변화 대응을 위해 탄소 배출을 줄이는 정책을 추진하고 있으며, 이러한 촉매 기술을 활용한다면 환경 규제를 준수하면서도 경제적 이익을 극대화할 수 있을 것이다[15]. 이러한 친환경 기술의 도입은 기업의 지속 가능성을 높이고, 사회적 책임을 다하는 데 기여할 수 있다.
◇ 암모니아 분해 기술이 상용화된다면, 수소 생산과 관련된 수소 경제가 활성화되어 관련 인프라 구축, 생산 공정 개선, 연구개발 등 다양한 분야에서 일자리가 창출될 수 있다. 이러한 기술 혁신은 경제 성장을 이끌 것이며, 장기적인 산업 발전과 고용 창출에 기여할 것이다. 궁극적으로 수소 경제의 활성화는 청정에너지 사회로의 전환을 가속화할 것이다.
기술개발 일정 및 추진체계
개발 일정
구성원 및 추진체계
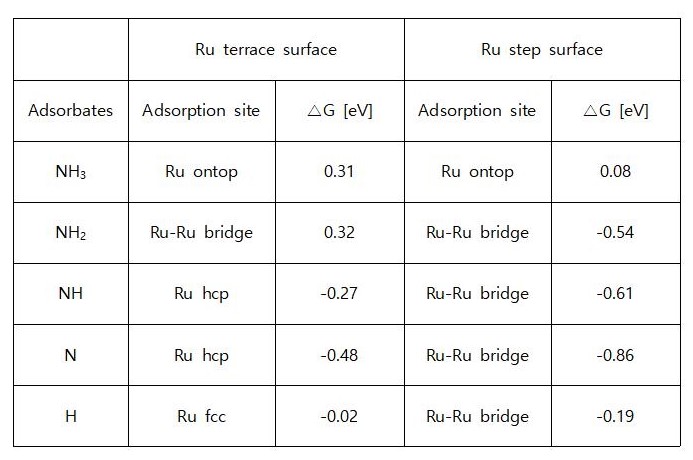
◇ 김우현, 김훈, 윤동현: Ru 촉매를 활용한 암모니아 분해 반응에 관한 선행 연구를 바탕으로 DFT 계산을 통해 순수 Ru 촉매의 표면 모델을 설계하고 그 특성을 파악한다. 각 흡착물의 흡착 에너지 및 활성화 에너지를 계산하여 순수 Ru 촉매 표면에서의 암모니아 분해 메커니즘 및 활성 사이트를 분석한다.
◇ 노희권, 류영철, 임서연: Ru 촉매 구조에 관한 선행 연구를 바탕으로 Ru 촉매 표면 모델을 설계하고, DFT 계산을 통해 Li 원자의 가장 안정한 위치 파악한다. Li 원자가 첨가된 Ru 촉매 표면의 특성을 파악하고, 해당 표면에서의 암모니아 분해 메커니즘 및 활성 사이트를 분석하여 Li 원자가 반응에 미치는 영향을 평가한다.
◇ 김우현, 김훈, 노희권, 류영철, 윤동현, 임서연: 순수 Ru 촉매 표면과 Li 원자가 첨가된 Ru 촉매 표면에서 구한 흡착 에너지 및 반응 메커니즘을 바탕으로 암모니아 분해 반응 free energy diagram을 도출하고 비교 분석한다. 이를 통해 표면별 특성 및 장단점을 파악하여 최적의 촉매 모델을 설계하고, 설계한 촉매의 성능을 예측한다.
설계
개념설계안
◇ DFT는 양자역학적 계산 방법으로, 전자의 개별적인 파동함수 대신 전자 밀도를 사용해 계산을 단순화하는 방법이다. 슈뢰딩거 방정식 (Figure 7a)은 전자 간 상호작용을 전자 간의 interaction을 통해 파동함수를 구하지만, 전자 개수가 증가하면 계산이 매우 복잡해져 원자의 전체 전자를 하나의 전자구름으로 가정하여 전자 간 interaction을 고려해 파동함수를 구하게 된다. 이렇게 전자 밀도를 중심으로 계산 비용을 줄이는 방법을 DFT라고 한다. DFT에서는 전자구름을 가정하기 때문에 self-interaction 오류가 발생할 수 있으며, 이를 보정하기 위해 exchange-correlation 함수를 적용한 Kohn-Sham 식 (Figure 7b)이 널리 사용된다.
◇ 본 연구에서는 DFT를 활용해 Ru 촉매에서의 암모니아 분해 메커니즘을 분석하였다. 먼저 Ru 촉매의 표면을 설계하고, 암모니아의 흡착 형태를 결정한 후, N-H 결합의 해리에 따른 step별 반응 중간체의 흡착 에너지를 계산하였다. 이를 통해 각 step에 필요한 반응 에너지 및 반응 전체의 RDS를 분석하고, 최종 생성물인 질소와 수소 기체의 탈착 에너지를 계산해 반응 종료 시점까지 평가하였다. 또한 Li 원자를 첨가해 촉매의 전자 밀도를 조절하고, 이를 통해 암모니아 분해 성능을 향상시킬 수 있는지 검토하였다.
이론적 계산 및 시뮬레이션
◇ 폐 NCA와 Ru을 혼합한 촉매의 성능을 분석하기 위해 선행 연구를 바탕으로 사용 후 NCA 양극재의 구조 변화를 확인하였다. 이를 통해 NCA와 Ru 혼합 시 상호작용을 고려하여 촉매 표면을 설계하고, 설계한 표면에서의 암모니아 분해 메커니즘을 분석해 free energy diagram을 작성하였다. 이후 Ru만으로 구성된 기존의 촉매와 비교하여 최적의 촉매 구조를 선정하였다.
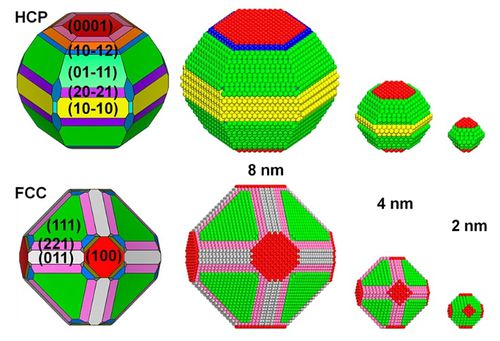
◇ 우선 가장 성능이 뛰어나다고 알려진 Ru 촉매에 대해서 조사하였으며, 선행 연구에서 DFT를 활용하여 설계한 Ru nanoparticle(NP) model은 Figure 8과 같다. Ru 입자는 주로 hcp 구조를 가지며, 그중에서도 (0001), (01-11), (10-10) 표면의 비율이 매우 높았다. 그리고 질소나 수소와 같은 작은 분자들은 (10-10)과 같은 step 표면을 선호하므로 입자의 크기가 너무 작아선 안 된다. 본 연구에서는 Ru 촉매의 구조적 안정성을 고려하여, 존재 확률이 높은 (0001) terrace 및 (10-10) step 표면을 설계하여 암모니아 분해 성능을 분석하였다. 또한, DFT 계산을 통해 두 표면에서의 암모니아 분해 메커니즘을 규명하고, 반응을 촉진할 수 있는 최적의 표면을 확인하였다.
상세설계 내용
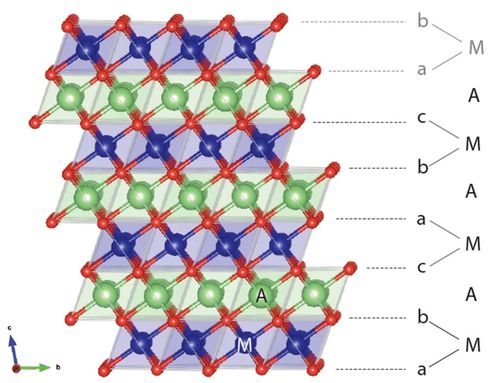
◇ NCA는 리튬 이온 배터리에 사용되는 양극재 중 하나로, Ni, Co, Al 산화물이 층상 구조로 구성된 충상 구조를 가진다 (Figure 9). 이 층상 구조는 층과 층 사이에 Li 이온을 저장하고, 충·방전 시 Li 이온이 intercalation과 deintercalation을 반복하며 에너지를 저장하고 방출하는 역할을 한다. 하지만 충·방전이 반복될수록 구조적 degradation이 발생하고, 특히 에너지 밀도를 높이기 위해 양극재의 Ni 함량을 증가할수록 구조가 더욱 불안정해지는 경향이 있다.
◇ 폐 NCA 배터리는 충·방전 과정에서 Ni-rich 층상 구조가 불안정해지고 충·방전 후 잔류 리튬층이 형성된다. 이는 사용하지 않은 NCA 배터리와는 달리 전극 물질의 상변화나 잔류 리튬층으로 인해 intercalation이 완료되지 않은 Li 이온이 전극 표면에 남아있을 수 있음을 의미한다. 이러한 잔류 리튬층 및 Ni-rich NCA의 불안정한 구조는 Ru 촉매와 혼합될 때 전자 밀도에 변화를 유도해, 암모니아 분해 반응에서 촉매의 활성에 영향을 줄 수 있다.
◇ 따라서 본 연구에서는 폐 NCA 배터리와 Ru 촉매를 혼합했을 때, 배터리의 degradation 과정에서 형성된 Li 원자 혹은 Li 화합물이 Ru 촉매 표면으로 이동하여 촉매 활성에 미치는 영향을 분석하고자 하였다. 이를 위해 먼저 DFT를 활용해 clean Ru 촉매의 terrace와 step 표면에서의 암모니아 분해 메커니즘을 규명하고, 이후 Li 이온이 첨가된 촉매 표면을 설계하여 동일한 반응을 분석하였다. 이를 통해 clean 표면과 Li 기반 물질이 존재하는 표면에서의 흡착 에너지를 비교하여 촉매의 활성이 어떻게 달라졌는지 평가하고, Li 기반 물질의 존재가 Ru 기반 촉매의 암모니아 분해 성능에 미치는 영향을 분석하였다.
결과 및 평가
완료 작품의 소개
개발과제 핵심결과
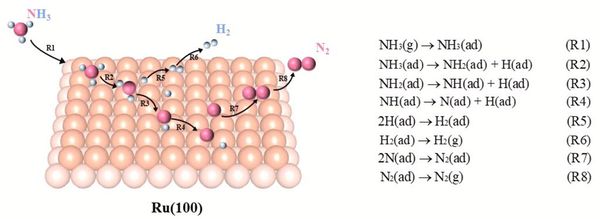
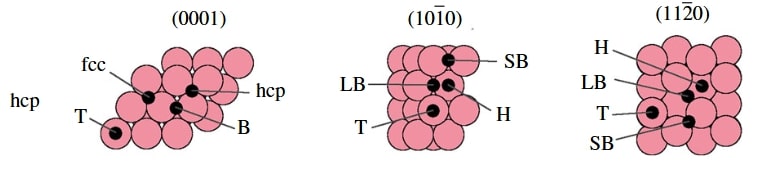
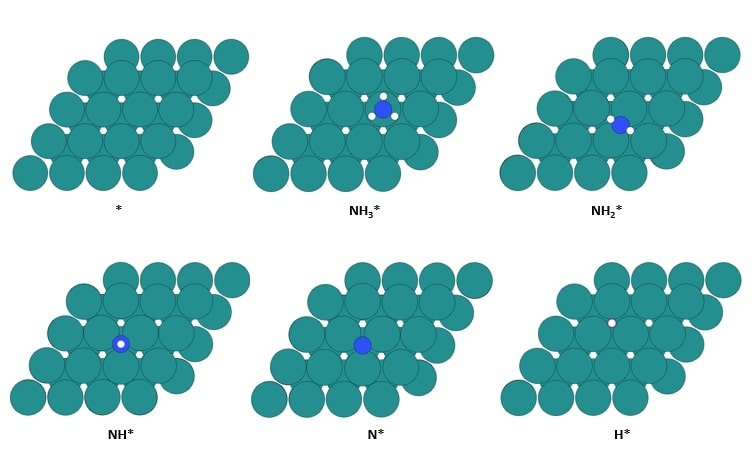
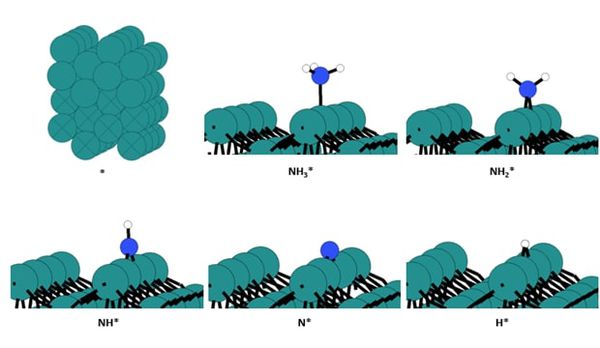
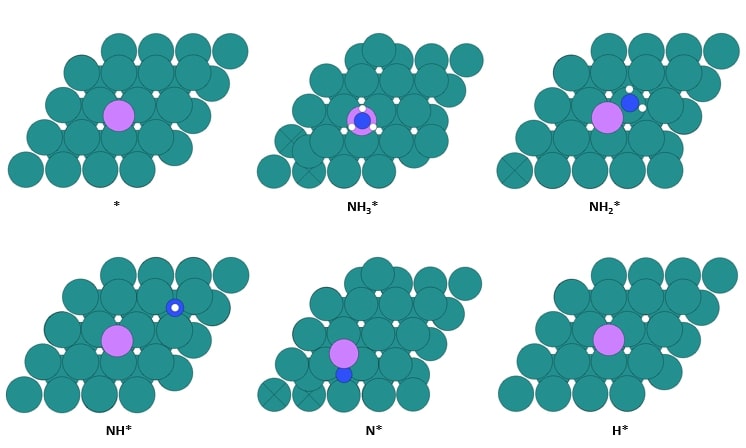
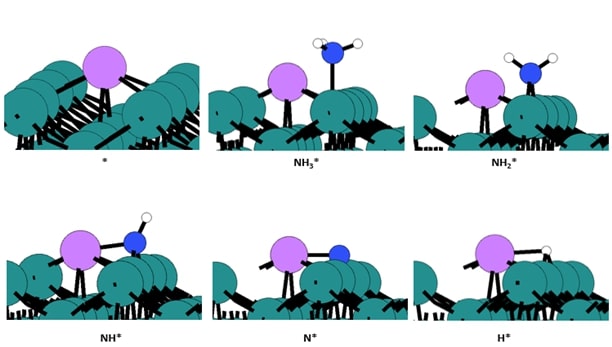
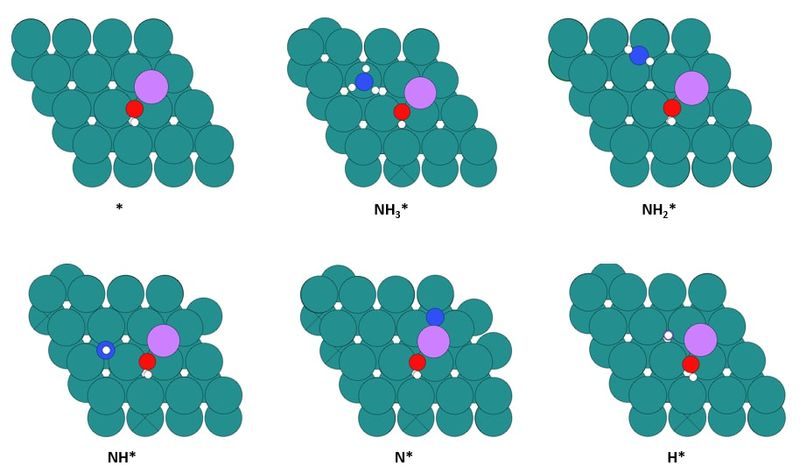
◇ 순수 Ru 촉매의 암모니아 분해 성능을 확인하기 위해 선행 연구의 Ru NP model을 참고해 terrace 및 step 표면을 설계하였다 (Figure 11). Ru NP model에서 매우 높은 비중을 차지하는 terrace 표면에서의 흡착 site는 ontop, bridge, fcc, 그리고 hcp site가 있으며, 흡착물의 구조에 따라 다양한 site에 흡착할 수 있다. 그리고 암모니아 합성 반응에서 활성이 뛰어나다고 알려져 연구가 활발히 이루어지고 있는 step 표면에서의 흡착 site는 ontop, short bridge, long bridge, hollow site가 있다 (Figure 12). Ru 표면 위의 흡착물은 Figure 4의 암모니아 분해 메커니즘을 기반으로 흡착시켰으며, 선행 연구에서 RDS로 알려진 NH3 dissociation step과 N2 association step을 중점으로 암모니아 분해 성능을 분석하였다.
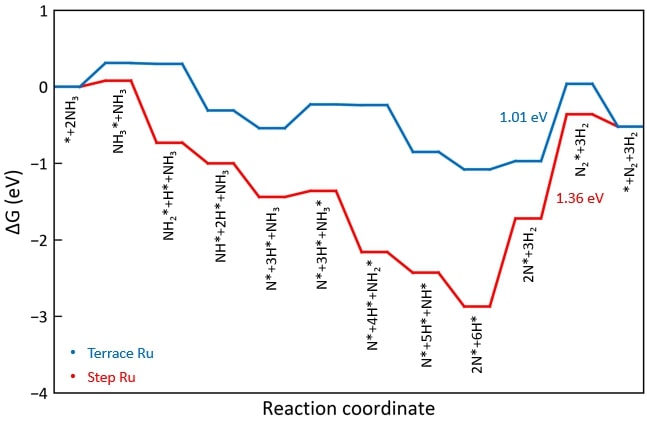
◇ 1기압, 600K 반응 조건에서 순수 Ru 촉매 표면에서의 암모니아 분해 메커니즘은 Figure 13에 나타나 있다. 반응 step별 흡착 에너지를 비교한 결과, terrace와 step 표면 모두 선행 연구와 동일하게 N2 association step이 RDS로 작용하며, 반응 전반에 걸쳐 terrace 표면보다 step 표면에서 흡착이 더 안정적임을 확인할 수 있다. 특정 step이 반응의 RDS임을 정확하게 판단하기 위해선 transition state를 확인할 수 있는 NEB(Nudged Elastic Band) 계산과 조건에 따른 화학 반응 속도를 예측할 수 있는 MKM(Micro-kinetic modeling) 계산을 통해 정확한 활성화 에너지를 계산해야 한다. 하지만 활성화 에너지를 직접 계산하지 않더라도 단순히 반응 에너지 비교함으로써 N2 association step에 더 많은 에너지가 필요한 step 표면에서 반응이 더 어렵다는 것을 유추할 수 있다.
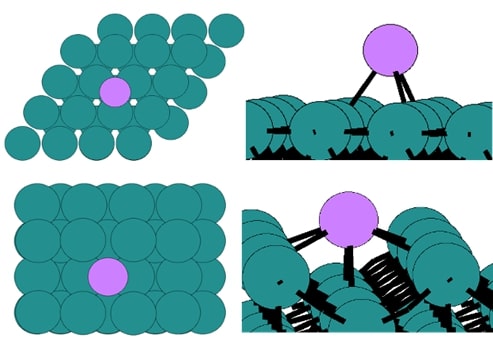
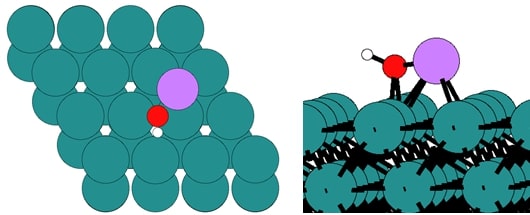
◇ 폐 NCA와 Ru 촉매를 혼합시키면 Li 이온이 암모니아 분해 성능을 향상시킬 것이라는 가정을 검증하기 위해 Ru 표면 위에 Li 이온을 흡착시켰다. 먼저, terrace 표면에서 Li 이온을 ontop, bridge, fcc, hcp site에 흡착시킨 결과, hcp site에서 흡착 상태가 가장 안정했다. 또한, bridge와 fcc site에서도 hcp site와 유사한 에너지를 가지므로 흡착 상태에 따라 Li 이온이 해당 위치로 이동할 가능성이 있다. 그리고 step 표면에서도 Li 이온을 ontop, bridge, 3-fold, 6-fold(hollow) site에 흡착시킨 결과, 6-fold site가 가장 안정했다. 이를 통해 terrace와 step 표면 모두에서 Ru 원자와 Li 이온 간의 결합 수가 많을수록 촉매 표면의 안정성이 증가함을 확인할 수 있다.
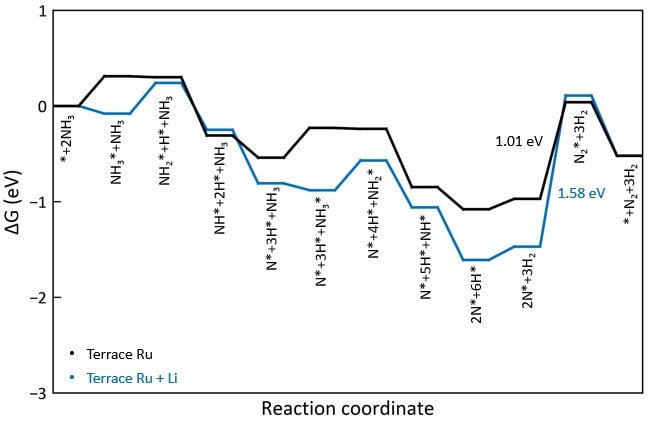
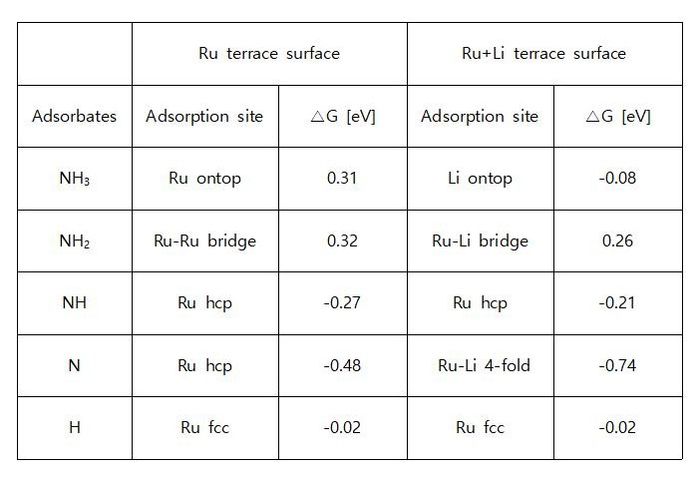
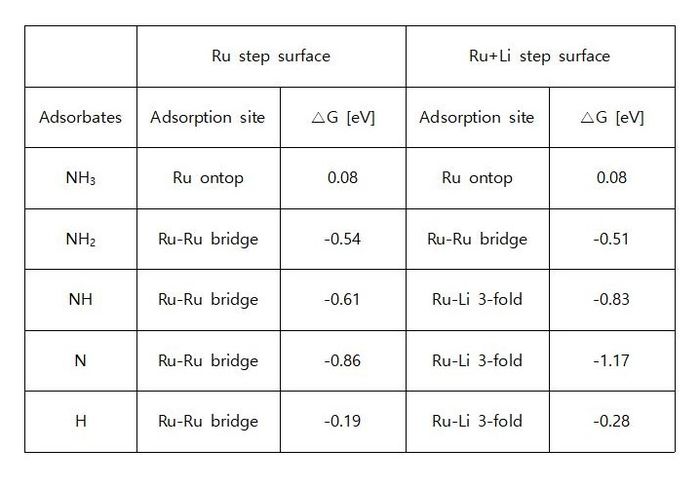
◇ Terrace 표면 위에 흡착된 Li 이온이 암모니아 분해 메커니즘에 미치는 영향을 분석하기 위해 free energy diagram을 작성하였다 (Figure 17). Li 이온이 흡착되었을 때 전체적으로 흡착 에너지가 안정해지는 경향을 보였으며, 이는 Li 이온이 촉매 표면의 전자 구조를 변형시켜 흡착물의 흡착 위치와 전자 구조에 변화를 유발했기 때문이다. 특히, Li 이온과 N 원자가 결합을 형성할 때(NH3*, NH2*, 그리고 N*), 흡착물이 더 안정해지는 경향을 보인다 (Table 5). 하지만 촉매 위에 흡착물이 너무 강하게 흡착할 경우, 탈착이 어려워져 반응이 다음 step으로 진행하기 어려워진다. 따라서 terrace 표면에 Li 이온이 흡착된 경우, Li 이온이 촉매 성능을 향상시킬 것이라는 가정과 달리, 흡착물의 흡착 에너지가 더욱 안정해져 촉매 활성이 감소하였다. 또한, N2 association step의 활성화 에너지를 직접 계산하지 않더라도, 반응 에너지(=1.58 eV)가 이미 600K의 반응 조건에서 가능한 활성화 에너지인 1.55 eV를 초과하기 때문에 해당 반응은 진행되기 어렵다는 것을 알 수 있다.
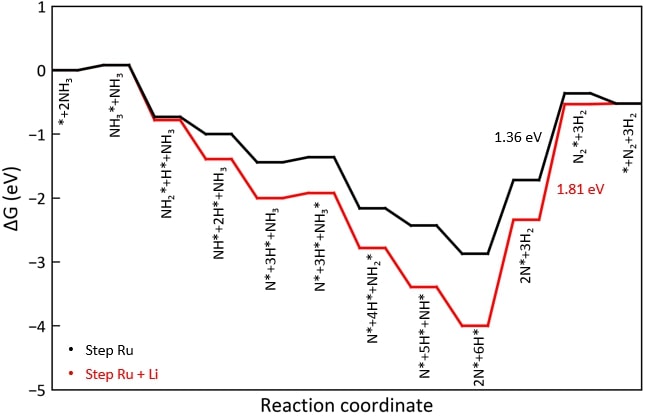
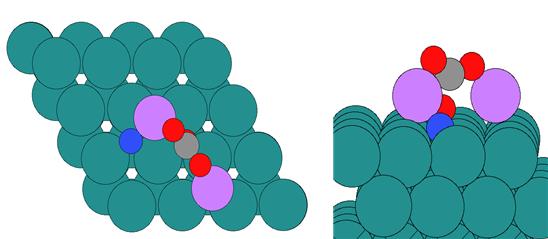
◇ Step 표면 위에 흡착된 Li 이온이 암모니아 분해 메커니즘에 미치는 영향을 free energy diagram을 통해 표현하였다 (Figure 19). Terrace 표면과 마찬가지로, Li 이온이 존재할 때 흡착 에너지가 더 안정해지는 경향을 보였으며, terrace 표면과 유사하게 N2 association step의 반응 에너지(=1.81 eV)가 반응 온도에서 가능한 에너지를 초과하기 때문에 Li 이온의 첨가가 촉매 성능을 악화시킨다는 것을 확인하였다. 촉매의 성능 악화는 흡착물이 더욱 안정해졌기 때문이며, 특히 NH*, N*, 그리고 H*에서 큰 차이를 보인다. 순수 Ru step 표면에서 해당 흡착물들은 Ru bridge site에 흡착하였지만 (Figure 16), Li 이온이 첨가된 표면에서는 Li 이온과 추가로 결합을 형성해 3-fold site로 흡착하기 때문에 표면과 더 강하게 결합하게 된다 (Figure 20). 이러한 이유로 인해 Li 이온은 흡착물의 흡착 에너지를 안정시켜 촉매의 활성이 저하됨을 확인할 수 있다.
◇ 폐 NCA와 Ru을 혼합시키면 NCA 내부의 잔류 Li 이온이 촉매 성능에 긍정적인 영향을 미칠 것이라는 초기 가정과 달리, 반응 중간체들이 Li 이온이 첨가된 Ru 촉매 표면에 더 강하게 흡착하여 촉매 성능이 전반적으로 저하되는 경향을 보였다. 이는 Li 이온이 흡착물의 결합 세기를 증가시켜 탈착이 어려워짐으로써 반응이 다음 step으로 진행되기 어려워지기 때문이다. 따라서, 앞으로의 연구 진행 방향을 설정하기 위해 폐 NCA-Ru 혼합 촉매의 성능 변화에 영향을 미칠 수 있는 다양한 요인들을 조사하였다. 특히 잔류 Li 이온의 형태, 촉매 표면의 구조적 변화, 그리고 다른 금속 이온과의 상호작용 등이 촉매 성능에 미치는 영향을 자세히 분석할 필요가 있다.
1. Li 화합물에 의한 촉매 활성 변화
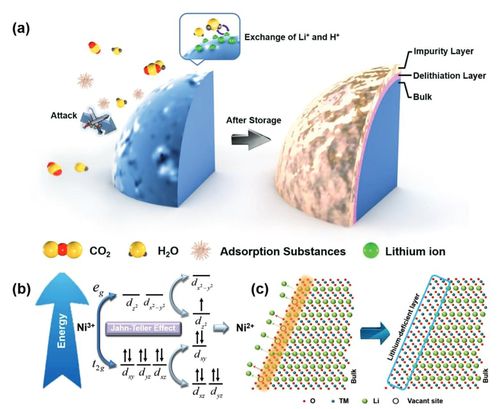
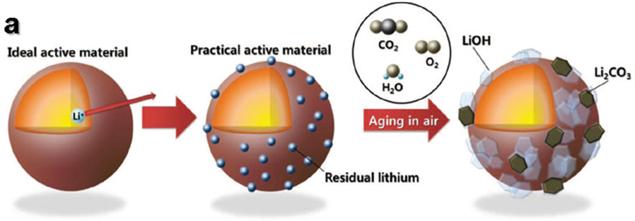
NCA 양극재를 사용한 배터리가 충방전 과정을 반복하며 열화를 겪을 때, 배터리 내부의 Li 이온은 표면에 Li2O2 코팅층 형태로 남게 된다. 이 코팅층은 Li 이온이 공기 중의 H2O나 CO2와 반응하여 생성된 LiOH, Li2CO3 같은 Li 화합물이 쌓이면서 형성된다 (Figure 21). 이러한 Li 화합물은 배터리가 정상적으로 사용된 후에도 표면에 남아있으며, 이를 따로 제거하지 않고 폐 NCA 배터리를 촉매 합성에 활용할 경우, Li 이온 자체가 아니라 Li 화합물의 형태로 촉매 표면에 결합할 가능성이 크다.
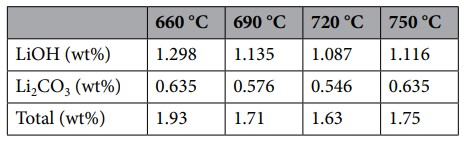
Li 화합물의 양과 조성은 배터리 제조 과정 중 NCA 양극재의 소성(sintering) 온도에 따라 달라진다. 소성 온도는 양극재 결정의 형태를 결정짓는 중요한 변수로, 이 과정에서 Li 화합물의 양과 조성이 변할 수 있다. 예를 들어, sintering 온도가 720℃보다 낮아질수록 NCA 표면의 잔류 Li 화합물의 양이 증가하는 경향을 보인다 (Table 7).
따라서 Li 화합물에 대한 계산을 진행할 때, sintering 온도와 촉매 활성 간의 상관관계를 세밀하게 고려해야 한다. 이는 폐배터리를 재활용하여 촉매로 활용하는 과정에서, 합성된 촉매의 성능을 평가하는 중요한 요소로 작용할 수 있다. 또한, 잔류 Li 화합물이 촉매에 미치는 영향을 분석함으로써 추후에 폐배터리 소재를 재활용한 합성 촉매의 방향성을 제시하는 데 큰 도움이 될 것이다.
2. 촉매 표면의 strain effect
폐 NCA 위에 Ru 입자가 올라간 형태의 합성 촉매를 형성할 경우, NCA의 층상 구조가 일종의 촉매 지지체 역할을 하게 된다. NCA lattice 구조는 배터리의 충·방전 과정에서 상 변이를 겪으며 변화할 수 있는데, 이는 NCA의 구조적 성질뿐만 아니라 Ru 입자에까지 영향을 미칠 수 있다. 이러한 lattice 변화는 tensile strain 또는 compressive strain을 유발할 수 있으며, strain의 종류 및 세기에 따라 촉매 표면의 전자 구조와 반응물의 흡착 세기에 변화를 일으켜 촉매 성능에 영향을 미칠 수 있다.
3. NCA-Ru 촉매 계면의 영향
합성된 촉매가 폐 NCA 위에 Ru 입자가 올라간 형태를 가질 수도 있으며, 이러한 형태에서는 암모니아 분해 반응이 Ru 표면, NCA 표면, 또는 NCA-Ru 계면에서 진행될 수 있다. 이때 성능이 뛰어나다고 알려진 Ru 촉매가 NCA와 혼합되면서 전자 구조가 변화하여 성능이 변할 수도 있으며, NCA 표면과 NCA-Ru 계면에서 반응이 진행되면서 반응 메커니즘 및 전체적인 경향성이 변할 수 있기 때문에 이 부분에 대한 연구도 필요하다.
4. M/Li cationic mixing 및 양극재의 구조 변화
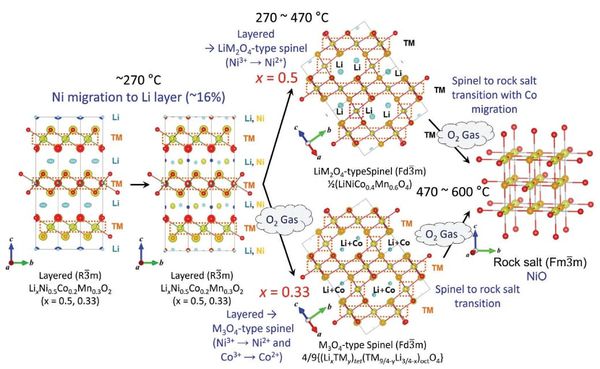
Cationic mixing은 전이금속이 산화수를 가지고 Li+ ion 층에 들어가 그 자리를 차지하는 현상을 의미한다. 이러한 현상은 Ni2+, Co2+, Mn2+ 이온에서 이러한 현상이 나타나며, 특히 Ni2+ 이온이 Li+ 이온과 비슷한 이온 반지름을 가지기 때문에 Ni/Li mixing 현상이 가장 뚜렷하게 일어난다. 이러한 현상으로 인해 NCA 양극재의 결정은 기존의 층상 구조에서 spinel 구조를 거쳐 NiO-like rock-salt phase로 변화하게 된다 (Figure 22).
이와 같은 구조적 변형은 촉매의 특성에 중요한 영향을 미칠 수 있다. 따라서 층상 구조와 NiO-like rock-salt phase로 구조가 변형된 촉매의 활성 및 성능을 비교하는 것이 중요하다. 이 과정에서, cationic mixing 현상에 의해 발생하는 구조적 변화가 반응 메커니즘 및 촉매 활성에 어떠한 영향을 미치는지 분석할 수 있을 것이다.
5. 입자 크기의 영향
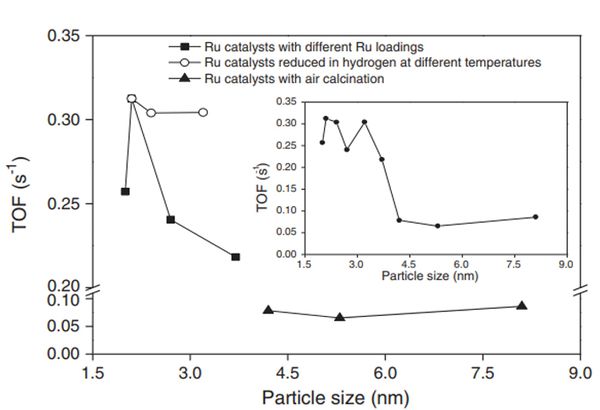
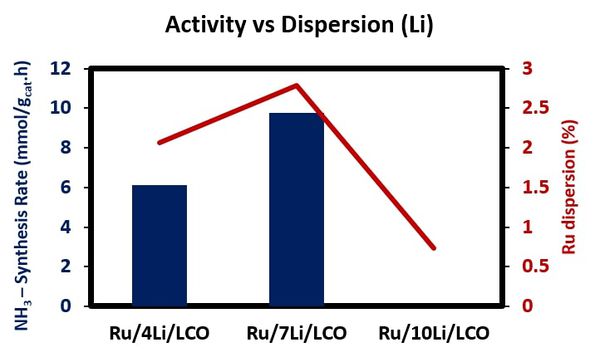
선행 연구의 촉매 실험 결과에 따르면 촉매 제조방법, Ru 입자 크기, 수소 흡착 및 암모니아 합성 활성 간의 상관관계가 있음을 보여준다. Ru 농도가 증가할수록 Ru 입자 크기가 증가하고, Ru에서 promoter로의 수소 이동과 탈착되는 수소의 양이 증가해 암모니아 합성 속도 또한 증가한다. 하지만, Ru 입자 크기의 증가는 B5 site 감소로 이어지며 결국 암모니아 합성 TOF가 감소하게 된다 (Figure 23).
Ru/La2Ce2O7(Ru/LCO) 촉매 연구에서는 지지체의 화학적 조성이 Ru 금속과 promoter 간의 interaction에 영향을 미치며, 이는 Ru 입자의 크기 안정화에 중요한 역할을 한다. 특히, Ru-Li-LCO interface에서는 Ru과 Li 간의 interaction이 약하기 때문에 Ru 입자가 상대적으로 더 크게 성장하는 경향을 보인다. 또한, Li promoter는 상대적으로 다른 알칼리 금속에 비해 작은 원자 질량으로 인해 다량의 Li 원자가 Ru 및 LCO 표면을 덮음으로써 촉매의 분산도가 떨어져 촉매 활성에 부정적인 영향을 미칠 수 있다. 그럼에도 불구하고, 적절한 양의 promoter를 사용함으로써 Ru 입자의 크기와 분산도를 조절하면 촉매 성능 개선에 긍정적인 영향을 미칠 수 있음을 확인하였다 (Figure 24).
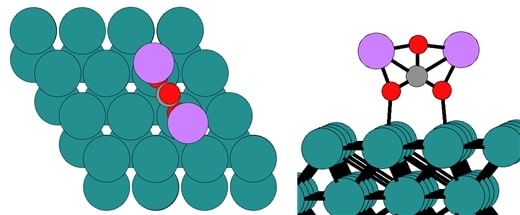
◇ 추가적으로, 본 연구에서는 Ru 표면에 흡착된 Li 이온이 공기 중의 H2O나 CO2와 반응해 LiOH와 Li2CO3의 Li 화합물을 형성된 후 암모니아 분해 반응이 진행되는 경우 폐 NCA-Ru 혼합 촉매의 성능 변화에 대해 분석하였다. 이를 위해 Li 이온과 동일하게 각 화합물의 흡착 구조를 파악하기 위해 Ru terrace 표면의 ontop, bridge, fcc, hcp site에 각각 흡착시킨 후 시스템의 에너지를 비교하였다. LiOH의 경우, Figure 25와 같이 산소는 Ru bridge site에, 리튬은 Ru fcc site에 흡착한 형태가 가장 안정했다. 그리고 Li2CO3의 경우, 분자의 전자 구조 계산에 최적화된 ORCA 프로그램을 활용하여 구조를 최적화한 뒤 Ru 표면에 흡착시켰으며, Figure 26과 같이 산소가 Ru ontop site에 수직으로 흡착한 형태가 가장 안정했다.
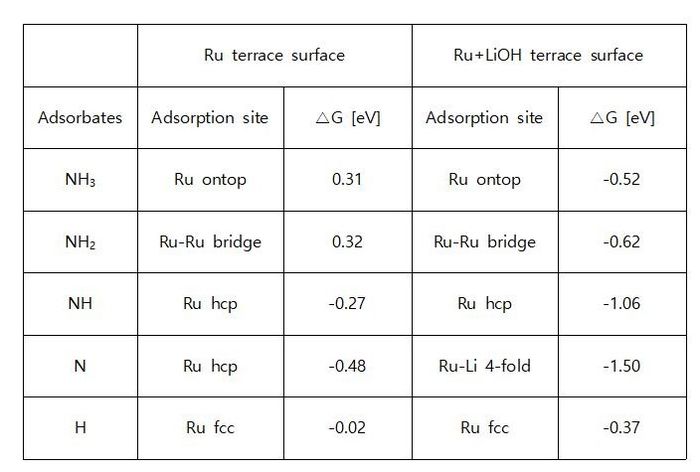
◇ Ru terrace 표면에서 clean 표면, Li 이온이 흡착된 표면, 그리고 LiOH가 흡착된 표면에 대해 암모니아 분해 반응의 free energy diagram을 비교한 결과는 Figure 27과 같다. 모든 표면에 대해 N2 association step이 RDS로 작용하며, Li 기반 물질이 흡착된 경우 전체적으로 흡착 에너지가 안정화되는 경향을 보인다. 이는 Ru 표면에 Li이 흡착하게 되면 촉매 표면의 전자 밀도를 변화시키고, Ru보다 Li 원자가 전자를 강하게 끌어당겨 반응 중간체와 더 강한 결합을 형성해 반응물의 이동 및 탈착이 어려워지기 때문이다. 특히, LiOH가 흡착된 경우에는 Li이 양이온 형태로 존재해 전자를 더 강하게 끌어당길 뿐만 아니라, 수산화 이온(OH-)이 반응 중간체와 일부 수소 결합을 형성함으로써 매우 안정한 흡착 상태를 나타낸다
◇ clean Ru 표면부터 Li 이온 및 LiOH가 흡착된 표면까지 암모니아 분해 반응 메커니즘을 분석한 결과, 모든 표면에서 N* 흡착 에너지가 가장 안정한 것으로 나타났다. 이는 반응 전체에서 N2 association step이 RDS로 작용함을 의미하며, 본 연구팀은 N* 흡착 에너지가 촉매 성능 평가에 활용될 수 있는 주요 지표로 연구 효율성을 높이는 데 기여할 수 있다고 판단하였다. 이에 따라, Ru terrace 표면에 Li2CO3가 흡착된 촉매의 성능을 예측하기 위해 N* 흡착 에너지를 계산하였으며, 흡착 에너지와 흡착 형태는 각각 Figure 27과 Figure 29에 나타나 있다. Free energy diagram에서 흡착 에너지가 Li 이온이 흡착된 표면과 LiOH가 흡착된 표면 사이의 범위에 존재하는 것으로 보아, Li2CO3가 흡착된 표면 또한 촉매 성능이 저하될 것으로 예상된다. 이는 탄산 이온(CO32-)이 수소 결합을 형성하지 않아 수산화 이온에 비해 결합 세기가 약하지만, 여전히 표면 전자 밀도를 변화시켜 반응 중간체의 결합을 강하게 만들기 때문이다.
◇ 암모니아 분해 반응은 수소 생산을 위한 핵심 기술로, 단일 금속 중 성능이 가장 우수한 Ru 기반 촉매가 널리 연구되고 있다. 본 연구에서는 Ru 촉매의 성능을 향상시키기 위해 리튬 이온 폐배터리 소재를 재활용하는 방안을 제안하였다. DFT 계산을 통해 Li 이온 및 Li 화합물이 Ru 표면에 흡착되어 반응 중간체의 흡착 세기를 조절하고 촉매 활성을 저하시킨다는 점을 확인하였다. 이와 더불어, 입자 크기 조절을 통한 촉매 표면의 구조적 변화, 지지체 및 그 계면의 작용, 알칼리 금속 사용과 같이 촉매 성능에 영향을 미칠 수 있는 요인을 제시하였다. Li 기반 물질의 첨가가 촉매 활성 저하를 유발할 수 있음을 발견하였으며, 이는 암모니아 분해 촉매 성능 개선을 위해 다른 방식으로 촉매를 변형시켜야 한다는 방향성을 제시한다. 본 연구는 촉매 성능 극대화와 동시에 환경 보호를 고려한 지속 가능한 방향을 제안하며, 향후 다양한 연구를 통해 저비용, 고효율의 암모니아 분해 촉매 설계 및 수소 경제 활성화에 기여할 것으로 기대된다.
포스터
완료작품의 평가
향후계획
◇ 현재 암모니아 분해 반응에 주로 사용되는 Ru 기반 촉매에 다양한 물질을 첨가함으로써 촉매 표면 구조와 전자 구조를 변화시켜 촉매의 성능을 향상시키기 위한 연구가 활발히 진행되고 있다. 특히 전이금속을 도핑시키거나 NCA 양극재나 비금속 물질 등을 추가하여 촉매의 반응성과 안정성을 높이는 방법이 연구 중이다. 예를 들어, 탄소나노튜브나 그래핀과 같은 탄소 기반 소재는 높은 전도성과 우수한 열 안정성 덕분에 촉매 지지체로 주목받고 있다. 이러한 합성 촉매 개발을 통해 상대적으로 적은 비용으로 암모니아 분해를 통한 수소 생산 효율을 극대화할 수 있다.
◇ 암모니아 분해 반응은 상대적으로 고온 조건에서 진행되기 때문에 촉매를 활용하더라도 장기간 사용 시 촉매의 성능이 저하될 가능성이 크다. 따라서 촉매의 활성을 높여 반응 수율을 높일 뿐만 아니라, 표면 코팅, 촉매 binder, 금속-산화물 복합체 등을 활용하여 촉매의 안정성 및 내구성을 높이기 위한 연구도 동시에 진행되어야 한다. 특히, 고온에서 산화되거나 결정 구조가 붕괴되지 않는 물질에 대한 연구가 중요하다. 또한, 반응 조건에 따라 촉매의 구조 및 활성이 달라지기 때문에 반응 효율을 극대화시킬 수 있는 최적의 조건을 찾아야 한다. XRD나 라만 분광법 등을 활용하여 조건에 따른 촉매 구조 변화를 확인하고 활성 site 개수를 최대로 만들 수 있는 조건을 확인할 수 있다. 또한, 현재 연구실 수준에서 연구되고 있는 촉매를 실제 산업 현장에 적용할 수 있는 방안에 대한 연구도 필요하다.
◇ 최근 밀도범함수이론과 머신러닝을 활용한 이론적인 촉매 연구가 활발히 이루어지고 있으며, 이를 통해 다양한 촉매 시스템을 예측하고 최적화할 수 있게 되었다. 계산화학을 활용하면 조성에 따른 촉매 표면 구조 및 반응 에너지를 예측하고, free energy diagram을 제작하여 반응 메커니즘을 분석할 수 있다. 이를 통해 실험에서 겪을 수 있는 시행착오는 줄이면서 성능이 뛰어난 촉매를 설계할 수 있고, Volcano plot과 같은 분석 기법을 통해 검증이 필요한 촉매 후보군을 줄여가면서 최적의 촉매를 효율적으로 개발할 수 있다.
◇ 암모니아는 이미 전 세계적으로 많이 유통되고 사용되는 물질로, 암모니아 분해 반응을 통해 대량의 수소를 안정적으로 공급할 수 있다는 장점이 있으며, 이러한 특성 덕분에 암모니아 기반의 수소 공급망이 점차 확대될 것이다. 그리고 암모니아 분해 반응에 필요한 에너지를 공급하기 위해 화석연료 대신 태양광이나 풍력 등과 같은 신재생 에너지를 활용한 방안을 찾아야 한다. 이를 통해 온실가스 배출이 0에 수렴하는 완벽하게 탄소 중립적인 수소 생산이 가능해진다면, 더 넓은 분야에 응용할 수 있으며, 미래에 화석연료 고갈로 인해 에너지 수급이 불안정해지더라도 꾸준히 수소를 생산할 수 있을 것이다.
참고문헌
[1] Energy Institute - Statistical Review of World Energy (2024); Smil (2017) – with major processing by Our World in Data
[2] Muhammad Asif et al., “Recent advances in green hydrogen production, storage and commercial-scale use via catalytic ammonia cracking”, Chemical Engineering Journal 473 (2023), 145381
[3] Xiuyuan Lu et al., “Kinetic and mechanistic analysis of NH3 decomposition on Ru(0001), Ru(111) and Ir(111) surfaces”, Nanoscale Adv., 2021, 3, 1624
[4] J.C. Ganley et al., “A priori catalytic activity correlations: the difficult case of hydrogen production from ammonia”, Catalysis Letters 96, 117–122 (2004)
[5] Dipak J. Garole et al., “Recyle, Recover and Repurpose Strategy of Spent Li-ion Batteries and Catalysts: Current Status and Future Opportunities”, ChemSusChem 2020, 13, 3079-3100
[6] Zikai Su et al., “Research progress of ruthenium-based catalysts for hydrogen production from ammonia decomposition”, International Journal of Hydrogen Energy 51 (2024), 1019-1043
[7] Asbjørn Klerke et al., "Ammonia for hydrogen storage: challenges and opportunities", J. Mater. Chem., 2008, 18, 2304-2310
[8] Shreya Mukherjee et al., "Low-temperature ammonia decomposition catalysts for hydrogen generation", Applied Catalysis B: Environmental 226 (2018), 162-181
[9] Chongqi Chen, et al., "Ru-based Catalysts for Ammonia Decomposition: A Mini-Review", Energy & Fuels 2021, 35, 11693-11706
[10] F. R. García-García, A. Guerrero-Ruiz, and I. Rodríguez-Ramos, "Role of B5-Type Sites in Ru Catalysts used for the NH3 Decomposition Reaction", Topics in catalysis 52 (2009), 758-764
[11] Jianwei Zheng et al., "Efficient Non‐dissociative Activation of Dinitrogen to Ammonia over Lithium‐Promoted Ruthenium Nanoparticles at Low Pressure", Angew. Chem. Int. Ed., 2019, 58, 17335-17341
[12] Shekhar R. Kulkarni et al., “Elucidating the rate-determining step of ammonia decomposition on Ru-based catalysts using ab initio-grounded microkinetic modeling”, Catal. Sci. Technol., 2023, 13, 2026-2037
[13] Ho Jin Lee and Eun Duck Park, “Ammonia Decomposition over Ru/SiO2 Catalysts”, Catalysis, 2022, 12, 1203
[14] Xiangyong Huang et al., “Recent Progress on Hydrogen Production from Ammonia Decomposition: Technical Roadmap and Catalytic Mechanism”, Molecules, 2023, 28, 5245
[15] Qingfeng Teng et al., “Ru/Attapulgite as an Efficient and Low-Cost Ammonia Decomposition Catalyst”, Catalysts, 2024, 14, 197
[16] David S. Sholl and Janice A. Steckel, Density Functional Theory, New Jersey: John Wiley & Sons, Inc., 2009
[17] Peng Zhao et al., “Morphology and Reactivity Evolution of HCP and FCC Ru Nanoparticles under CO Atmosphere”, ACS Catal. 2019, 9, 2786-2776
[18] Julia H. Yang et al., “Insights into Layered Oxide Cathodes for Rechargeable Batteries”, Molecules 2021, 26, 3173
[19] Wujiu Zhang et al., “Air INstalibity of Ni-Rich Layered Oxides-A Roadblock to Large Scale Application”, Adv. Energy Mater. 2023, 13, 2202993
[20] Fabian Morteo-Flores et al., “Biomass hydrogeoxygenation catalysts innovation from atomistic activity predictors”, Phil. Trans. R. Soc. A. 2020, 378: 20200056
[21] Ji Ung Choi et al., “Recnet Progress and Perspective of Advanced High-Energy Co-Less Ni-Rich Cathodes for Li-Ion Batteries: Yesterday, Today, and Tomorrow”, Adv. Energy Mater. 2020, 10, 2002027
[22] Hye-Jin Park et al., “Influence of sintering temperatures on microstructure and electrochemical performances of LiNi0.93Co0.04Al0.03O2 cathode for high energy lithium ion batteries”, Sci Rep. 2022 12, 9617
[23] Sung-Kyun Jung et al., “Unveiling the Role of Transition-Metal Ions in the Thermal Degradation of Layered Ni-Co-Mn Cathodes for Lithium Rechargeable Batteries”, Adv. Funct. Mater. 2022, 32, 2108790
[24] Bingyu Lin et al., “Effect of treatment conditions on ruthenium particle size and ammonia synthesis activity of ruthenium catalyst”, Catalysis Communications 2013, 39, 14-19
[25] Hizkia Mannuel Vieri et al., “Comparative Study of Ba, Cs, K, and Li as Promoters for Ru/La2Ce2O7-Based Catalyst for Ammonia Synthesis“, International Journal of Energy Research 2023, 2072245