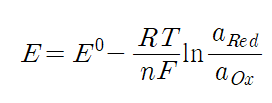LMB
프로젝트 개요
기술개발 과제
국문 : 리튬메탈베터리의 안정화를 위한 덴드라이트의 효과적인 억제 방안
영문 : Effective Method to Inhibit Dendrite Growth for Stable Lithium Metal Battery
과제 팀명
LMB
지도교수
정철수 교수님
개발기간
2021년 9월 ~ 2021년 12월 (총 4개월)
구성원 소개
서울시립대학교 화학공학과 20183400** 김*랑(팀장)
서울시립대학교 화학공학과 20183400** 박*혜
서울시립대학교 화학공학과 20183400** 정*진
서울시립대학교 화학공학과 20183400** 황*진
서론
개발 과제의 개요
개발 과제 요약
- 리튬메탈배터리(Lithium metal battery, LMB)는 리튬이온배터리(Lithium ion battery, LIB)보다 10배 이상 높은 용량, 높은 에너지 밀도를 가짐에도 불구하고 덴드라이트의 생성으로 사용되지 못하고 있다.
- Li 덴드라이트가 성장하면 부반응으로 인해 배터리의 쿨롱 효율이 낮아질 뿐만 아니라, 배터리의 단락화 등을 유발하여 배터리의 고장을 초래하는 문제를 일으킨다.
- 기존 사례에 의하면 전해질 디자인, 전극의 시드(seed) 디자인, 보호막의 소재 선택과 같은 다양한 방법을 통해 덴드라이트 생성 속도를 조절하고 LMB를 안정화시킬 수 있다.
- 따라서 덴드라이트 억제를 통한 LMB 상용화를 목표로 한 연구 방향에 대해 조사해보고자 한다.
개발 과제의 배경
- Li 금속을 anode로 사용하는 배터리를 리튬메탈배터리라고 한다. 리튬이온배터리의 anode는 흑연을 사용하는데, 이 흑연물질의 이론용량은 약 372 mAh/g이고 LMB의 이론용량은 약 3,860 mAh/g으로 흑연보다 10배 이상 높은 용량을 가진다. 에너지 밀도는 LIB는 800 Wh/L, LMB는 1000 Wh/L 이상이다.[1]
- 최근 미국의 LMB 개발업체인 솔리드에너지시스템(SES)은 현재 개발 중인 LMB를 2025년에 상용화할 계획이라고 밝혔다. 지난 5월 현대차와 기아가 LMB 개발을 위해 제휴개발계약(JDA)를 SES와 체결하면서 LMB 개발에 박차를 가하고 있다.[2]
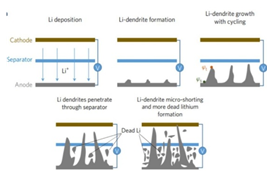
- 이렇게 각광받는 LMB의 개발이 늦었던 이유는 Li 금속을 anode로 사용하게 되면서 생기는 Li 덴드라이트(Lithium dendrite) 현상 때문이다. Li 덴드라이트란, Li 표면과 전해질과의 화학 반응으로 인해 생성되는 불안정한 SEI(Solid electrolyte interface)층으로 전자가 유입되어 Li 이온과 결합해 Li 금속이 석출되어 균일한 표면을 이루지 못하고 한 곳에 집중적으로 전착이 심해지는 현상을 말한다.[3]
- LIB, LMB 모두 전지를 충전할 때 Li 이온이 anode에 도금되는 과정을 거치는데 LMB의 anode인 Li 금속은 기존 LIB의 anode인 흑연보다 훨씬 더 큰 부피 변화를 수반하여 SEI층의 파괴 및 재형성을 유발한다. SEI층이 파괴되면 전자가 유출되어 일어나는 부반응으로 인해 전해질과 활성 물질이 지속적으로 고갈되어 쿨롱 효율과 사이클 수명을 낮추고 배터리의 고장을 초래한다.[4,5] 또한 지속적으로 성장하면서 부피가 커져 불안정해진 덴드라이트가 부서지면 집전체로부터 분리된 “Dead Li”이 형성된다. Dead Li이 발생하면 충전 및 방전 중에 Li 이온이 비가역적으로 전환되어 용량 손실을 일으킨다.[6] 마지막으로 덴드라이트가 길게 성장하면 SEI층 뿐만 아니라 분리막의 파괴까지 초래할 수 있다. 결과적으로 덴드라이트의 끝부분이 LMB의 cathode에 닿아 배터리의 단락을 유발하여 폭발 등의 문제가 발생한다.[7] 이러한 문제로 인해 LMB를 상용화하기 위해서는 덴드라이트의 생성 억제 또는 성장 억제가 매우 중요한 역할을 한다.
- 따라서 본 과제를 통해 LMB의 원리와 덴드라이트의 생성 및 성장 메커니즘을 조사하여 이해하고, 덴드라이트에 대한 LMB의 영향을 분석하여 이를 억제할 수 있는 방안들의 사례를 모색한다. 또한, 이 방안들과 덴드라이트 억제의 관계성을 파악하여 이해한다.
개발 과제의 목표 및 내용
최종 목표
- LMB 상용화 및 배터리 효율 개선에 필요한 덴드라이트 억제 관련 연구 조사
세부 목표
- Anode로써 흑연과 리튬 금속의 차이를 이해하고, 리튬 금속 anode에서 덴드라이트 생성과 성장에 대한 과정과 원리에 대해 분석한다.
- 전해질 첨가제, 분리막 등의 다양한 조건 변화로 리튬 금속 표면에 생성되는 덴드라이트의 생성 또는 성장을 억제하여 높은 안정성과 높은 쿨롱 효율을 갖기 위한 방안들을 조사한다.
- 덴드라이트는 리튬 금속 표면에 리튬 이온 농도의 감소로 인해 발생하기 때문에 리튬 금속 계면에서 리튬 이온의 농도를 일정하게 유지시킬 수 있는 방법에 대해 조사한다.
- 리튬 금속 표면의 덴드라이트는 리튬의 환원 반응으로 인해 불균일하게 성장하여 SEI층 및 분리막을 파괴하여 내부단락을 발생시킨다. 그러므로 덴드라이트 성장을 늦추거나 균일한 덴드라이트 성장을 위한 방향으로 조사를 진행한다.
전해질 디자인
고농도의 전해질을 사용했을 때 전기화학적 산화, 환원의 안정성이 향상된다는 연구와 더불어 이를 사용한 LIB에서 덴드라이트 형성이 억제된 결과가 보고되고 있다. 또한 전해질에 첨가제가 포함되어 있을 때, 첨가제가 분해되면서 SEI층의 특성을 바꾸고 이는 결과적으로 리튬 금속이 자라는 데에 중요한 영향을 끼친다. 예를 들어, 세슘과 같은 금속이온과 불소가 함유된 첨가제를 사용하는데, LMB의 문제점인 낮은 쿨롱 효율을 높여주는 효과를 가지지만, 세슘 이온은 리튬 이온과 환원전위 차이가 크지 않기 때문에 고속으로 충방전할 때에는 덴드라이트의 성장을 막기 어렵다는 한계가 여전히 존재하고 있다.
전극의 시드 디자인
덴드라이트 생성의 시작인 시드를 조절하면 덴드라이트의 성장을 막고 균일한 덴드라이트 증착을 유도할 수 있다.[8] 리튬 금속 anode에 특정 금속을 원자 단위로 분산시키면, 그 특정 금속과 리튬이 solid solution을 형성하여 interface energy를 낮추어 균일한 증착을 유도하는 시드 역할을 하게 된다. 이러한 역할을 하는 금속에는 리튬에 비해 표준 환원 전위가 높은 금속들을 사용할 수 있다. 예로, Ga, In, Mg, Zn, Au 등이 있다. 이 금속들이 리튬 금속 anode에 있다면 덴드라이트가 증착하기 이전에 alloy phase를 형성하여 리튬 증착을 분산시킬 수 있다.
보호막의 소재 선택
리튬 덴드라이트의 성장을 억제하거나, 또는 보다 compact한 성장을 유도시키기 위해 보호막의 toughness와 shear modulus를 증가시키는 소재 설계가 진행되고 있다. 무기전해질 소재는 낮은 전자전도성과 우수한 이온 전도성으로 인해 덴드라이트의 성장을 물리적으로 억제가 가능하다는 장점을 갖는다. 하지만 무기소재 보호막은 리튬 계면과 보호막에서의 화학적 안정성이 취약하다는 공통적인 한계가 존재한다. 산화물계 무기전해질의 경우는 리튬 전극과 밀착 계면 형성에 어려움을 가지고, 황화물계 무기전해질의 경우는 리튬과의 화학적 안정성이 취약하다. 유무기 복합 보호막은 무기소재 도입으로 보호막의 강도를 높여 덴드라이트 생성을 억제시키는 유무기 소재들의 상호보완적 기능을 이용하는 설계가 진행되고 있다.[9]
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
가. 전 세계적인 기술현황
- 리튬 금속이 성장할 때 전해질 특성에 크게 영향을 받기 때문에, 리튬을 안정하게 자랄 수 있게 하는 전해질에 대한 연구가 더욱 활발히 진행되고 있다. 덴드라이트, 낮은 이온전도도와 같은 문제를 해결하기 위해 폴리머, 황화물, 산화물 등 다양한 고체 전해질 연구가 계속되고 있지만, 현재까지 액체 전해질을 사용하는 배터리보다 더 나은 배터리를 만들지 못했다.[10]
- 전해질 디자인 외에도 분리막을 개질하거나 리튬 금속 표면을 개질하는 등 다양한 방면에서 리튬 덴드라이트 억제 연구가 진행되고 있다. 하지만 여전히 이끼(Mossy)상의 덴드라이트가 내부에 형성되거나, 높은 전류 밀도에서는 완전한 억제가 불가능하다는 한계가 존재한다.[11]
- 이와 같은 문제를 해결하기 위해 복합 고체 전해질을 적용하거나, 무기 고체 전해질 보호막을 사용하여 차세대 리튬금속배터리를 선보이기 위한 연구들이 진행되고 있다. 복합 고체 전해질은 무기 고체 전해질과 고분자 고체 전해질의 장점을 결합하여 높은 이온 전도성, 우수한 기계적 특성을 제공한다. 하지만 복합 고체 전해질에 자주 사용되는 Polyethylene Oxide(PEO)는 실온에서 이온전도도가 낮고 기계적 강도가 낮아 LMB에 적용하는 것이 어려웠다. 따라서 연구에서는 PAN/LIZTO의 3차원 섬유 네트워크에 의해 강화된 복합 고체 전해질을 사용하여 리튬 이온의 빠른 이동과 균일한 증착을 촉진시키고 polymer matrix의 기계적 강도를 개선하여 덴드라이트의 성장을 효과적으로 억제할 수 있었다.[12]
- 또한 국제 학술지인 ‘Nature energy’에 게시된 최근 연구 중 하나는 그래핀계 나노소재를 리튬 금속 표면에 균일하게 전사하여 인조 고체 전해질 계면상을 만들거나, 양자역학 계산을 통해 최적의 전해질을 배합하는 기술을 발표했다. 이와 더불어 리튬 핵생성 과전압 측정을 도입하고 인조 고체 전해질 계면상 효과에 관한 빠른 평가가 가능해졌다.[13]
- 하지만 차세대 배터리 로드맵에서 LIB를 잇는 수많은 배터리 후보군 중에 가장 앞서 있는 배터리가 전고체 배터리임에도 불구하고, 양산 공정 중에 발생 가능한 문제점과 더불어 배터리 시장의 상황, 기업들의 의지에 따라 전고체 배터리의 상용화 시기는 아직 예측이 불가능한 시점이다.[14]
나. 특허조사 및 특허 전략 분석
특허 현황
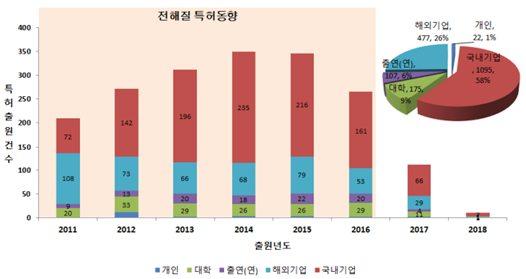
- 현재 리튬이차전지 관련 특허는 기술 분야별로 양극활물질, 음극활물질, 분리막, 전해질로 나뉜다. Fig.2에서 볼 수 있듯이 전해액에 관련된 특허가 가장 많은 비중을 차지하고 있다.[15]
- Fig.3에서 전해질 관련 특허 동향을 살펴보면 리튬이차전지 전해질 기술은 2015년까지 꾸준히 증가하였으며 국내기업이 가장 큰 비율을 차지하고 있다. 현재 고분자 전해질, 리튬염과 부반응 억제 첨가제 포함 전해질 조성물, 젤 고분자 전해질을 포함하는 리튬이차전지 제조방법 등 다양한 기술을 보유하고 있다.[16]
특허 기술 조사
금속 기반 배터리의 덴드라이트 억제 전해질
본 특허는 전해질에 비프로톤성 용매를 사용하며 단일 할로겐 함유 물질로 금속 할라이드염을 포함한다. 금속 할라이드염을 사용하게 되면, 금속-기반 배터리의 사이클링 능력이 향상된다. 또한 사이클링 능력 향상을 위해 추가로 단일 할로겐 함유 물질 첨가제와 나노 다공성 고체(알루미나-PVDF 멤브레인)를 포함한다. 본 특허를 따라 우수하게 형성된 염-풍부 SEI(Solid Electrolyte Interphase)층은 금속 이온 이동 속도를 조절하고, anode 금속 표면의 금속 이온 플럭스 분포를 조절하여 안정하고 균일하게 증착을 유도할 수 있다. 이러한 방법을 사용하게 되면, 금속 anode의 노출을 방지할 수 있으며, 전해질 내에서 첨가제가 균일하게 존재할 수 있다. 또한 배터리의 장기간 사용을 위해 배터리 수명의 주요 부분인 SEI층의 회복이 가능하게 된다.[17]
리튬 금속 전지용 전해질 및 이를 포함하는 리튬 금속
본 특허는 전이금속 또는 전이금속염을 첨가제로 포함하는 리튬 금속 전지용 전해질을 이용하여 리튬 금속의 안정성을 향상시킨다. 리튬 금속의 안정성이 향상되면 전극 표면에서의 리튬 덴드라이트의 성장이 억제되어 LMB의 전기화학적 특성, 안정성을 개선시켜 전지의 용량과 수명을 향상시키는 효과를 나타낸다. 이때, 망간, 금, 코발트, 니켈, 아연, 은 및 백금으로 이루어진 군으로부터 하나 이상의 전이금속이 10~2000 ppm 함유된 전이금속 혹은 전이금속염을 첨가제로 사용하며, 리튬 금속 전지용 전해질의 중량을 기준으로 0.05~2 wt%를 첨가제로 첨가한다.[18]
고체 전해질막 및 이를 포함하는 전고체 전지
본 특허는 고체 전해질막 내에 리튬 덴드라이트의 성장을 억제하는 chloride, cyanide, hydroxide 등 억제물질을 위치시킨다. 이 물질은 리튬보다 반응성이 낮아 이온화 경향이 낮으므로 억제물질에 의해서 리튬 이온이 환원되어 금속으로 석출되는 것을 막을 수 있다. 더불어 석출된 금속 리튬을 다시 이온으로 산화시켜 리튬 덴드라이트의 저감이 가능하다. 또한, 필러 입자와 고분자 전해질 재료가 혼합된 고체 전해질막을 사용할 수 있는데, 필러 입자는 고분자 전해질 재료가 분포된 위치로 덴드라이트의 성장 방향을 안내하는 역할을 한다. 고분자 전해질 재료에 비해 필러 입자의 강도가 높기 때문에, 리튬 덴드라이트는 강도가 높은 필러 입자보다 고분자 전해질 재료가 배치된 방향으로 성장하게 된다. 또한. 사용되는 고분자 전해질 재료는 덴드라이트 성장 억제 물질을 포함하므로 더욱 효과적인 덴드라이트의 저감이 가능하다. 위와 같은 방법을 통해 리튬의 덴드라이트 성장이 억제되거나 지연되는 효과를 가질 수 있고, 덴드라이트 성장에 따른 전기적 단락의 효과적인 방지가 가능하다.[19]
폴리머 전해질
본 특허는 폴리머 전해질을 첨가하여 리튬 덴드라이트 성장을 억제하고 저온 혹은 고온에서 방전되는 특성을 보완하기 위한 전지 제공에 목적을 둔다. 폴리머 전해질은 폴리머 겔을 포함하는 전해질로, 상기 폴리머 겔은 공중합성 비닐기, (폴리)옥시에틸렌기, 글리시딜에테르 화합물 등을 포함하고 있다. 폴리머 전해질 속에 적당한 전해액이 포함되어 있기 때문에 리튬 이온의 이동에 방해가 되지 않으며, 폴리머 chain이 anode의 리튬 금속 표면을 도포하면서 리튬을 균일하게 석출시키기 때문에 리튬 덴드라이트 형성이 최소화된다. Seed가 형성되면 전해질의 폴리머 네트워크에 의해 생성이 억제된다.[20]
특허 전략
- 2010년대부터 전기차 산업이 성장하면서 한국·중국·일본이 중대형 이차전지 산업을 이끌어가고 있으며, 2020년을 기준으로 3국이 이차전지 시장의 95%를 점유하고 있다. 전지 제조기술은 3국이 비슷한 수준을 가지고 있지만 생산성 및 품질관리수준은 한국이 우위에, 가격은 중국이 우위에 있다. 앞으로 한국이 이차전지 수요 확대에 따른 이차전지 산업을 주도하기 위해서는 우수한 기술 개발뿐만 아니라 현지 진출을 통해 시장을 확대하고 소재·부품의 해외의존도를 낮출 필요성이 있다.[21]
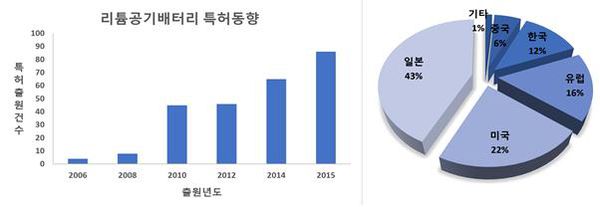
- Fig.4는 LMB 중에서도 리튬공기배터리에 대한 10년(2006년~2015년)간의 자료이다. 2006년과 2015년을 비교하면, 21배 이상 증가한 것으로 보아 차세대 전지에 대한 특허출원이 활발하게 이루어지고 있다. 특히 상용화하기 위한 기술이 특허 출원의 32.1%를 차지한다. 리튬공기배터리는 LIB와 비교하여 안전성과 경제성에서 크게 앞서기 때문에 차세대 배터리의 대표적인 예라고 할 수 있다. 하지만 상용화되기까지 앞으로 몇 년이 걸릴지 알 수 없는 일이다. 충·방전 시 수명이 줄어들고 내구성이 약해지는 차세대 배터리의 단점을 극복하기 위해 추가적인 연구개발이 필요해 보인다.[22]
- 따라서 최근 기술 동향에 따라 전해질 디자인과 배터리 내구성에 집중해보고자 한다.
개발과제의 기대효과
- LMB의 원리와 구조에 대해 이해하고, 성능에 영향을 미치는 덴드라이트의 생성 및 성장 메커니즘을 파악한다. 그다음 덴드라이트를 억제할 수 있는 방안들을 조사하여 덴드라이트 억제에 관한 개념과 원리를 이해한다. 또한 현재 LMB 연구의 방향성에 대해 분석하고, 이를 사례들에 적용하여 현실적인 적용 여부에 대해 고찰할 수 있다.
기술적 기대효과
- 덴드라이트의 억제를 통해 LMB를 안정화시킬 수 있다. 그동안 LMB가 상용화되지 못했던 주원인은 덴드라이트의 성장으로 인해 발생하는 문제들이므로 연구를 통해 덴드라이트의 생성과 성장을 억제시킨다면 LMB의 안정화에 기여할 수 있다.
- 안정화된 LMB가 LIB의 대체재로 사용될 수 있다. 현재의 LIB 기술은 전기 자동차 및 휴대용 전자 장치의 끊임없이 성장하는 에너지 저장 시장의 요구 사항이 증가함에 따라 이론적 에너지 밀도 한계에 접근하고 있다. 덴드라이트의 생성과 성장이 억제된다면 흑연의 10배에 달하는 용량, 높은 에너지 밀도 등의 성능에도 불구하고 그간 화재와 폭발 위험 때문에 사용할 수 없었던 LMB를 사용할 수 있다. 이를 통해 동일한 크기의 고용량 배터리 혹은 배터리 소형화를 구현할 수 있다.
경제적, 사회적 기대 및 파급효과
- LIB의 anode는 흑연으로 리튬 이온의 출입을 가능하게 하지만, 전류 자체를 직접 생산하지 않아 전류 생산에 있어 불필요한 무게를 차지한다고 할 수 있다. LMB는 anode 자체를 리튬으로 만든 것으로, 배터리의 anode를 기기를 작동시킬 수 있는 전류를 생성하기 위한 원자로 채울 수 있다는 것을 의미한다. 그렇기 때문에 LMB는 LIB에 비해 10배 이상 높은 용량을 가져 더 큰 에너지 밀도를 구현할 수 있다. 에너지 밀도가 증가하게 되면 스마트폰, 노트북의 장기 사용뿐만 아니라 장거리 트럭 운송, 장거리 여행 등에서의 배터리 방전 우려를 감소시킬 수 있다. 또한 주행 거리 확대와 충전 속도 증가가 이루어지면, 전기자동차 시장의 더 큰 성장을 이룰 수 있을 것이다.[23]
- 전기자동차 시장이 크게 성장하면서, 이에 사용되는 LIB 또한 많은 사용이 이루어지고 있다. 하지만 배터리에는 수명이 존재하고 이 배터리의 수명이 다하게 되면 폐배터리가 발생하게 된다. 현재 폐배터리의 경제성을 별로 없으며 아직까지 폐배터리의 관리체계가 미흡하다고 한다. 덴드라이트의 위험성을 해결한 LMB가 상용화될 수 있다면, LIB보다 10배 높은 용량으로 더 큰 에너지 밀도의 구현이 가능해지므로 보다 긴 수명의 배터리 사용이 가능해져 이로 인해 폐배터리의 발생도 감소시킬 수 있을 것이다.[24]
- 또한 덴드라이트 위험이 없는 LMB의 상용화가 가능해진다면, 기존 생산 설비에서 큰 변화 없이 양산을 할 수 있으며, anode의 믹싱, 코팅, 프레싱, 슬리팅 등의 공정들이 필요하지 않아 anode의 제조 시간과 설비의 투자비 등의 절감이 이루어질 수 있다. 그리고 LIB에 비해 에너지 밀도 증가로 배터리의 경량화와 대용량화에 적합하다고 할 수 있다.[25]
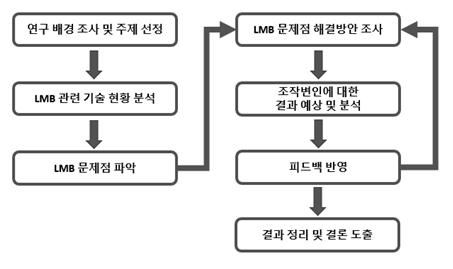
기술개발 일정 및 추진체계
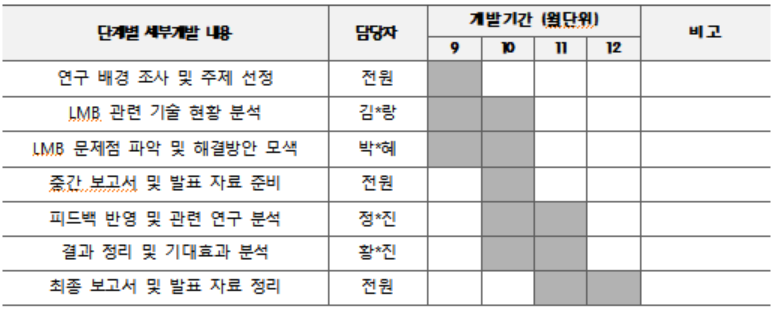
개발 일정
구성원 및 추진체계
- 배터리 관련 논문 조사 및 원리 파악
- LMB 관련 기술 및 특허 현황 분석
- 현재 LMB 기술의 한계 분석
- LMB에서 발생하는 덴드라이트 형성 원인 정리
- 덴드라이트 형성 억제를 위한 선행 연구 조사 및 흐름 파악
- 전해질 첨가제와 전착 조건에 의한 결과 분석
- 분석 결과의 장단점 및 현실적인 적용 여부 확인
- 발표 피드백 반영 및 보완 연구 분석
설계
목표 달성을 위한 설계 방법
LMB 상용화를 목표로 한 덴드라이트 억제 연구 방법에 대해 조사해보고자 한다.
방법 1. 보호막
- 보호막은 전해질과 리튬 금속 사이에 위치하여 반응을 차단시켜 더 균일한 리튬 전착을 유도시키는 역할을 한다. 이러한 보호막은 리튬 이온 전도성, 전자 절연성, 밀착계면의 유지, 불균일한 표면 구조의 변화를 수용할 수 있는 능력의 특징을 갖고 있어야 한다. 이와 같은 요구를 충족시켜야 하기 때문에 연구 난이도가 높다고 할 수 있다.
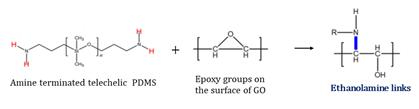
- 폴리머 기반의PDMS(Poly(dimethylsiloxane))/GO(Graphene Oxide) 보호막에 대한 연구를 보면, [26] Fig.6과 같이, PDMS의 말단인 아민기와 GO의 에폭시기는 에탄올 아민 결합을 형성하여 cross-linking된 구조를 만들게 된다. 이런 구조는 보호막의 유연성과 기계적 강도를 증가시키는 역할을 한다. 하지만, PDMS 자체는 이온전도도가 낮아 리튬 이온이 보호막을 통과하여 리튬 금속까지 도달할 수 없다. 따라서 불산으로 PDMS의 에칭 과정을 거쳐 리튬 이온 채널을 형성시켜야 한다. 이때 에칭 시간이 10분 미만이면, 에칭이 제대로 일어나지 않아 리튬 이온이 이동할 수 없게 되고, 10분 이상이면 과도한 에칭으로 보호막이 손상되어 덴드라이트가 더 쉽게 형성된다. 그러므로 10분의 에칭 시간을 통해 적절한 리튬 이온 채널을 형성하여 리튬 이온이 보호막을 통과하되, 덴드라이트를 억제할 수 있게 한다.
방법 2. 마이크로 패터닝
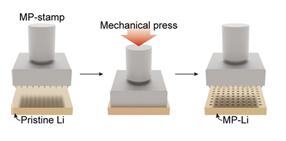
- 마이크로 패터닝은 연성이 높아 변형이 쉬운 리튬 금속의 특성을 이용하여, 마이크로 패터닝된 도장을 금속에 찍어 패턴 구멍에만 리튬을 집중적으로 증착시키는 방법이다. 패턴 구멍에만 리튬의 증착을 유도함으로써 더 균일한 리튬 증착을 관찰할 수 있긴 하지만, 마이크로 패터닝만으로는 덴드라이트 문제를 해결하기 어렵다.
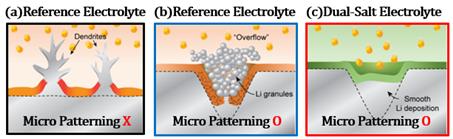
- Fig.8에서 (a)는 기준 전해질과 패터닝하지 않은 금속, (b)는 기준 전해질과 패터닝한 금속, (c)는 듀얼 솔트 전해질과 패터닝한 금속에서의 리튬 증착을 관찰할 수 있다. (a)에서는 덴드라이트가 축적되었고, (b)에서는 패턴 구멍에 데드 리튬의 축적이 일어났으며, (c)에서는 듀얼 솔트 전해질의 영향으로 균일한 리튬 전착이 일어났다. 관련 논문을 보면, 전해질에 LiTFSI와 LiBOB를 추가로 첨가하였을 때, 그렇지 않았을 때보다 배터리의 성능이 증가한 것을 확인할 수 있다. 이는 추가로 첨가한 염들에 의해 폴리카보네이트와 리튬 설포네이트가 포함된 SEI층이 생성되어 이온전도도가 높아져 데드 리튬의 축적을 막아주었기 때문이라고 할 수 있다.[27]
방법 3. 전해질 변화
- 전해질의 성분을 변화시켜 주는 방법도 있다. 관련 논문에 따르면, [28] Fig. 9의 SEM 사진을 보았을 때, PC 용매에 비해 ether 용매를 사용한 경우에 평평한 리튬 증착이 일어나는 것을 볼 수 있다. 여기서 전해질은 DX(Dioxane)-DME(Dimethoxyethane) 기반 용매에 LiFSI 염을 사용하였다. 평평한 리튬 증착이 일어난 이유는 DME의 LiFSI에 대한 높은 용해도와 DX의 넓은 electrochemical window로 인한 것이라고 판단하였다.
- 먼저, DME에서 두 개의 산소가 리간드로 작용하여 킬레이트 효과로 인해 리튬 이온과 DME의 배위결합을 통하여 보다 안정한 구조를 이룬다. 이는 LiFSI에 대한 용해도가 증가하는 것으로, FSI 음이온이 많이 생성된다. 또한, 용매에 DX를 첨가하였을 때 전해질의 electrochemical window가 증가하는 것을 그래프를 통해 확인할 수 있었다. 증가된 electrochemical window는 용매와 리튬 금속 간의 반응성이 낮아지게 되는 것을 의미하며, 많이 생성된 FSI 음이온이 리튬 금속과 반응하여 LiF가 풍부한 SEI층이 생성된다. LiF가 풍부한 SEI층은 표면 확산 장벽에너지가 낮아 리튬 이온이 원활하게 확산되어 평평한 리튬 이온이 증착되는 것이라고 판단하였다.
-지금까지 인공적인 보호막을 만드는 방법, 리튬 금속을 패터닝함으로써 리튬의 증착을 집중시키는 방법, 전해질의 변화를 통해 균일한 리튬 증착을 유도시키는 방법 총 3가지를 살펴보았다. 이후부터는 심도 깊은 리뷰를 위해 전해질 분야 중 첨가제 파트에 집중해보기로 하였다. 리튬메탈배터리의 안정성 보완하기 위한 염, 용매 변화 등 효과적인 솔루션들이 개발되었지만, 여전히 첨가제와 리튬염은 끊임없이 소모되고, SEI층 구조와 구성은 불가피하게 변화를 겪는다. 따라서 첨가제의 소모없이 쉴드를 만들어 리튬의 증착을 막는 SHES 메커니즘과 인공적으로 SEI층을 만들어 구조의 부피변화를 최소화할 수 있는 rich LiF layer 방법을 선택하여 덴드라이트를 억제시키는 논문 리뷰를 진행했다.
방법 4. Self-healing electrostatic shield mechanism (SHES mechanism)
- CsPF6 첨가제
리튬의 표준환원전위는 -3.04V, 세슘의 표준환원전위는 –3.026V이지만 네른스트식에 의하면 물질의 농도에 따라 환원전위가 변화한다.
- 물질의 농도가 매우 작을 때 활성도 a는 물질의 농도와 같게 볼 수 있으므로 세슘을 매우 소량 첨가할 경우, 위 식에 R= 8.314J/mol⦁K, T= 296K, n= 1mol, F=96485C를 적용한 후 세슘의 농도를 대입하면 Table1과 같이 세슘의 환원전위가 리튬보다 더 낮아질 수 있다.
convert: Image height exceeds user limit in IHDR `/var/www/capstone/ce/images/1/11/Table1.PNG' @ warning/png.c/MagickPNGWarningHandler/1672.
convert: Invalid IHDR data `/var/www/capstone/ce/images/1/11/Table1.PNG' @ error/png.c/MagickPNGErrorHandler/1646.
convert: corrupt image `/var/www/capstone/ce/images/1/11/Table1.PNG' @ error/png.c/ReadPNGImage/4095.
convert: no images defined `/tmp/transform_2702b21606f1.png' @ error/convert.c/ConvertImageCommand/3210.
Error code: 1
- 따라서 세슘과 리튬의 환원전위 사이값의 전압을 배터리에 걸어주면, Fig.10과 같은 SHES 메커니즘이 진행된다.먼저 소량을 첨가함으로써 리튬보다 더 낮은 환원전위를 가지는 세슘 이온은 리튬 팁에 달라붙어 환원되지 않고 electrostatic shield를 형성한다. [29]
- 세슘 이온이 리튬 이온보다 리튬 팁으로 먼저 접근하는 주된 이유는 용해도 차이로 생각할 수 있다. 일반적으로 물질의 분자량이 클수록 확산 속도는 느려지지만 세슘의 solvation number는 1.6으로, 3.4인 리튬보다 낮아서 용매와의 상호작용이 덜 일어나기 때문에 확산속도와 이온 이동성이 더 높다. 따라서 이동 속도가 더 큰 세슘 이온이 리튬 이온의 이동 통로를 막아주며 anode의 리튬 팁에 흡착되는 것이다. 흡착된 세슘 이온이 생성한 electrostatic shield와 리튬 이온은 (+)전하를 띠기 때문에 리튬 팁으로 접근한 리튬 이온은 척력에 의해 튕겨나가 팁이 아닌 평평한 부분에 증착된다. 이렇게 SHES mechanism은 첨가제를 소량 첨가함으로써 첨가제의 환원전위에 변화를 주어 (+)전하를 띠는 electrostatic shield를 형성한 후 팁으로 접근하는 리튬을 막아주어 평평한 리튬 증착을 유도한다.
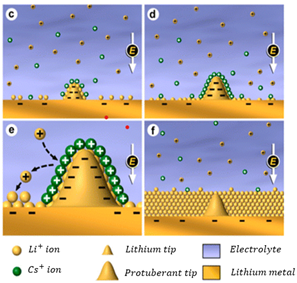
- 1가 양이온 중 루비듐과 칼륨 또한 쉴드를 형성하여 세슘과 동일한 역할을 수행한다. 하지만 환원전위가 세슘이 루비듐과 칼륨보다 더 낮아 덴드라이트의 성장 억제 효과는 세슘이 더 높을 것이라고 생각된다.[30,31]
- AlCl3 첨가제
- 알루미늄의 표준환원전위는 -1.660V로, 알루미늄을 매우 소량 첨가하더라도 리튬의 표준환원전위보다 낮아질 수 없다. 하지만 알루미늄도 SHES mechanism의 진행이 가능하다. 먼저 가수분해 반응으로 용매에 잔류하는 H2O와 Al3+가 반응하여 Al(OH)3입자가 만들어지는데 이 입자는 콜로이드 입자로, excess 알루미늄 이온을 끌어당겨 (+)로 전가된 Positively Charge Colloidal Particles(PCCP) 형태를 이룬다. PCCP는 Al(OH)3에 알루미늄이 붙은 벌키한 구조이기 때문에 입체 방해를 일으킬 뿐만 아니라 (+)전하에 의한 전하 방해로 리튬 이온이 리튬 팁으로 접근하는 것을 막아주는 역할을 한다. 아래의 Fig.13의 SEM 사진처럼 알루미늄과 같은 3가 양이온을 이용해서도 덴드라이트를 억제할 수 있다.[33]
방법 5. Rich LiF layer
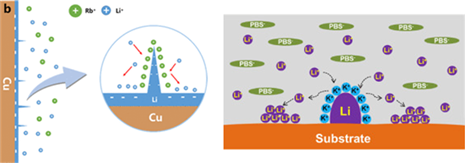
- NH4HF2첨가제[34]
NH4HF2+Li→NH4+LiF+H2, △G=-200.01eV
위의 반응식과 같이 를 첨가할 경우, 는 리튬 금속과 자발적인 반응을 통해 LiF SEI층과 수소 기체를 생성한다. LiF가 풍부한 SEI층에서는 오른쪽의 Fig.14와 같이 평평한 리튬 증착이 일어난다. 이러한 이유는 세 가지로 나눌 수 있다.
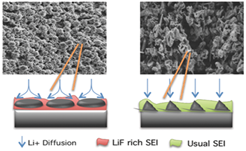
- ① Porous LiF-rich SEI layer by H2
위의 반응식에서 발생한 수소 기체에 의해 아래의 Fig.15처럼[35] LiF층에 pore가 생성되는데, 이러한 SEI층의 pore는 리튬이 증착할 수 있는 공간을 제공해주어 특정 부분에만 리튬이 증착되지 않고, pore가 없는 SEI층에 비해 덴드라이트의 형성이 감소되는 효과를 가져온다. 따라서 porous LiF-rich SEI층은 리튬이 평평하게 증착할 수 있는 공간을 제공해주고 리튬 증착 과정에서의 부피 변형을 잘 수용할 수 있으며, pore로 인해 SEI층의 표면적이 증가하여 국부적인 전류 밀도를 감소시켜 덴드라이트 형성을 억제시킬 수 있다.
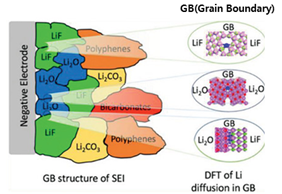
- ② Grain Boundary[36]
Fig.16에서 내부 SEI층을 구성하는 무기 성분들 간의 그레인 바운더리를 보면 Li2O- Li2O, Li2O-LiF 사이의 그레인 바운더리에 비해 LiF-LiF 사이의 그레인 바운더리가 가장 넓은 것을 확인할 수 있다. 리튬 이온은 그레인 바운더리를 통해 이동하기 때문에 그레인 바운더리가 가장 넓은 LiF-LiF 사이를 통과할 때 확산속도가 가장 빨라진다. 이온전도도가 높을수록 실제 적용에 필요한 장기 사이클링 안정성을 가질 수 있기 때문에 실제로 이온전도도가 높은 재료, 용매, 등을 선택하는 것도 중요한 문제가 된다. 따라서 SEI층은 높은 이온전도도로 리튬 이온만 통과시켜 전지가 안정적으로 가동되게 해야 하는데 rich-LiF SEI층이 이 역할을 수행하고 있다.
-③ Surface diffusion barrier energy[37]
Density Functional Theory(DFT, 초기밀도기능 이론)를 통해 SEI층의 활성화 에너지를 구한 결과, LiF는 0.19 eV의 낮은 표면 확산 장벽 에너지를 가져 표면에서 리튬 이온이 원활하게 확산되어 평평하게 리튬 이온이 증착된다. 같은 조건에서 Li2O는 0.32 eV, Li2CO3는 0.23 eV의 표면 확산 장벽 에너지를 가지는데, Li2CO3와 LiF는 0.04 eV의 에너지 차이가 나지만 확산 속도는 30배 이상의 차이를 보였다. 따라서 천연 SEI층 성분인 Li2CO3와 비교할 때, LiF는 낮은 표면 확산 장벽으로 인해 덴드라이트가 없는 표면을 만드는 데 유리하다.
- LiF층의 세 가지 장점을 모으면 결과적으로 porous LiF층으로 인해 리튬 증착이 가능한 공간이 제공되고 LiF층의 빠른 이온 확산 속도와 낮은 표면 확산 장벽 에너지로 평평한 리튬 증착이 가능해진다.
결과 및 평가
완료 작품의 소개
과제 핵심 결과
- 보호막의 경우는 연구 개발의 난이도가 높고, 크랙이 생겨 부서질 가능성이 크다. 두 번째, 마이크로 패터닝의 경우 패턴을 새기는 추가 공정으로 인해 비용이 발생하고, 리튬 이온의 공급이 원활하지 않으면 패턴 구멍이 아닌 부분에 리튬 증착이 일어나는 부작용으로 제약이 크다. 마지막으로 전해질은 온도와 압력 등 다양한 조건을 고려해야 하며 고농도 전해질을 사용하면 점도가 증가할 수 있다. 하지만 전해질은 SEI층을 형성하는 가장 중요한 역할을 하며 실현가능성이 높고 추가 공정이 필요하지 않다.
- 전해질 종류와 첨가제 조성 조절만으로 안정한 SEI층을 형성할 수 있어 전해질을 조절하는 솔루션에 집중하였고, SHES 방법과 LiF가 풍부한 SEI층의 장단점을 분석해보았다. 첫째로 SHES 방법의 단점은 세슘 이온의 농도 제한으로 높은 전류밀도에서는 빠르게 성장하는 덴드라이트 팁을 효과적으로 커버할 세슘 이온의 양이 충분하지 않다는 것이다. 또한, 리튬과 세슘의 환원전위 차가 0.063V로 매우 작기 때문에 전류 밀도가 증가하면 셀의 전압 강하가 증가하여 SHES 메커니즘 효과가 떨어질 수 있다. 하지만 장점은 첨가제가 소모되지 않기 때문에 시간이 지나도 첨가제의 농도가 변하지 않는다. 그리고 쉴드로 인해 전해질과 직접적인 접촉을 막아주어 부반응을 줄일 수 있을 뿐 아니라 이미 성장한 덴드라이트를 완화하는 데도 효과적이다.
- 두 번째 LiF가 풍부한 SEI층은 LiF 층을 만드는 데에 첨가제가 소모되므로, 시간이 지날수록 효과는 감소된다. 또한 첨가제와 리튬 금속이 반응하여 배터리의 용량을 결정하는 리튬이 소모되므로 배터리의 용량 손실을 초래한다. 하지만, 이는 덴드라이트를 억제할 수 있는 SEI 층의 구조를 변화시키는 가장 근본적인 방법이다. 또한 첨가제인 NH4HF2는 다른 불소공급원에 비해 높은 용해도와 비용이 저렴하여 큰 장점이 될 수 있다고 분석하였다.
- 따라서 첨가제의 소모없이 쉴드를 만들어 리튬의 증착을 막는 SHES 메커니즘과 전기 화학적으로 인공적으로 SEI층을 만들어 구조의 부피 변화를 최소화할 수 있는 rich LiF layer 방법을 선택하여 장단점을 분석하면서 덴드라이트에 대한 첨가제의 영향을 깊이 있게 분석할 수 있었다.
포스터
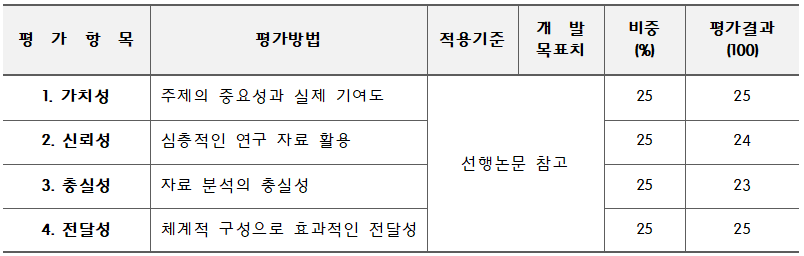
완료작품의 평가
향후계획
- ‘친환경차’=’전기차’라는 공식이 성립되면서 전기차의 전성시대가 도래하고 있다. 전기차의 시장 전망이 밝을 것으로 예상되면서 전기차의 심장인 배터리를 둘러싼 관심이 뜨겁고, 전 세계가 전기차 배터리 전쟁 중이라고 해도 과언이 아니다. 리튬금속 기반의 신형 배터리를 이용하면 내연기관 차량만큼 저렴하고 편리한 전기차 생산이 가능하다.
- 차세대 배터리 산업 분야에서 3대 스타트업 중 하나로 꼽히는 미국의 SES가 107Ah 이상의 용량을 가진 리튬메탈배터리로 ‘아폴로’를 공개했다. SES 창업자 겸 CEO 치차오 후는 “세계 최초로 제작된 대용량 리튬메탈베터리를 한국에서 개발하고 시제품을 생산할 것”이라 밝히고 SK, 현대차 배터리 기업과 협력관계도 맺었다.[38]
- 국내 배터리 3사(LG에너지솔루션·SK온·삼성SDI)는 전고체 배터리 연구개발에 주력하며 오는 2027년 전후로 전고체 배터리를 상용화한다는 계획이다. LG에너지솔루션은 지난달 전고체 배터리 상온 충전 기술 개발에 성공하는 성과를 거두고 오는 2027년 이후 상용화를 계획하고 있다. SK온은 솔리드파워에 3000만달러(약 353억원)를 투자해 전고체 배터리 공동 개발을 추진하며 2030년 이전 상용화를 목표하고 있다. 삼성SDI는 자체 개발 프로젝트와 함께 삼성전자 종합기술원, 일본연구소 등과 협업해 전고체 기술을 공동 개발, 2027년 전고체 배터리를 양산할 계획이다.[39]
- 개발 과제 핵심 결과에서 언급한 단점들로 인해 리튬메탈배터리의 상용화 시점이 늦춰지고 있다. 덴드라이트를 완벽하게 컨트롤하지 못한다면 쿨롱 효율 감소 및 폭발 가능성 증가로 실질적인 사용이 불가능하기 때문이다. 최근에는 이를 해결하기 위한 방안으로 All solid state battery(ASSB)가 대두되었는데, 황화물계 고체 전해질(SSE, Sulfide solid electrolytes)을 기반으로 Ag-C nanocomposite layer를 적용한 LMB 개발을 추진 중에 있다. 이 LMB는 부피 감소에 효과적이며, 고체 전해질 사용에도 불구하고 이온전도도가 액체 전해질에 비해 떨어지지 않고, SSE에 의해서 리튬이 균일하게 증착된다는 장점이 있다. 따라서 이와 같은 ASSB의 연구가 활발히 진행된다면, LMB의 고질적인 덴드라이트 문제점을 해결하여 상용화될 수 있을 것이다.[40]
참고 문헌
[1] 유승호. "[신진연구자 칼럼] 안정한 리튬금속음극 개발." News & Information for Chemical Engineers 38.2 (2020): 201-205.
[2] "한국 대기업 손잡은 SES '리튬메탈 배터리 2025년 상용화', 연합뉴스, 2021-07-21, https://www.yna.co.kr/view/AKR20210721103100003.
[3] 김희탁. "[기획특집: 에너지/환경 분리막 기술] 차세대 리튬금속음극 보호막 기술동향." Korean Industrial Chemistry News 21.6 (2018): 17-18.
[4] Dan, L. et al. “Constructing multifunctional solid electrolyte interface via in-situ polymerization for dendrite-free and low N/P ratio lithium metal batteries” Nature Communications 12, 186. (2021).
[5] Lianbo, M. et al. “Dendrite-free lithium metal and sodium metal batteries” Energy Storage Materials, 27 (2020): 522-554.
[6] Yao, Z. et al. “Hierarchical Cu fibers induced Li uniform nucleation for dendrite-free lithium metal anode“ Chemical Engineering Journal 392. (2020).
[7] Woo Hyeong Sim and Hyung Mo Jeong. “Efficient Lithium Growth Control from Ordered Nitrogen-Chelated Lithium-Ion for High Performance Lithium Metal Batteries” ADVANCED SCIENCE. (2021).
[8] Yan, Kai, et al. "Selective deposition and stable encapsulation of lithium through heterogeneous seeded growth." Nature Energy 1.3 (2016): 1-8.
[9] Wang, Aiping, et al. "Review on modeling of the anode solid electrolyte interphase (SEI) for lithium-ion batteries." npj Computational Materials 4.1 (2018): 1-26.
[10] Fan, Lei, et al. "Recent progress of the solid‐state electrolytes for high‐energy metal‐based batteries." Advanced Energy Materials 8.11 (2018): 1702657.
[11] 이상현,석도형,정요한,and 손희상. "PDMS/GO 복합체 박막의 리튬 금속 표면 개질: 리튬전극의 성장 제어 및 리튬금속전지(LMB) 성능 향상." 멤브레인 30.1 (2020): 38-45.
[12] Zheng, Z. et al. “Three–dimensional fiber network reinforced polymer electrolyte for dendrite–free all–solid–state lithium metal batteries” Energy Storage Materials 41. (2021): 631-64.
[13] Kim, Mun Sek, et al. "Langmuir–Blodgett artificial solid-electrolyte interphases for practical lithium metal batteries." Nature Energy 3.10 (2018): 889-898.
[14] 진다희, 박주남, Cyril Bubu Dzakpasu, 윤별희, 유명현, 이용민 "미세 패턴화된 리튬금속 전극의 Vinylene Carbonate 첨가제 도입에 따른 전기화학 특성에 관한 연구" 전기화학회지 22.2 pp.69-78 (2019) : 69.
[15] "리튬이온전지 이을 차세대 전지는... ‘전고체전지’ 유력", Zum 뉴스, 2017-01-21, https://m.news.zum.com/articles/35619278.
[16] 「리튬이차전지 소재 기술동향」, 『S&T Market Roport』, 제62호(2018), 과학기술일자리진흥원, 12-19.
[17] Cornell University. Dendrite Inhibition Electrolytes for Metal-based Batteries. US Patent 15128635, filed May 24, 2015, and issued May 2, 2021.
[18] 주식회사 엘지화학. 리튬 금속 전지용 전해질 및 이를 포함하는 리튬 금속 전지. 특허 출원번호 10-2018-0071136, 출원일 2018년 06월 21일.
[19] 주식회사 엘지에너지솔루션. 고체 전해질 막 및 이를 포함하는 전고체 전지. 특허 출원번호 10-2020-0003691, 출원일 2020년 7월 20일.
[20] 오야마 노보루. 폴리머 전해질. 특허 출원번호 10-2000-0013697, 출원일 2000년 3월 17일, 출원일 2001년 1월 26일.
[21] 「2030 이차전지 산업 발전 전략」, 과학기술인재정책 플랫폼 (2021), 3-6.
[22] "'폭발 위험' 리튬이온 대체 '금속공기'전지…언제쯤 나올까", 머니투데이, 2016-10-13, https://news.mt.co.kr/mtview.php?no=2016101216203580283.
[23] “리튬금속 배터리, 전기차 전환 앞당긴다”, MIT Technology Review, 2021-3-10, https://www.technologyreview.kr/lithium-metal-batteries-electric-vehicle-car/.
[24] “전기차 증가만큼 발생하는 폐배터리 ‘어찌 하오리까’”, AEM, 2018-5, https://www.autoelectronics.co.kr/article/articleView.asp?idx=2757.
[25] “이엔플러스, 차세대 경량화 고효율 2차 전지 핵심 기술 확보”, 매일경제, 2020-6-25, https://www.mk.co.kr/news/stock/view/2020/06/651706/.
[26] Ha, Heonjoo, et al. "Gas permeation and selectivity of poly (dimethylsiloxane)/graphene oxide composite elastomer membranes." Journal of Membrane Science 518 (2016): 131-140.
[27] Yoon, Byeolhee, et al. "High-rate cycling of lithium-metal batteries enabled by dual-salt electrolyte-assisted micropatterned interfaces." ACS applied materials & interfaces 11.35 (2019): 31777-31785.
[28] Miao, Rongrong, et al. "A new ether-based electrolyte for dendrite-free lithium-metal based rechargeable batteries." Scientific reports 6.1 (2016): 1-9.
[29] Ding, Fei, et al. "Dendrite-free lithium deposition via self-healing electrostatic shield mechanism." Journal of the American Chemical Society 135.11 (2013): 4450-4456.
[30] Li, Shaopeng, et al. "RbF as a dendrite-inhibiting additive in lithium metal batteries." ACS applied materials & interfaces 11.23 (2019): 20804-20811.
[30] Li, Shaopeng, et al. "RbF as a dendrite-inhibiting additive in lithium metal batteries." ACS applied materials & interfaces 11.23 (2019): 20804-20811.
[31] Wang, Dongdong, et al. "A long-lasting dual-function electrolyte additive for stable lithium metal batteries." Nano Energy 75 (2020): 104889.
[32] Li, Lulu, Huichao Dai, and Chengliang Wang. "Electrolyte additives: Adding the stability of lithium metal anodes." Nano Select 2.1 (2021): 16-36.
[33] Ye, Huan, et al. "Synergism of Al-containing solid electrolyte interphase layer and Al-based colloidal particles for stable lithium anode." Nano Energy 36 (2017): 411-417.
[34] Yuan, Yanxia, et al. "Regulating Li deposition by constructing LiF-rich host for dendrite-free lithium metal anode." Energy Storage Materials 16 (2019): 411-418.
[35] Wu, Qingping, et al. "Oxygen-defect-rich coating with nanoporous texture as both anode host and artificial SEI for dendrite-mitigated lithium-metal batteries." Journal of Materials Chemistry A 9.9 (2021): 5606-5618.
[36] Tan, Jian, et al. "A Growing Appreciation for the Role of LiF in the Solid Electrolyte Interphase." Advanced Energy Materials 11.16 (2021): 2100046.
[37] Choudhury, Snehashis, and Lynden A. Archer. "Lithium fluoride additives for stable cycling of lithium batteries at high current densities." Advanced Electronic Materials 2.2 (2016): 1500246.
[38] “美SES "한번에 700㎞ 주행 차세대 배터리, 韓서 생산", 중앙일보, 2012-11-04, https://www.joongang.co.kr/article/25021052#home.
[39] “전기차 배터리 시장 동향과 전망”, TECHWORLD, 2021-11-01, https://www.epnc.co.kr/news/articleView.html?idxno=216214.
[40] Lee, Yong-Gun, et al. "High-energy long-cycling all-solid-state lithium metal batteries enabled by silver–carbon composite anodes." Nature Energy 5.4 (2020): 299-308.