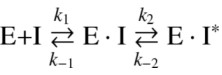RNA만들조
프로젝트 개요
기술개발 과제
국문 : m6A modification을 이용한 circRNA치료제 개발 가능성 탐구
영문 : Studying the possibility of developing a new circular RNA therapeutics through m6A modification
과제 팀명
RNA만들조
지도교수
이종범 교수님
개발기간
2021년 9월 ~ 2021년 12월 (총 4개월)
구성원 소개
서울시립대학교 생명과학과 20165600** 홍*기(팀장)
서울시립대학교 화학공학과 20143400** 이*용
서울시립대학교 화학공학과 20153400** 김*호
서울시립대학교 화학공학과 20173400** 이*경
서울시립대학교 생명과학과 20185600** 안*환
서론
개발 과제의 개요
개발 과제 요약
1. circular RNA(이하 circRNA)의 생체 내 작용 메커니즘 파악
- RNA는 구조적으로 3’ end의 2번 탄소에 -OH group이 존재해 불안정한 성질이 있다. 이로 인해 세포 내부에서 exonuclease라는 분해효소에 의해 RNA는 쉽게 분해된다. 어떤 물질을 백신 및 치료제로 사용하기 위해서는 물질의 안정성을 높여 세포까지 안전하게 전달하는 것이 중요하다. 따라서 이러한 exonuclease의 작용 부위를 제거하여 RNA의 안정성을 높이는 한 방법인 circRNA에 대해 조사를 실시한다
2. circRNA의 치료제 개발 및 관련 기술 현황 리뷰 논문을 작성
3. circRNA를 이용한 치료제의 안정성과 효율성을 높이기 위한 방법 조사
- 치료제로서의 기능을 위해서는 생체 내 안정성과 전달 효율성이 중요하다. 따라서 안정성을 높이기 위해 RNA의 구조를 화학적으로 변형을 시키는 Chemical Modification에 대해 조사하고 전달 효율을 올리기 위해 RNA 외부에 별도의 전달체를 만드는 DDS(Drug Delivery System)에 대해 분석한다.
개발 과제의 배경
1. 코로나 19로 인한 RNA 백신 관심 급등
- 기존의 백신과 달리 RNA 백신은 신속한 항체 생성을 유도할 수 있다. 또한 면역반응이 일어난 후 쉽게 제거될 수 있는 성질이 있다. 특히 이번 팬데믹 상황에서 각광받고 있는 기술이며, 또한 최근 RNAi를 이용한 질병의 치료에도 관심이 쏟아지고 있다. 이번 탐구를 통해 현재 개발되는 circRNA 분야를 탐색한다.
2. 콜드체인 시스템이 필수인 기존 RNA 백신 공급 한계 극복
- RNA는 구조적 특징으로 인해 쉽게 분해되는 성질이 있다. 따라서 RNA를 이용한 백신을 유통하는 과정에서 콜드체인시스템이 필요하다. 하지만 이를 준비한 국가는 소수이며 특히 개발도상국에서는 구축하는 것이 불가능한 시스템이다. RNA의 안정성을 높인 circRNA를 이용해 백신을 제조하면 콜드체인시스템을 활용하지 않고도 유통할 수 있을 것이라 기대한다.
3. circRNA를 이용한 기존 질병의 새로운 진단 및 치료제 개발 가능성 제시
개발 과제의 목표 및 내용
- circRNA를 이용하여 기존 치료제가 없는 질병에 대한 치료법을 개발하기 위해선, 작용 매커니즘, 기존까지의 연구기술 현황 등의 자료수집이 필요하므로 그에 대한 문헌조사를 선행할 예정이다.
- circRNA를 이용한 치료법 개발에 성공할 경우 그 치료제를 대량생산하는 공정이 필수적으로 뒤따라야하기 때문에 circRNA 치료제를 대량생산하는 공정에 대해서도 연구를 진행하는 것이 목표이다.
- RNA 는 구조적으로 매우 불안정한 물질로서, 표적세포까지 잘 전달되기 위해선 그 안정성을 높이는 연구가 필요하다. Polymer와 chemical modification을 이용한 RNA 치료제의 안정성 향상 방법에 관한 연구도 진행할 예정이다.
- 표적세포까지의 안전한 약물 전달을 위한 DDS(Drug Delivery System) 매커니즘을 이해한다.
관련 기술의 현황
관련 기술의 현황 및 분석(State of art)
*백신
1. Function as vaccine adjuvants to induce anti-tumor immunity
- 종양백신이 종양관련 항원을 통해 종양특이적 면역반응을 활성화하여 암세포가 사멸하는 기술이 널리 적용되어있다. 최근 연구는 unmodified foreign circRNAs가 antigen-specific T and B cell activation, antibody production, and anti-tumor immunity를 유도하는 보조제로 쓰일 수 있음을 연구하였다.
*치료제
1. lncRNA/circRNA‑miRNA‑mRNA ceRNA network in lumbar intervertebral disc degeneration (척추에서 발생하는 추간판변성에 관여하는 RNA 네트워크)
- Intervertebral disc degeneration(이하 IDD)의 발생에 비암호화 RNA가 관여한다는 증거는 꾸준히 축적되어 왔다. 추간원판수핵 세포의 과다한 세포자멸사와 세포외 기질의 저하로 인해 척추가 손상되는데, 현재 이루어지는 치료법인 척추융합술이나 디스크 대체물 등은 일시적인 고통을 덜어줄 뿐이다. 따라서 RNA와 관련된 좀 더 효율적인 전략이 필요하다. 최근에는 miRNA, lncRNA, circRNA와 같은 비암호화 RNA가 세포의 증식과 사멸을 포함한 여러 생물학적 과정에서 중요한 역할을 한다는 것이 발견되고 있다. 현재는 작은 표본을 통한 선별 연구밖에 이루어지지 않았지만 향후에는 체외, 체내 실험을 통해 IDD의 발현 패턴과 RNA간 상호작용을 밝혀낼 수 있을 것으로 기대된다.
2. Extracellular Vesicle–Mediated Delivery of Circular RNA SCMH1 Promotes Functional Recovery in Rodent and Nonhuman Primate Ischemic Stroke Model
- 논문을 통해 circSCMH1이 뇌졸중을 앓는 개체의 회복에 도움을 준다는 것을 알 수 있다. 아마 그 방법으로는 circRNA의 기능에 있는데. circRNA의 기능 중 하나는 transcription factor에 결합하는 것이다. MeCP2(methyl-CpG binding protein 2)에 결합해 MeCP2가 타겟으로하는 gene의 발현을 억제하기에 뇌졸중 치료가 가능할 것이다.
3. Lipid nanoparticles for mRNA delivery
- 치료제로 사용할 물질을 target cell로 안전하게 이동시키는 것이 중요하다. COVID-19 치료제 및 백신으로 이용하기 위한 약물전달 방식을 circRNA에도 적용할 수 있을 것이다. 이 논문은 기존 mRNA 백신 및 치료제를 target cell에 전달하기 위해 lipid barrier에 관해 설명한다. Cationic lipids, Ionizable lipids 등 다양한 구조를 활용해 cell의 내막과 외막을 돌파하는 vesicle을 이용한다.
4. Advances in Controlled Drug Release Technology
- 약물의 전달만큼 중요한 것이 체내 약물 농도를 적정수준으로 유지하는 것이다. 위 강의를 통해 현재 약물을 세포 내부로 전달하기 위한 방법을 알 수 있다. 약물을 한번 주입할 경우 drug level이 감소해 주기적으로 약물을 투여해야한다. 이를 보완하기 위해 다양한 기술이 나왔다. 하지만 궁극적으로 우리는 약물의 농도를 desired range에 맞게 설정하는 기술이 필요하며 이를 controlled release라고 한다. 강의에서는 이와 관련된 Drug delivery technology의 원리를 알 수 있다. Controlled Release의 원리는 크게 네가지가 있다. 확산을 이용한 Diffusion, 반응을 유도하는 Chemical reaction, solvent에 녹이는 solvent controlled Release 마지막으로 외부에서 drug의 농도를 조절하는 Controlled Release가 있다.
*진단
1. Extracellular Vesicle–Mediated Delivery of Circular RNA SCMH1 Promotes Functional Recovery in Rodent and Nonhuman Primate Ischemic Stroke Model
- 현재 휴대용으로 사용할 수 있는 진단키트의 개발은 없다. 하지만 circRNA는 진단의학적으로 사용될 수 있는데, 대표적으로 뇌졸중이다. circSCMH1을 영장류 및 마우스 모델에서 실험을 진행한 결과 뇌졸중을 앓는 경우 혈액에서 circSCMH1의 양이 급격하게 감소하는 것을 확인할 수 있다. 이 때, circRNA의 전달 방식은 rabies virus glycoprotein-circSCMH1-extracellular vesicle을 뇌로 전달하는 것으로 보인다. 이후 Nissle 염색을 통해 혈관이 얼마나 막혀있는지 관찰을 실시한다.
2. Recent Advances in the Potential Use of Circular RNA for the Diagnosis and Treatment of Pancreatic Cancer
- 췌장암은 이전까지 빠른 진단이 어려워 사망하는 경우가 대부분이다. 즉 췌장암 증상이 나타난 경우는 이미 진행된 병기에 해당한다. 따라서 조기 진단을 통해 췌장암 환자의 생존율을 높이는 것이 핵심이다. circRNA를 활용해 진단을 시행할 경우 CT 및 MRI 같은 기구를 사용하지 않고 암의 유무를 판단할 수 있다.
시장상황에 대한 분석
*경쟁제품 조사 비교
1. 백신
1. US20210069310A1, ENDOGENOUS TUMOR-DERIVED CIRCULAR RNA AND PROTEINS THEREOF FOR USE AS VACCINE (내재적 종양 유래 circRNA와 단백질의 백신으로서의 사용) : 미국, 출원번호; 16960280 (2018.12.27)
- 이 특허는 질병예방과 암 치료에서의 백신사용에 관련된 것으로, tumor-derived circRNA와 단백질 발현에 대해 연구하였다.
2. 치료제
1. WO2021128516A1, Application of circrna pvt1 and peptide in tumor growth prediction, metastasis prediction, prognostic assessment and treatment
- PVT1 Circular RNA와 PVT1 단백질을 종양의 성장 예측, 전이 예측, 예후 평가와 치료에 이용한다. 비소세포폐암 세포(NSCLC)에서 circ PVT1이 과발현 된다는 현상을 발견했다. 이를 통해 circPVT1의 Knock-down으로 NSCLC 세포의 증식을 억제하고 사멸을 유도함을 입증했다. 또한 circPVT1이 miR-497에 경쟁적으로 작용하며 NSCLC 세포의 Bcl-2 발현을 간접적으로 조절한다는 것을 밝혔다. 이는 miR-497을 억제했을 때 NSCLC의 circPVT1 knock-down이 일어나지 않는 것으로 증명했다. 결론적으로 circPVT1이 NSCLC에서 종양 유전자로서 작용하는 것을 확인했으며, 이는 circPVT1이 NSCLC 환자에 대한 유망한 치료 자료로 활용될 수 있음을 의미한다.
2. CN109593760A, CircRNA relevant to tumour cell MTX drug resistance and its in reversing tumor cell to the application in MTX drug resistance
- Circular RNA가 종양세포의 면억억제제 내성과 관련있으며, 이와 관련있는 circular RNA를 이용해 역으로 생체 내의 면역억제제 내성을 조절한다. 골육종(OS)세포에서 hsa_circ_0000073이 과발현되는 현상을 발견했다. hsa_circ의 과발현은 종양의 전이 확산, 전이 뿐만아니라 MTX(면역억제제)내성을 강화시킨다. 반대로 hsa_circ의 knock-down으로 MTX 내성을 약화시키는 것을 확인했다. 이 현상은 OS 세포에서 miR-145-5p와 miR-151-3p를 표적으로해 NRAS 발현을 증가시는 과정으로 발생한다. 또한 hsa_circ에 의한 OS의 진행은 miR-145-5p와 miR-151-3p 매개의 NRAS 억제에 의해 중단되는 것을 확인했다. 결론적으로, OS세포의 MTX 내성은 hsa_circ_0000073를 통한 miR-145-5p와 miR-151-3p 연관 NRAS downregulation으로 조절할 수 있다. 연구 결과를 활용해 OS 세포 뿐만이 아닌 다른 종양세포의 치료를 위한 MTX 내성 조절에도 이용할 수 있을 것으로 기대된다.
3. 진단
1. US20180282809A1, A METHOD FOR DIAGNOSING A DISEASE BY DETECTION OF circRNA IN BODILY FLUIDS (체액에서 circRNA의 검출에 의해 질병을 진단하기 위한 방법) : 미국, 출원번호; 15763870 (2016.09.29) [7]
- 체액 내의 circRNA의 존재 여부로 대상의 질병을 진단하는 방법. 특히 퇴행성 뇌신경질환인 알츠하이머에 대한 진단 방법이다. 피험자의 체액 내의 하나 이상의 circRNA의 존재 여부로 질병을 진단하는 방법이다. 특히 퇴행성 뇌신경질환인 알츠하이머에 대한 진단 방법으로, 대조군과 비교하였을 때의 피험자의 체액 내의 circRNA 양 수준에 따라 질병의 유무를 진단할 수 있다. 이러한 진단은 신경퇴행성 질환의 biomarker로써의 circRNA와 이러한 circRNA의 head to tail arrangement의 exon-exon junction을 탐지하는 핵산 probe으로 구성된 array를 이용한다.
2. US20210079474A1, CIRCULAR RNAS FOR THE DIAGNOSIS AND TREATMENT OF BRAIN DISORDERS (뇌 장애의 진단과 처리를 위한 원형의 RNA) : 미국, 출원번호; 17050285 (2019.04.25) [8]
- 자폐증, 아스퍼거 증후군, ASD, 조울증, 조현병 등의 뇌와 신경계 장애를 포함한 정신과 질환을 circRNA를 이용하여 진단하는 방법이다. 여러 종류의 circRNA의 발현은 뇌 관련 질환과 연관이 있다. circRNA는 뇌 질환의 식별, 진단, 선별, 치료 및 모니터링에 유용하다. 이러한 뇌 및 신경계 장애에는 조울증(BD), 조현병(SCZ), 우울증, 주의력결핍/과잉행동장애(ADHD), 강박장애(OCD), 불안장애 등과 같은 정신질환과 자폐증, 아스퍼거 증후군, 이외의 자폐 스펙트럼 장애(ASD) 및 이외 달리 명시되지 않은 만연한 발달 장애(PDD-NOS) 등의 신경발달 장애를 포함한다.
3. WO2017046203A1, Novel Circular RNA Biomarkers for Heart Failure (심부전증을 위한 새로운 circRNA biomarker) : 미국, 출원번호; 16618601 (2018.06.01) [9]
- 상기 방법은 심근경색 이후의 심부전 발생에 대한 새로운 biomarker로써의 circRNA를 기술한다. 심부전의 예측 및 진단 방법은 하나 이상의 circRNA 측정을 기반으로 한다.
*마케팅 전략 제시
Circular RNA의 표적특이성을 이용해 종양과 같은 질병을 직접적으로 치료하거나, 약물의 내성을 조절해 기존 치료제의 효과를 보조하는 것을 목적으로 개발한다. 또한 현재까지 빠른 진단이 힘들었던 질병들을 분자 수준에서 빠르게 진단하는 것을 목표로 개발한다.
개발과제의 기대효과
기술적 기대효과
- Circular RNA를 이용한 치료제는 기존 RNA 치료제의 불안정성을 극복하며, chemical modification과 drug delivery system을 활용해 target cell로의 전달 효율을 높일 수 있으며, 현존하는 RNA 치료제 중 가장 안정적일 것으로 기대된다.
- 기술적으로 조기에 진단이 어려운 암이나 기타 질병에 분자 단위의 빠른 접근이 가능해진다.
- 안정도가 큰 circRNA를 이용한 백신 연구를 통해 생체 내에서 안정적으로 기능할 수 있는 RNA 백신 개발 가능성 증대된다.
- 현재 척추암과 같이 물리적인 시술로만 치료가 가능한 질병들을 circRNA 치료제의 단백질 발현 조절로 비수술적 치료법을 기대할 수 있다.
경제적, 사회적 기대 및 파급효과
- circRNA degredation을 막기 위한 별도의 adjuvant를 첨가하지 않은 안정적인 치료제 개발이 가능할 것이다.
- 기존의 mRNA 백신의 장점에 더해 2021년 현재와 같은 범유행전염병에 대한 효과적인 대응책을 마련할 수 있을 것으로 기대된다.
- 현재까지 진단이 늦어 치료하기 힘들었던 질병들을 빠르게 치료할 수 있어, 이러한 질병을 가진 환자들, 특히 정신질환자들에 대한 사회적인 인식이 나아질 수 있을 것으로 예상한다.
- 또한 각종 암 진단에서도 사용할 수 있는 이점이 있어 CT 및 MRI등 기구를 사용하지 않고 질병의 진단 및 치료에 도움될 수 있다.
기술개발 일정 및 추진체계
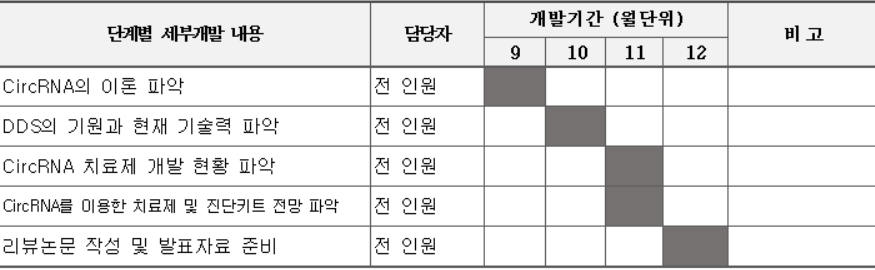
개발 일정
구성원 및 추진체계
- 연구 주제 및 연구 계획 설정(전 인원)
- CircRNA의 이론 파악(전 인원)
- DDS의 기원과 현재 기술력 파악(전 인원)
- CircRNA 치료제 개발 현황 및 전망 파악(전 인원)
- CircRNA 치료제 개선 사항 연구(전 인원)
- 리뷰논문 작성 및 발표자료 준비(전 인원)
설계
설계사양
제품의 요구사항
circRNA는 RNA의 종류 중 하나로 이름처럼 원 형태의 구조를 가지고 있다. mRNA의 두 말단인 3`과 5`를 연결해 원형이 된 것으로, 반응성이 큰 말단이 서로 결합했기 때문에 mRNA보다 안정적인 특징이 있다. 그렇기 때문에 mRNA를 대신해서 circRNA를 각종 치료제나 백신 등에 응용하려는 연구가 활발히 진행되고 있다. 하지만 단점 역시 존재하는데, 예를 들어 바이러스에 감염된 사람에게 투여했을 시 circRNA가 세포 내부에서 ribonuclease에 의해 쉽게 분해될 수 있다. 이러한 단점을 보완하기 위해 circRNA를 endoribonuclease로부터 보호하는 방법을 고안해본다.
설계 사양
circRNA의 사용애 있어 발생하는 단점을 보완하기 위한 m6a modification 기술에 관해 문헌조사하였다.
개념설계안
circRNA의 보호를 위해 논문을 찾아본 결과 현재 "m6A-modification"이 활발하게 연구되는 것을 알 수 있었다. 이 외에도 "IL-6" 또는 "Ribonuclease Inhibitor(RI)"를 이용한다면 circRNA의 분해를 막을 수 있을 것이다.
상세설계 내용
- 2.1. Main idea(m6a modification)
- 2.1.1. mechanism of m6a modification[15]
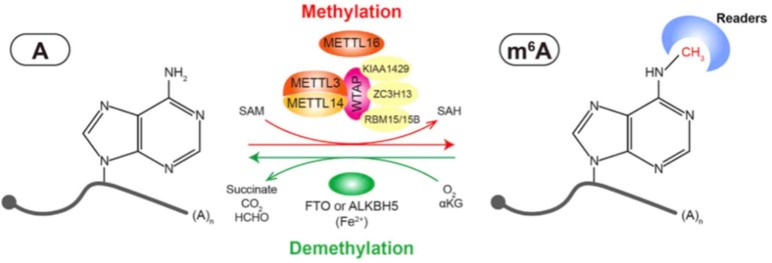
circRNA degradation을 방지하기 위한 전략으로 endogenous RNA는 면역 반응을 하지 않는다는 것에 착안한다. Exogenous circRNA(이하 circFOREIGN)의 경우, m6a modification 인식에 의해 innate immunity가 발현된다. 여기서, m6a는 N6-methyladenosine의 줄임말로, DNA의 아데노신의 NH2기가 메틸기로 치환된 형태다.
M6a는 RNA가 자가세포에서 유래된 것인지, 외부에서 유입된 것인지를 결정하는 기준이 된다. 체내에서 생성된 circRNA는 METTL(m6a writer)에 의해 m6a 표지를 가진다. YTHDF 단백질(m6a reader)이 m6a를 인식하고, endogenous RNA에 대한 별도의 면역반응을 거치지 않는다. 반면, circFOREIGN은 in vitro에서 bacteriophage를 통해 합성되기 때문에 methylation 과정이 없다. 따라서 m6a가 없으므로 m6a reader가 인식하지 못하고 RIG-1 단백질이 발현된다. RIG-1단백질은 antiviral gene을 활성화시켜 체내 면역을 개시한다. 따라서 결과적으로 circFOREIGN을 외부 물질로 인식해 분해하게 된다.
- 2.1.2. Experimental results
A의 왼쪽 그림은 circFOREIGN의 임의의 adenine을 m6A-modification하였을 때의 예상 모델이다. m6A가 exogenous RNA에 표지되면, 면역 반응이 일어나지 않을 것으로 추측된다. 오른쪽 그래프는 실제로 Wild Type의 HeLa cell에 각각의 시료를 투여했을 때, 면역 반응 관련 유전자의 발현 정도를 나타낸 것이다. RIG-1, MDA5, OAS, OASL, PKR은 모두 exogeneous RNA 바이러스 항원에 대응하는 면역 반응 유전자들이다. 100% m6A로 modification한 circFOREIGN은 endogenous RNA와 거의 유사하게 면역반응이 매우 적은 것을 볼 수 있다. (이는 원래 체내의 circRNA와 구분이 거의 불가능함을 알 수 있다.) 1%만 modification한 circFOREIGN의 경우에도 눈에 띄게 면역반응이 감소함을 보여준다. 이는 m6A modification이 circFOREIGN 구분에 있어 매우 중요한 역할을 한다는 것을 알 수 있다. B는 이러한 modification이 무작위의 위치가 아닌 특정 부위에서 일어난다는 것을 시사한다. 대표적인 modification region인 RRACH를 RRUCH로 mutation시킨 결과, 면역 반응이 기존 circFOREIGN에 비해 거의 두배로 증가한 것을 보인다. C는 RRACH의 sequence의 중요성이 아닌 특정 sequence에 존재하는 “A”의 중요성을 보여준다. circFOREIGN의 모든 A를 U로 치환시킨 결과, 면역 반응이 기존 circFOREIGN에 비해 증가했음을 보인다. D와 E는 각각 m6A modification을 적용하였을 때, T cell의 면역 반응과 antibody의 면역 반응이 모두 떨어짐을 보여준다. 이러한 실험 결과들을 바탕으로, 필요한 circRNA 치료제를 제조할 때 m6A modification을 적용한다면 우리의 치료제가 체내에서 면역반응에 의해 제거되지 않을 것이다.
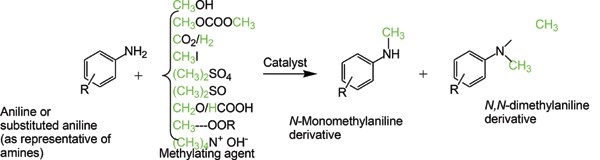
- 2.1.3. Synthesis of m6a modified circRNA
m6A modification의 장점을 알았다면, 이제 우리가 제작하고 싶은 circRNA 백신에 이러한 처리를 할 수 있어야 한다. 체내에서는 위에서 제시한 m6A 생성과정 그림처럼 METTL series와 WTAP 등의 수 많은 효소들이 작용하여, 만들어진 RNA에 후처리를 하게 된다. 그러나 이러한 방법은 in vitro에서 sequencing을 하는 circRNA 치료제에는 많은 효소를 추출하고 정제해야하므로 매우 비효율적인 과정이다. 다른 방법으로는 이미 제작한 circRNA에서 위 그림과 같은 화학 반응을 일으켜 NH2에 methyl기를 치환시키는 방법이 있다.[16] 그러나 이러한 방법은 우리에게 필요하지 않은 dimethyl amine이 만들어질 수 있다. 또한 원하는 위치의 amine기 뿐만 아니라 원하지 않는 다른 염기의 amine기에도 methyl기를 치환시킬 수밖에 없으므로 좋은 방법이 아니다. 가장 이상적인 방법은 sequencing을 하기 전에 기존의 adenosine과 함께 m6A를 사용하는 방법이라 생각한다. 실제로 adenosine에는 amine기는 하나뿐이어서 생산하기 편하고, sequencing을 하기 전이라면 dimethyl기와 같은 불순물은 제거할 수 있을 것이다. 또한 실제로 몇몇 biomaterial 기업에서는 m6A를 lab을 대상으로 판매도 하고 있다. 그러므로 적절한 비율로 adenosine과 m6A를 사용하여 circRNA를 제작한다면 면역반응을 어느 정도 회피할 수 있을 것이다.
- 2.1.4. Discussion(Limit)
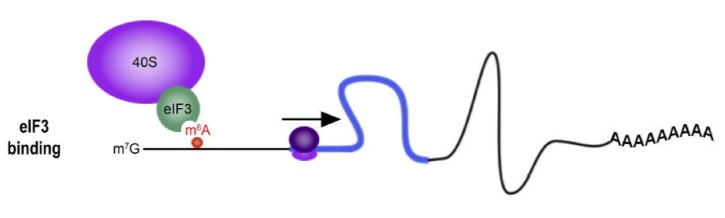
이러한 m6A modification에는 여러 단점이 존재한다. Endogenous RNA의 경우에는 5’-UTR이나 poly A tail과 같은 특정 위치에서 m6A modification이 일어나는 반면, in vitro에서 circRNA를 제작할 경우에는 무작위하게 modification이 일어난다. 위 그림에서는 이러한 문제로 sequence 전부를 m6A로 치환하거나, 1%만 치환하여 면역반응에 영향을 미치는 지 여부에 중점을 두었다. 이러한 modification이 면역반응에 영향을 미치는 것은 분명하나, m6A의 위치에 따라 그 효과가 달라질 가능성이 있다. Methylation의 또 다른 역할로는 이것이 UTR에 존재할 경우에는 gene translation을 촉진하는 역할을 하지만, 우리가 원하는 gene의 내부에 존재한다면 유전자 발현을 억제하는 부작용이 있어 백신으로써의 효과가 떨어질 수 있다.[17] 이는 UTR 조각을 m6A를 사용하여 제작한 후, 이를 기존의 circRNA에 삽입하는 방법으로 우리가 필요한 gene이 methylation 되는 것을 막을 수 있을 것이다.
두 번째 문제는 우리의 체내에 exogenous RNA의 m6A만을 인식하여 분해하는 기전이 있다는 것이다.[18] 체내에는 m6A modification을 인식하는 YTHDF2라는 단백질이 존재한다. 이는 위에서 언급한 endogenous RNA를 식별하는 과정에서 제일 첫 번째 interaction을 하는 매우 중요한 단백질이다. 그러나 이 단백질과 함께, exogenous RNA에 “GGUUC”와 같은 특정 sequence가 존재한다면 일련의 과정을 통해 endonuclease인 RNase P/MRP complex가 작용하여 이 RNA를 분해한다. 또한 이러한 일련의 과정이 어떻게 exogenous RNA와 endogenous RNA를 구분하는지에 대해 아직 밝혀지지 않은 것이 가장 큰 문제이다.
- 2.2. Sub idea
- 2.2.1. IL-6
circRNA의 또다른 단점으로는, 바이러스에 감염된 포유류에 circRNA를 주입하여도 그 농도가 감소할 수 있다는 점이 있다.[14] 이는 바이러스에 감염된 경우, poly(I:C)가 RNase를 유도하게 되고 RNase가 circRNA를 분해하기 때문이다. 아래 사진에서 볼 수 있듯이 다종의 circRNA가 poly(I:C) treatment에 의해 degradation되었음을 확인할 수 있다. 바이러스에 감염되었을 때 mRNA가 endonuclease에 의한 degradation을 어떻게 피하는지에 대한 문헌으로부터 circRNA의 개선방안에 대한 힌트를 얻었다. lytic Kaposi's sarcoma-associated herpesvirus(KSHV) infection의 경우, viral endonuclease인 SOX가 messenger RNA(mRNA)를 degradation시킨다. 메커니즘은 아직 밝혀지지 않았지만, IL-6(Interleukin 6) mRNA는 SOX에 의한 degradation을 회피하는 것으로 연구결과가 나타났고, 작용 매커니즘에 대한 연구를 통해 circRNA로의 응용법을 연구한다면 유망한 결과가 예상된다.
- 2.2.2. Ribonuclease Inhibitor
마지막으로 Ribonuclease inhibitor(RI)를 사용하는 방법이 있다.[19] RI는 ribonuclease와의 affinity가 매우 높다. RI는 1952년 기니피그 간에서 최초로 추출되었고 그 기능에 대한 연구가 시작되었다. RI는 pI값이 4.7로 ribonuclease와 결합하는 protein이다. RI는 RNase A superfamily를 저해시키며, 저해받는 대표적인 단백질은 RNase1, RNase2, RNase4 등이 있다. RI와 결합된 ribonuclease는 더 이상 RNA에 부착되어 분해할 수 없다. 사람, 돼지, 쥐의 RI가 가진 아미노산 서열은 66% 일치한다. 즉 1/3의 서열에 따라 다른 구조를 가지며, 지금까지 연구된 결과로 사람과 돼지가 가진 RI는 매우 유사한 서열을 나타낸다. RI와 ribonuclease(논문에서는 ANG을 사용)가 가지는 affinity에 대해 알아본다. Nuclease(E)와 RNA(S)가 결합하는 과정을, 효소-기질 반응이라 생각할 수 있다. 이 때, RI(I)는 inhibitor로 작용하여 nuclease가 RNA에 결합하는 것을 막으며 효소-저해제 복합체(E•I)를 형성한다. 효소-저해제 복합체는 isomerization을 통해 안정성을 높이고 (E•I*)를 이룬다. (식 1)
- (식 1)
이 때, 첫번째 반응의 평형상수(K1=k-1k1)는 0.53μM이며, 두번째 반응(97s-1)에 의해 isomerization된다. RI와 nuclease 복합체를 기준으로 다시 떨어지는 것보다 isomerization되는 것이 더 안정적인 것을 알 수 있다. 이 때 association rate constant는 1.8×108 M-1s-1이며, dissociation rate constant는 1.3×10-7 s-1이다. 이를 통해 dissociation constant를 계산하면 7.1×10-16 M으로 매우 낮은 값을 가진다. 일반적으로 효소와 기질이 결합할 때 dissociation constant가 10-6단위, receptor와 ligand는 10-9이다.[20] 이와 비교했을 때 RI와 ribonuclease의 결합은 매우 잘 결합하는 것을 알 수 있으며, 이 때 RI와 ribonuclease의 복합체의 반감기는 62일이다. 이처럼 RNase와 결합해 dissociation constant가 매우 작은 RI를 사용한다면, circRNA가 RNase L에 의해 분해되는 속도를 감소시킬 수 있을 것이다. 하지만 치료가 끝난 후, RI와 nuclease의 결합을 풀어줘야하는 것은 남은 해결과제라 할 수 있다. 다른 논문을 참고할 경우[21], HIV에 감염된 환자의 경우 RNase L의 활성이 낮다고 설명한다. HIV에 감염된 환자는 외부 antigen에 대해 저항하는 능력이 없기 때문에 RNase L의 활성이 낮을 것이라 생각한다. 따라서 에이즈 환자에게 circRNA를 활용한 치료제를 사용할 경우 RI의 첨가로 인한 side effect를 고려하지 않고 사용할 수 있을 것이라 생각한다.
결과 및 평가
완료 작품의 소개
본 연구에서는 circRNA가 치료제로서 사용될 때 degradation되는 것을 막기 위한 m6a modification에 대해 문헌조사하였다. m6a는 RNA가 자가세포에서 유래된 것인지, 외부에서 유입된 것인지를 결정하는 기준이 되어 체내에서 면역반응을 조절하고, 실험에서 m6a modification된 경우에 면역반응이 감소됨을 확인하였다. 이러한 m6a modification을 백신, 치료제 등에 적용하는 과정에 대해서도 문헌조사하였다. 가장 이상적인 방법은 sequencing을 하기 전에 기존의 adenosine과 함께 m6A를 사용하는 방법이었다. 실제로 adenosine에는 amine기는 하나뿐이어서 생산하기 편하고, sequencing을 하기 전이라면 dimethyl기와 같은 불순물은 제거할 수 있어 단점을 보완할 수 있다. 또한 실제로 몇몇 biomaterial 기업에서는 m6A를 lab을 대상으로 판매도 하고 있다. 그러므로 적절한 비율로 adenosine과 m6A를 사용하여 circRNA를 제작한다면 면역반응을 회피하는 cirRNA 치료제를 개발할 수 있다.
포스터
완료작품의 평가
이번 연구를 통해 circRNA를 치료제로 사용하는 과정에서 발생할 수 있는 문제점과 그 해결책에 대해 알아보았다. 3’ 및 5’ 말단을 제거해 기존의 mRNA보다 안정성을 높였지만, cell 내부의 endonuclease에 의해 분해될 수 있는 문제점이 있다. 이를 해결하기 위해 m6A modification, IL-6 모방, RI를 추가로 처리하는 방법이 있다. IL-6와 RI는 cell 내부에서 endonuclease로부터 보호하는 역할을 수행할 수 있을 것이다. 하지만 정확한 매커니즘이 밝혀지지 않았고 circRNA의 보조제로서 첨가하기 때문에 어떤 side effect를 가져올지 알 수 없다. 따라서 circRNA 자체를 자가 물질로 인식하도록 해 면역을 억제하는 modification 방법에 대해 집중적으로 조사했다. 실험 결과, 세포가 m6a를 외부물질로 인식하지 못해 면역발현이 감소하는 효과를 나타냈다. 선택적으로 RNA를 methylation 하지 못한다는 한계가 있지만, ATP를 먼저 methylation 한 후 m6ATP와 ATP로 circRNA를 합성한다면 선택적으로 면역 발현도를 줄일 수 있을 것으로 예상된다.
향후계획
exogenous RNA에 특정 sequence가 존재한다면 endonuclease가 작용해서 외부 circRNA의 m6A만을 인식해서 분해하는 기전이 있는데, 이 때 어떻게 외부 circRNA를 구분하는지 아직 밝혀지지 않았다. 이 부분에 대한 연구가 추가적으로 필요할 것으로 보인다.
참고 문헌
[1] Jinwen Zhu , Xinliang Zhang , Wenjie Gao, Huimin Hu, Xiaodong Wang, Dingjun Ha: lncRNA/circRNA‑miRNA‑mRNA ceRNA network in lumbar intervertebral disc degeneration. Molecular Medicine REPORTS 20: 3160-3174, 2019.
[2] Si Qin , Yue Zhao , Gwanyong Lim , Hongjing Lin , Xueli Zhang , Xiaohong Zhang, Circular RNA PVT1 acts as a competing endogenous RNA for miR-497 in promoting non-small cell lung cancer progression, Biomed Pharmacother. 2019 Mar;111:244-250.
[3] Xia Li, Yi Liu, Xiangxin Zhang, Jun Shen, Renjie Xu, Yubo Liu, and Xiao Yu, Circular RNA hsa_circ_0000073 contributes to osteosarcoma cell proliferation, migration, invasion and methotrexate resistance by sponging miR-145-5p and miR-151-3p and upregulating NRAS, Aging (Albany NY). 2020 Jul 31; 12(14): 14157–14173.
[4] Vermaelen K. Vaccine Strategies to Improve Anti-cancer Cellular Immune Responses. Front Immunol. 2019;10:8. Published 2019 Jan 22. doi:10.3389/fimmu.2019.00008
[5] Xinzhu Sun, Dongyan Liu, Nan Ge, Jintao Guo, Sheng Wang, Xiang Liu, Guoxin Wang, …Siyu Sun(2021). Recent Advances in the Potential Use of Circular RNA for the Diagnosis and Treatment of Pancreatic Cancer. Cancer Management and Research, 13, 4251-4262.
[6] Xucheng Hou, Tal Zaks, Robert Langer, Yizhou Dong(2021). Lipid nanoparticles for mRNA delivery. Nature Reviews Materials,
[7] Nikolaus Rajewsky, Sebastian Memczak, Panagiotis Papavasileiou, A METHOD FOR DIAGNOSING A DISEASE BY DETECTION OF circRNA IN BODILY FLUIDS, https://patents.google.com/patent/US20180282809A1/en
[8] Nikolaos MELLIOS, Circular rnas for the diagnosis and treatment of brain disorders, https://patents.google.com/patent/US20210079474A1/en
[9] Yvan Devaux, Melanie Vausort, Lu Zhang, Biomarkers for heart failure, https://patents.google.com/patent/WO2017046203A1/ja
[10] iBiology (2015) Robert S. Langer (MIT) Part 1: Advances in Controlled Drug Release Technology: An Overview. https://www.youtube.com/watch?v=O3KccVX574s
[11] Peerzada Tajamul Mumtaz, Qamar Taban, Mashooq Ahmad Dar, Shabir Mir, Zulfkar ul Haq, Sajad Majeed Zargar, Riaz Ahmad Shah, Syed Mudasir Ahmad (2020) Deep Insights in Circular RNAs: from biogenesis to therapeutics, p1
[12] Ling-Ling Chen, Li Yang (2015) regulation of circRNA biogenesis, p383-386
[13] Weiwei Zheng, Qing Chu,Liyuan Yang, Lingping Sun, Tianjun Xu (2021) Circular RNA circDtx1 regulates IRF3-mediated antiviral immune responses through suppression of miR-15a-5p-dependent TRIF downregulation in teleost fish, p19
[14] Liu, Chu-Xiao, et al. "Structure and degradation of circular RNAs regulate PKR activation in innate immunity." Cell 177.4 (2019): 865-880.
[15] Y. Grace Chen, et al. (2019) N6-Methyladenosine Modification Controls Circular RNA Immunity, M olecular Cell 76, 96-109.
[16] Saad Moulay (2019) N-Methylation of Nitrogen-Containing Organic Substrates: A Comprehensive Overview, Current Organic Chemistry, 23(16) 1695-1737
[17] Kate D. Meyer (2019) m6A-Mediated Translation Regulation, Biochim Biophys Acta Gene Regul Mech. 1862(3), 301-309.
[18] Yingli Guo, et al. (2020) Structure-Mediated Degradation of CircRNAs, Trends in Cell Biology 30(7), 501-503.
[19] Kmberly A.Dickson, Marcia C.Haigis, Ronald T. Raines, Ribonuclease Inhibitor: Structure and Function, Prog Nucleic Acid Res Mol Biol. 2005, Jan
[20] Mike Wiliamson, how proteins work, Garland Science, p78
[21] RNase L Inhibitor Is Induced during Human Immunodeficiency Virus Type 1 Infection and Down Regulates the 2-5A/RNase L Pathway in Human T cells, Camille Martinanad, Celine Montavon, Tamim salehazada, Michelle silhol, Bernard Lebleu, and Catherine Bisbal, Journal of Virology, 1999, Jan p290-296